活性氧在肿瘤顺铂耐药中的作用研究进展
2022-02-15岑铠丽荚耘路
岑铠丽,陈 明,荚耘路,沈 朋
(浙江大学医学院附属第一医院肿瘤内科,浙江 杭州 310000)
顺铂是一种具有抗癌活性的金属铂类配合物。自1978年在美国批准上市后,被广泛应用于胃癌、卵巢癌和肺癌等多种实体肿瘤的治疗[1]。但在治疗过程中,大多数患者出现顺铂耐药,不仅影响了顺铂的疗效,还成为肿瘤复发的主要原因[2]。因此,明确顺铂耐药的机制有助于研发新药,改善临床治疗手段。
氧化应激是顺铂发挥抗肿瘤效应的主要机制之一。顺铂不仅能够结合并消耗细胞内的还原性物质,而且能与线粒体DNA形成络合物,导致线粒体功能紊乱,活性氧(reactive oxygen species,ROS)产生增加,从而诱导氧化应激,最终导致细胞死亡[2]。然而,肿瘤在不断接受顺铂刺激并最终演变成耐药细胞的过程中,ROS代谢异常与顺铂耐药的发生密切相关。一方面,顺铂耐药细胞通过促进顺铂外排、减少ROS产生、增加谷胱甘肽等还原物质合成等降低顺铂诱导的氧化应激,增强其对顺铂的抵抗。另一方面,细胞内ROS还参与调控顺铂作用的多个环节,包括顺铂的转运、DNA损伤修复和信号通路等。本综述将对顺铂耐药肿瘤中的ROS代谢特点以及ROS对顺铂耐药的调控机制进行阐述,并总结目前基于ROS代谢的治疗策略,为提高顺铂的临床疗效提供参考。
1 顺铂耐药肿瘤中的活性氧代谢
1.1 活性氧概述
ROS是氧分子衍生物的统称,包括单线态氧、过氧化氢(H2O2)、羟自由基、超氧阴离子、一氧化氮和过氧亚硝基阴离子等[3]。在真核生物中,超氧阴离子往往是ROS的最初形式,但其性质不稳定,易转化成相对较稳定、长效的H2O2。因此,H2O2是细胞内最主要的ROS形式[4]。正常情况下,细胞内的ROS能够维持在较低的生理水平,调控细胞增殖、迁移和血管生成等活动[5]。但当细胞内ROS含量大幅度增加,远超过细胞的生理水平以及代偿范围时,就会导致核酸和蛋白质等发生氧化变性,导致细胞死亡[6]。
为维持氧化还原的动态平衡,细胞内存在多种抗氧化系统,主要包括:①谷胱甘肽(glutathione,GSH)系统。GSH由谷氨酸、半胱氨酸和甘氨酸合成,是细胞内最丰富的还原性物质[4],其与谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)、谷胱甘肽还原酶(glutathione reductase,GR)以及NADPH共同组成了GSH还原系统。在GPx的作用下,还原型GSH提供电子转化为氧化型谷胱甘肽(GSSG),同时,H2O2被还原生成水。而GSSG又能在GR的作用下,由NADPH提供电子,重新生成GSH[6]。② 硫氧还蛋白(thioredoxin,TRX)系统。TRX是小蛋白抗氧化剂,其与TRX还原酶(TRX reductase,TrxR)和NADPH组成硫氧还蛋白系统,在生物中高度保守[7]。还原型TRX将H2O2还原成水,生成的氧化型TRX又能够在TrxR作用下,由NADPH提供电子,重新还原成还原型TRX[8]。
1.2 顺铂作用下肿瘤细胞中ROS来源
1.2.1 线粒体电子传递链
目前研究认为,在多种类型的肿瘤细胞中,顺铂诱导的ROS主要来源于线粒体电子传递链。Marullo等[9]发现,在线粒体DNA缺失的前列腺癌细胞中,顺铂诱导ROS生成的能力明显下降,同时该类肿瘤对顺铂的敏感性也减弱。Kleih等[10]在卵巢肿瘤中发现,顺铂能够通过促进线粒体生成来提高线粒体ROS水平,而用寡霉素A(ATP合酶抑制剂)抑制线粒体氧化磷酸化,能够有效降低线粒体ROS水平以及顺铂的细胞毒性。表明线粒体电子传递链在顺铂诱导的氧化应激中发挥了重要作用。
1.2.2 NADPH氧化酶
NADPH氧化酶(NADPH oxidase,NOX)也是顺铂作用下细胞内ROS的重要来源[11]。研究表明,NOX蛋白家族由NOX1~NOX5及双氧化酶1和双氧化酶2组成,它们能够利用供体NADPH将其电子传递给分子氧,从而生成超氧阴离子[5]。然而,NOX表达具有组织特异性。如,NOX2在肺泡上皮组织中高表达,介导顺铂作用下肺癌细胞内ROS产生[12]。而胶质瘤组织中则高表达NOX4,通过提高细胞内ROS促进肿瘤对顺铂的应答[13-14]。
1.3 顺铂耐药肿瘤中ROS的代谢异常
在顺铂治疗过程中,肿瘤细胞会逐渐适应并调整细胞内的ROS代谢活动,最终导致顺铂耐药。研究发现,在顺铂耐药的肿瘤中,顺铂诱导ROS的能力明显下降[15]。可归结于以下3个方面机制。
1.3.1 胞内顺铂的累积减少
目前为止,多种顺铂转运体被相继报道,它们能够参与顺铂的跨膜运输。按功能可分为摄取型和外排型2类。
铜离子转运体 1(copper transporter 1,Ctr1)是细胞摄取铜离子的主要转运体,也是肿瘤细胞主动摄取顺铂的主要转运体[16]。在顺铂耐药的卵巢肿瘤中,Ctr1蛋白不仅表达下降,且易发生核心岩藻糖基化修饰,导致其对顺铂的摄取能力降低[17-19]。ATP7A和ATP7B是P-型铜外排ATP酶,被证明能够分别介导早期和晚期顺铂外排活动[20-21]。在部分顺铂耐药的肿瘤中存在ATP7A和ATP7B高表达,与其耐药特性密切相关[22-23]。此外,ATP结合盒(ATP-binding cassette,ABC)转运蛋白家族成员中的ABCB1、ABCC1和ABCG2等,亦被证明参与顺铂等化疗药物的外排,与肿瘤的多药耐药相关[24]。
摄取型转运体减少,外排型转运体增加,导致肿瘤细胞内顺铂累积减少,氧化应激诱导受限,是介导顺铂耐药的重要机制之一[2]。
1.3.2 ROS生成减少
线粒体和NOX作为细胞内ROS的主要来源,其含量以及功能异常会直接影响顺铂诱导下ROS的产生,调控肿瘤耐药。Kleih等[10]发现,相较于亲本细胞,顺铂耐药的卵巢肿瘤细胞线粒体含量明显减少,同时在顺铂刺激下产生ROS的能力也明显下降。在顺铂耐药的骨肉瘤中,DNA脱嘌呤或嘧啶位点核酸内切酶在线粒体中富集,它通过抑制小GTP结合蛋白RAC1磷酸化,从而减少线粒体ROS的产生[25]。此外,在顺铂耐药的卵巢肿瘤和肺癌中,极性蛋白scribble表达减少,其能够通过富含亮氨酸的重复片段结构域与NOX2结合,防止NOX2被蛋白酶体降解[25]。Pan等[26]发现,在多种肿瘤细胞系中,肌醇-三磷酸3-激酶B的蛋白表达水平与肿瘤对顺铂的耐受程度呈正相关。机制上,其代谢产物肌醇1,3,4,5-四磷酸盐能够竞争性结合并抑制NOX4的活性,从而减少ROS的产生。
1.3.3 还原性物质增加
肿瘤细胞内还原性物质增加,也是导致ROS代谢异常的重要原因。核转录因子红系2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)是细胞内重要的抗氧化组分,其在肿瘤细胞中的高表达被证明与顺铂耐药密切相关[27-28]。作为转录因子,Nrf2能够促进多种抗氧化相关基因的转录,如过氧化氢酶和超氧化物歧化酶等,缓解细胞内的氧化应激,从而削弱顺铂的抗肿瘤效应[29]。GPx是机体内广泛分布的过氧化物分解酶,能通过催化GSH,将有毒的过氧化物还原为无毒的羟基化合物[30]。研究表明,GPx1[31]和 GPx2[32]在顺铂耐药的肺癌细胞系中高表达,通过降解细胞内的ROS来介导肿瘤对顺铂耐药。溶质载体蛋白家族7成员A11(solute carrier family 7 member 11,SLC7A11)是细胞氨基酸转运系统Xc-的功能性亚基,介导细胞对胱氨酸的摄取,参与胞内GSH的合成。研究表明,顺铂耐药的胃癌细胞高表达SLC7A11,采用柳氮磺吡啶(SLC7A11抑制剂)能够明显提高肿瘤细胞内ROS水平,降低GSH水平,增加细胞对顺铂的敏感性[33]。谷胱甘肽 S 转移酶(glutathione S-transferase,GST)是GSH合成的关键酶。在顺铂耐药的肿瘤细胞中,GST活性明显提高,敲减GST能够降低肿瘤对顺铂的耐药[34]。H-铁蛋白亦是抗氧化系统的重要组成成分,它能够包裹细胞内铁,从而抑制铁离子介导ROS产生[35]。Salatino等[36]发现,H-铁蛋白在顺铂耐药的OVCAR3卵巢癌细胞中表达增加,表明其参与了肿瘤顺铂耐药的调控。
2 活性氧调控肿瘤顺铂耐药的机制
目前研究认为,ROS是肿瘤进展过程中的一把双刃剑。一方面,ROS是多种化疗药物发挥抗肿瘤效应的主要机制之一[37],另一方面,ROS能够调节顺铂作用的诸多环节,如上调顺铂转运体的表达、增强细胞DNA损伤修复能力、提高Nrf2和低氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)的蛋白水平和转录活性以及调控线粒体动态活动等,最终影响肿瘤的耐药进程。
2.1 上调顺铂转运体表达
研究表明,在非小细胞肺癌中,限糖[38]和表没食子儿茶素没食子酸酯[39]能够通过增加细胞内ROS上调Ctr1蛋白表达,从而促进顺铂在胞内的累积,增加肿瘤对顺铂敏感性。然而,同样也是在非小细胞肺癌,高表达的EF手域家族成员D2则通过上调NOX4/ROS/ABCC1通路来促进顺铂外排,从而介导顺铂耐药[40]。低氧条件诱导的ROS则能通过提高HIF-1α水平,促进ABCB1和ABCC1转录,促进顺铂的外排[41]。此外,在头颈部鳞癌中,跨膜蛋白16A(Ca2+激活的氯离子通道)能够通过上调NOX2来促进提高细胞内ROS,后者能够上调ATP7B表达,减少顺铂的胞内累积,介导顺铂耐药[42]。以上研究表明,细胞内ROS对顺铂转运体的调控可能受多种因素影响,如刺激的种类、肿瘤细胞品系、细胞内ROS升高幅度、持续时间及ROS产生的部位。
2.2 增强细胞DNA损伤修复能力
DNA损伤应答包括细胞对损伤的感知、信号的转导以及修复或者死亡程序的执行等多个过程[43]。应答初期,损伤信号能够招募并激活共济失调毛细血管扩张突变蛋白[44]、共济失调毛细血管扩张突变和RAD3相关蛋白(ataxia telangiectasia-mutated and Rad3 related factor,ATR)等损伤识别蛋白[45],通过细胞周期检测点激酶1(checkpoint kinase1,Chk1)和Chk2等转导损伤信号,调控细胞周期检查点蛋白活性,导致细胞周期阻滞[46]。与此同时,多种修复程序,包括核苷酸切除修复、同源或非同源重组修复等启动,开始修复损伤的DNA。若DNA损伤被修复,细胞则重新进入细胞周期;但当DNA损伤超过了自身的修复能力,损伤信号持续存在,Chk1/Chk2能够通过激活p53等下游信号,启动细胞死亡相关程序[47]。因此,ROS对细胞命运的调控也受细胞本身损伤修复能力的影响。一方面,ROS能够介导多种理化因素,如电离辐射及蒽环类和顺铂等化疗药物对细胞DNA造成不可逆损伤,直接导致细胞死亡[48]。另一方面,ROS也能通过激活细胞内DNA损伤应答,启动多种修复相关程序,从而维持基因组的完整性[49]。在卵巢肿瘤中,ROS能够通过激活ATR/Chk1通路,促进DNA损伤修复,从而介导对顺铂耐药[50]。在结肠癌和肝癌中,ROS也能够通过激活组蛋白去乙酰化酶,使尿嘧啶DNA糖苷酶2上第78位赖氨酸去乙酰化,减少其被泛素化降解,而后者则能够切除DNA分子上错误形成的胞嘧啶碱基,是碱基切除修复的重要组分[51]。此外,ROS还能够通过促进RNA去甲基化酶ALKB同源蛋白5类泛素化,从而抑制其功能,导致细胞整体mRNA m6A水平增加,促进DNA修复相关基因表达,以保持基因完整性[52]。
2.3 提高Nrf2蛋白水平和转录活性
Nrf2是细胞内抗氧化系统的重要组成之一。正常情况下,Nrf2与Keap1-cullin3-E3泛素连接酶复合体结合,通过蛋白酶体系统降解,维持在低水平稳态。但当细胞内ROS水平提高时,Nrf2与复合体解离,入核并启动下游基因的转录[37]。Nrf2异常表达与肿瘤顺铂耐药密切相关,抑制Nrf2也被认为是克服肿瘤顺铂耐药的治疗手段。在非小细胞肺癌中,高表达的孕激素和脂联素分子受体家族4能够通过抑制Nrf2与Keap1结合,从而促进Nrf2入核转录NADPH醌氧还原酶1、谷氨酸-半胱氨酸连接酶重链亚基及修饰亚基、GR和TrxR等抗氧化蛋白,增强肿瘤对顺铂的耐受[53]。此外,丝裂原活化蛋白激酶磷酸酶1能够与Nrf2结合并抑制其被泛素化降解,从而促进细胞内GSH合成,提高细胞糖酵解代谢,增加肿瘤细胞对顺铂的耐受[54]。在顺铂耐药的胃癌细胞中,转录激活因子3低表达与肿瘤的不良预后相关,而过表达转录激活因子3则能通过抑制Nrf2/Keap1/SLC7A11通路而增加肿瘤对顺铂的敏感性[55]。此外,Nrf2还能够通过调控顺铂转运蛋白 ABCG2[56]和 ABCB1[57]影响肿瘤对化疗药物的敏感性。
2.4 提高HlF-1α蛋白水平和转录活性
在血管平滑肌细胞中,ROS能够降低细胞内的抗坏血酸盐,而后者能够增加HIF-1α脯氨酰羟化酶活性,促进HIF-1α降解[58]。此外,在结肠癌中,溶质载体蛋白家族34成员A2(solute carrier family 34 member 2,SLC34A2)对HIF-1α表达的调控也依赖于ROS,使用抗氧化剂丁基羟基茴香醚能够下调SLC34A2过表达的结肠癌细胞中HIF-1α的蛋白水平[59]。而作为转录因子,HIF-1α能够促进多种耐药相关基因转录。在结肠癌中,HIF-1α能够通过转录Zeste基因增强子人类同源物2来介导结肠癌对顺铂的耐药[60]。此外,在膀胱癌中,HIF-1α被证明能够通过促进miR-424转录来抑制UNC5同源家族B和去乙酰化酶4的表达,从而降低肿瘤细胞对顺铂的应答[61]。免疫球蛋白样和上皮生长因子样域酪氨酸激酶1(tyrosine kinase with immunoglobulin-like and EGF-like domains 1,Tie1)曾被证明能够通过增强细胞核苷酸切除修复能力来介导对顺铂等DNA 损伤药物耐药[62]。Li等[63]发现,在非小细胞肺癌中,HIF-1α能够通过直接结合Tie1基因上游的缺氧反应元件,从而促进Tie1转录,介导肿瘤干细胞性以及顺铂耐药。此外,HIF-1α还能通过促进自噬相关蛋白4B[64]、真核细胞翻译起始因子5A2[65]等自噬相关基因的转录,启动细胞保护性自噬,介导肿瘤对顺铂的耐受。
2.5 调控线粒体动态活动
线粒体是真核细胞的能量代谢中心,同时在细胞凋亡进程中发挥重要作用,其数量、形态和功能受到多种因素的精密调控[66]。其中,ROS能够通过调控细胞线粒体的动态活动来影响细胞代谢以及凋亡等进程,从而影响肿瘤对顺铂敏感性。过氧化物酶体增殖物激活受体γ共激活物1α(peroxisome proliferator-activated receptor gamma coactivator-1α,PGC-1α)能够通过促进核转录复合体以及线粒体DNA转录相关因子的形成,来调节线粒体关键蛋白的合成,因而是线粒体生成的重要蛋白[67]。在非小细胞肺癌[68]和卵巢肿瘤[69]中,ROS能够通过提升PGC-1α的表达,增加线粒体数量,提高线粒体内膜电位,同时促进细胞代谢向氧化磷酸化转化,导致耐药肿瘤的形成。此外,在卵巢肿瘤中,ROS还能够促进动力相关蛋白1依赖的线粒体分裂,介导顺铂耐药[70]。而在头颈部鳞状细胞癌中,ROS则能通过提高HIF-1α水平来促进线粒体分裂相关因子转录,从而介导线粒体分裂,增加肿瘤对顺铂的敏感性[71]。肿瘤坏死因子受体相关蛋白 1(tumor necrosis factor receptor-associated protein 1,TRAP1)是一种线粒体热休克蛋白,能通过减少线粒体ROS的产生降低化疗药物对肿瘤细胞的杀伤[72]。顺铂耐药肺癌细胞TRAP1高表达,抑制TRAP1后能够有效提高顺铂作用下线粒体ROS的水平,降低线粒体膜电位,促进细胞色素c的释放,导致细胞凋亡[73](图1)。
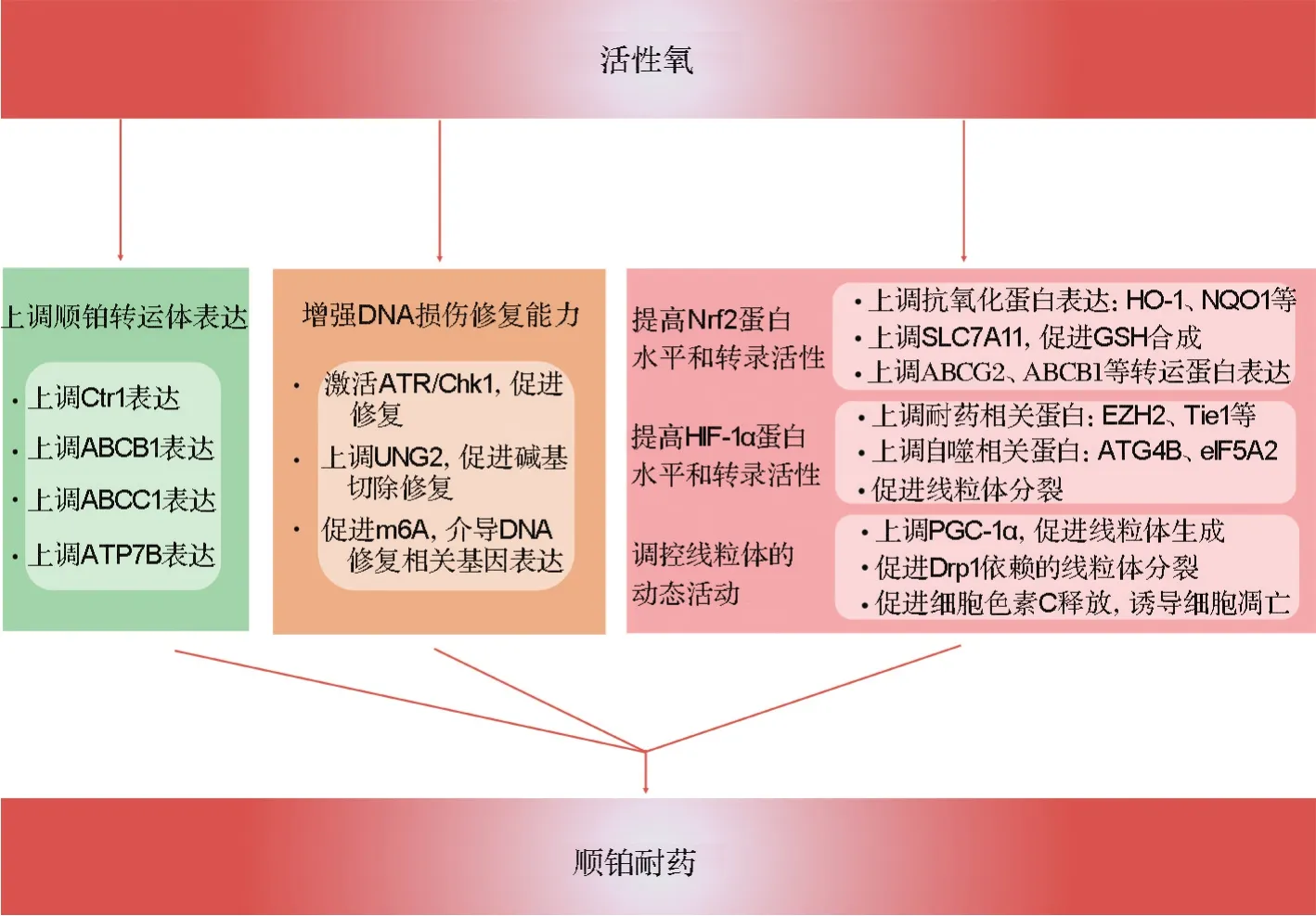
图1 活性氧调控肿瘤顺铂耐药的机制.Ctr1:铜离子转运体1;ABCB1:ATP结合盒亚家族B成员1;ABCC1:ATP结合盒亚家族C成员1;ATR:共济失调毛细血管扩张突变和RAD3相关蛋白;Chk1:细胞周期检测点激酶1;UNG2:尿嘧啶DNA糖苷酶2;m6A:N6-腺苷酸甲基化;Nrf2:核转录相关因子红系2;HO-1:血红素氧合酶1;NQO1:NADPH醌氧还原酶1;SLC7A11:溶质载体蛋白家族7成员A11;GSH:谷胱甘肽;ABCG2:ATP结合盒亚家族G成员2;HIF-1α:低氧诱导因子1α;EZH2:Zeste基因增强子人类同源物2;Tie1:免疫球蛋白样和上皮生长因子样域酪氨酸激酶1;ATG4B:自噬相关蛋白4B;eIF5A2:真核细胞翻译起始因子5A2;PGC-1α:过氧化物酶体增殖物激活受体γ辅激活物1α;Drp1:动力相关蛋白1.
3 靶向ROS的肿瘤治疗新策略
基于耐药肿瘤中ROS的代谢特点以及ROS调控肿瘤顺铂耐药的机制,目前已有大量的药理学研究据此展开,按照其作用机制可分为ROS诱导剂和抗氧化系统抑制剂2类(表1)。

表1 通过调节细胞内ROS促进顺铂增敏的药物
3.1 ROS诱导剂
ROS诱导剂是指在联合顺铂后,能够大幅度提高肿瘤内ROS水平,使其达到细胞毒性水平的药物。在舌鳞癌中,褪黑素(melatonin)联合顺铂能够明显提高细胞内ROS水平,相较顺铂单用组,联合用药能够诱导更多的肿瘤细胞发生凋亡[74]。在喉鳞癌中,姜黄素(curcumin)联合顺铂能够进一步提高肿瘤细胞和线粒体ROS水平,最终导致肿瘤细胞死亡[75]。此外,唑来膦酸(zoledronic acid)[76]、灵芝酸D(ganoderic acid D)[77]、白花丹素(plumbagin)[78]和荜拔酰胺(piperlongumine)[79]等其他多种药物亦有相似报道。
3.2 抗氧化系统抑制剂
抗氧化系统抑制剂是指能够通过抑制细胞内的抗氧化分子,间接提高细胞内ROS的药物。Nrf2作为细胞内主要的抗氧化蛋白,曾被证明是多种顺铂增敏药物的作用靶点。在胃癌中,犹素修饰系统关键蛋白是预后良好的标志。它能够通过泛素化降解Nrf2,减少下游醛酮还原酶的转录,从而提高顺铂作用后细胞内ROS水平,增加胃癌对顺铂的敏感性[80]。氟米松(flumethasone)[81]和葫芦巴碱(trigonelline)[82]能够分别通过降低细胞内 Nrf2 表达水平和功能,从而增加肿瘤对顺铂的敏感性。除Nrf2外,其他抗氧化蛋白也是作为顺铂增敏剂的潜在靶点。在结肠癌细胞中,异脱氧象皮素(isodeoxyelephantopin)能够通过抑制TrxR1的活性,提高细胞内ROS水平[83]。在肺癌中,敲除GPx4或者采用GPx4抑制剂RSL3能够有效增加肿瘤细胞对顺铂的敏感性并促进细胞发生铁死亡[84]。ent-贝壳杉烷类二萜(ent-kaurane diterpenoids)则能够通过直接结合GSH并抑制其还原性,逆转肺癌对顺铂的耐药[85]。此外,Kawahara等[86]还设计了一种新型的一氧化碳搭载系统,在可见光诱导下,该系统能够在肿瘤局部释放一氧化碳,后者能够通过抑制胱硫醚β-合成酶,降低细胞内GSH以及金属硫蛋白的水平,从而逆转卵巢肿瘤顺铂耐药。Chen等[87]设计了一种包含顺铂和GST抑制剂的铂(IV)前药,它能够在顺铂耐药的肺癌细胞中造成更多的DNA损伤,介导肿瘤细胞死亡。
4 结语
顺铂是多种实体瘤临床化疗方案的基石,但是顺铂的耐药问题极大地限制了它的临床疗效。因此,克服顺铂耐药是亟待解决的一大临床难题。目前为止,很多研究提示,ROS代谢异常是顺铂耐药的重要机制,一方面肿瘤能够通过多种机制降低细胞内活性氧,增强对化疗药物的耐受,另一方面活性氧本身在肿瘤对顺铂耐药形成过程中亦发挥了重要作用,然而相关的分子机制仍有待进一步完善和研究。此外,ROS水平作为衡量肿瘤对顺铂等化疗药物应答能力的重要标志,如何在临床中构建基于ROS水平的评价体系,改进化疗药物疗效预估和评价也仍需进一步探索。相信ROS相关分子机制的阐明以及新型药物的研发,定能为逆转肿瘤顺铂耐药提供更有效的治疗策略和方案。
