聚茶多酚包覆柚皮素纳米脂质体的制备、小鼠体内药动学和抑制肝细胞脂质沉积作用
2022-02-15阿斯亚白依赛提
胡 睿,阿斯亚·白依赛提,祁 荣
(1.石河子大学药学院,新疆 石河子 832000;2.北京大学医学部基础医学院药理学系,北京 100191;3.新疆克拉玛依市中心医院,新疆 克拉玛依 834000)
柚皮素(naringenin,NGN)是二氢黄酮类化合物[1],主要存在于柑橘类水果中[2]。研究表明,NGN具有抗氧化、抗炎和免疫调节等药理活性[3-6],并具有抑制肝纤维化作用,在体内和体外肝损伤模型中具有良好的保肝活性[7]。本课题组前期研究发现,NGN可通过抑制炎症相关通路的激活达到抑制油酸和脂多糖(lipopolysaccharide,LPS)诱导的HepG2细胞脂质沉积的作用,以及抗蛋氨酸-胆碱缺乏饲料诱导的非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)的作用[8],这与常规通过调节血脂、改善胰岛素抵抗或控制肥胖等策略治疗NAFLD有所不同。
NGN水溶性和脂溶性均较差[9],且其肠吸收受小肠上皮细胞膜表面P-糖蛋白外排作用的影响,生物利用度低,影响其药理活性。研究者尝试将NGN制备成纳米乳[10]、纳米粒[11]和自微乳[12]等制剂,以改善NGN的口服生物利用度并提高其药理作用。本课题组前期研究结果表明,将NGN制备成纳米脂质体(nanoliposomes,NL)可明显增加其口服吸收和抗NAFLD的药效作用[13],但NL仍存在制剂储存稳定性差等问题[14]。对NL进行改进产生的新一代的脂质纳米颗粒,如固体脂质纳米粒和纳米脂质载体等[15]以及大分子包覆[16]均能增加NL的储存稳定性。
茶多酚具有抗氧化[17]、抗炎[18]和抗菌[19]活性,但其对光、氧气和温度等敏感,易降解为无生物活性的中间产物。因此,多酚生物利用度相对较低[20]。为解决多酚稳定性和生物利用度差的问题,有研究者将其聚合制备成纳米颗粒,用于开发新型功能性食品[21];也将其作为功能性材料组装在各种模板表面[22],使其兼具功能性和药理活性。
本研究将茶多酚聚合为聚茶多酚(poly-tea polyphenol,PTP)并包覆在NGN-NL表面制成PTP包覆的NGN-NL(PTP@NGN-NL),研究PTP包覆是否增加NGN-NL制剂稳定性,以及是否提高NGN的抗肝细胞脂质沉积作用,为开发治疗NAFLD临床新药奠定研究基础。
1 材料与方法
1.1 药品、主要试剂和仪器
NGN(纯度93%),日本TCI公司;茶多酚(纯度98%),上海晶都生物有限公司;胆固醇和磷脂,上海阿拉丁生化科技有限公司;肝素,北京华中海威基因科技有限公司;油酸,日本TCI公司;LPS,上海源叶生物科技有限公司;水合氯醛,国药集团化学试剂北京有限公司;胎牛血清和高糖DMEM培养基,北京全式金公司;甘油三酯测定试剂盒(批号:R21738-96T);北京中生北控生物科技公司;碳酸氢钠、磷酸二氢钠、氯化钠、三氯甲烷、甲醇、氯化钾、氯化钙、碳酸钙、盐酸和氢氧化钠,北京精细化工厂。
超纯水制备器,美国Millipore公司;Agilent1260高效液相色谱仪(high performance liquid chromatography,HPLC),美国安捷伦科技有限公司;紫外扫描分析系统,美国Kodak公司;pH计,意大利Hanna公司;1/1000电子天平,美国Ohaus公司;Zetasizer Nano分析仪,英国Malvern Instruments公司;旋转蒸发仪,上海亚荣生化仪器;KQ-100DE型数控超声波清洗器,郑州明天仪器设备有限公司;台式冷冻高速离心机5810 R,德国Eppendorf公司;-80℃超低温冰箱和孵箱,日本Sanyo公司;涡旋混合器,北方同正生物技术发展公司;光学显微镜,德国Leica公司和超净工作台,北京长城空气净化公司;Tecnai TF30透射电镜(transmission electron microscope,TEM),美国FEI公司。
1.2 动物和细胞
18只8周龄雄性C57小鼠(北京大学医学部动物部),体重24~26 g,使用许可证号:SYXK(京)2016-0041,伦理学批准文号:LA2016035,饲养于SPF级屏障实验室。所有动物正常饮食饮水,在室温(18~22℃),湿度45%~55%,12 h昼夜交替条件下饲养。人肝癌HepG2细胞购自中国科学院上海细胞库。
1.3 NGN-NL和PTP@NGN-NL的制备
NGN-NL的制备:磷脂225 mg、胆固醇25 mg和NGN 25 mg置茄形瓶中,加3.00 mL溶剂(甲醇∶氯仿=2∶1)溶解混匀,旋转蒸发30 min(37℃,100 r·min-1)至成膜。吸取3.00 mL PBS水化,冰浴状态下超声至泛淡蓝色乳光,即得NGN-NL。将制备好的NGN-NL过0.22 μm滤膜,取滤液于5 mL EP管中4℃保存。NL的制备除不加NGN外,其余制备步骤与NGN-NL一致。
PTP@NGN-NL的制备:茶多酚粉末30 mg溶解于1 mL水中,吸取3.00 mL NGN-NL于西林瓶中,在300 r·min-1磁力搅拌下,将1.00 mL茶多酚溶液缓慢加入西林瓶中,用NaOH 0.01 mol·L-1调节溶液至pH8.5,持续搅拌反应24 h。用去离子水在9391×g,10 min离心3次,洗去未聚合的多酚和游离的NGN,4℃下保存。PTP@NL载体的制备:除将NGN-NL替换为NL外,其余制备步骤均同PTP@NGN-NL制备。
1.4 NGN-NL和PTP@NGN-NL表征检测
1.4.1 粒径、Zeta电位测定及表观形态观察
分别精密吸取100 μL PTP@NGN-NL或NGN-NL于10.00 mL容量瓶中,取适量去离子水振摇混匀后,稀释至刻度摇匀。吸取1.00 mL上述样品,用马尔文粒径仪测定粒径以及Zeta电位;将样品置小烧杯中,用镊子夹住铜网边缘并在样品溶液中浸润数秒,干燥后用透射电镜观察样品表观形态。
1.4.2 HPLC法测定包封率和载药量[13]。
首先吸取1.3制备的NGN-NL或PTP@NGN-NL 100 μL,置10.00 mL容量瓶中,用甲醇定容,超声(频率:40 kHz,功率:100 W)破乳10 min,计算NGN-NL或PTP@NGN-NL中NGN的质量即为总含药量(N,g)。另吸取200 μL NGN-NL,超速离心(84 518×g,2 h,4℃)后,精密吸取上清液100 μL,测定NGN浓度,即为NGN-NL中游离药物含量(Cfree,g·L-1);或吸取1.00 mL PTP@NGN-NL,离心(9391×g,10 min,4℃)后,吸取上清于EP管中,再补充1.00 mL去离子水于PTP@NGN-NL中,重复离心3次,合并上清液(总体积为V),测定NGN浓度,即为PTP@NGN-NL中的Cfree。计算包封率和载药量。包封率(%)=(N-Cfree×V)/N×100%,载药量(%)=(N-Cfree×V)/(N+W)×100%,式中,W为药物载体总量(g)。
1.5 HPLC法测定PTP@NGN-NL的储存稳定性
分别平行制备3份NGN-NL和PTP@NGN-NL,各取2.00 mL置相同体积EP管中,加氮气隔绝空气,封口膜封EP管管口,分别保存在室温和4℃,于第0,3和7天取样,按1.4.2处理,测定NGN含量,计算载药量,以载药量反映制剂的储存稳定性。
1.6 HPLC法测定PTP@NGN-NL在模拟胃液和肠液中溶出率
据2015版《中国药典》[23]制备模拟胃液:取稀盐酸1.64 mL,加水稀释至100.00 mL,使溶液pH值为1.2;模拟肠液制备:取25.00 mL 0.2 mol·L-1磷酸二氢钾溶液,加入0.2 mol·L-1氢氧化钠溶液11.80 mL,用水稀释至 100.00 mL,摇匀,即得,使溶液pH值为6.8。
精密吸取9.00 mL配置好的模拟胃液,平行3份,分别加入1.00mLNGN,NGN-NL或PTP@NGNNL溶液(均7 g·L-1),放入摇床中,37℃,100 r·min-1振动,分别于0,2和4 h取样品溶液200 μL,加入氢氧化钠中和至pH=7,13 523×g离心30 min后,取上清用HPLC法测定NGN量,计算胃液溶出的NGN与加入量的比例(%)以反映制剂在胃液中的稳定性。
精密吸取配置好的模拟肠液9.00 mL,平行3份加入1.00 mL NGN,NGN-NL或PTP@NGNNL溶液(均7 g·L-1),分别在0,2和4 h取样品溶液200 μL,样品溶液经13 523×g离心30 min,取上清用HPLC法测定NGN的量,计算肠液溶出的NGN与加入量的比例(%)以反映制剂在肠液中的稳定性。
1.7 HPLC法测定PTP@NGN-NL的体外释放
首先活化透析袋(分子截留量为8000~14000ku),随后在透析袋中加入相当于含1 mg NGN的NGN,NGN-NL和PTP@NGN-NL样品溶液,用水稀释至1 mL,用透析夹将透析袋两端夹紧固定,防止液体流出。以PBS缓冲液(含0.25%吐温80)为释放介质,将透析袋置200.00 mL 37℃恒温释放介质中磁力搅拌(300 r·min-1)。分别在0.5,1,2,4,8,12和24 h吸取1.00 mL透析袋外的释放介质,并补充等体积新鲜释放介质。采用HPLC法测定各时间点所取样品中NGN浓度并计算累积释放百分率。
1.8 PTP@NGN-NL的小鼠体内药动学
1.8.1 分组和样制备
18只小鼠,分为NGN-NL 12.5,25.0 mg·kg-1和PTP@NGN-NL 12.5 mg·kg-1组(剂量为相当于NGN的含量),每组6只,ig给药。给药前禁食12 h,自由饮水。每组再分为2个亚组,亚组1在给药后0.083,0.25,1,6和12 h眼眶取血100 μL;亚组2在给药后 0.167,0.5,2,8 和 24 h 眼眶取血 100 μL。血液样品置肝素处理的离心管中,1502×g离心10 min,取上清得血浆样品,冷冻保存于-20℃。
1.8.2 血浆样品处理和药动学参数测定
β-葡萄糖醛酸酶溶液制备:精密称取10 mg β-葡萄糖醛酸酶,加入2.00 mL PBS溶液,制得浓度5000 kU·L-1的β-葡萄糖醛酸酶溶液。
酶解样品制备:将冰冻血浆进行解冻,精密吸取40 μL于离心管中,随后加入β-葡萄糖醛酸苷酶溶液50 μL,涡旋1 min,在37℃恒温水浴条件反应1 h后,加入1.00 mL甲醇,涡旋1 min,1502×g,4℃离心10 min,取上清液于离心管中,在40℃水浴条件下用氮气吹干。在吹干样品中加入0.10 mL流动相进行溶解,涡旋1 min,使其混匀,1502×g,4℃离心10 min,吸取上清液用0.45 μm针孔式过滤器过滤,取上清液,采用HPLC测定血浆中NGN浓度[13]。采用DAS 2.0软件对小鼠血药浓度进行非房室模型拟合,得药动学参数。
1.9 MTT法确定HepG2细胞PTP@NGN-NL安全浓度
将HepG2细胞接种在96孔板中〔每孔(5~6)×104个细胞〕,培养过夜待细胞贴壁后用DMEM培养基处理12 h,每组设6个平行孔。分为空白对照组、细胞对照组、模型组(加含油酸0.3 mmol·L-1和LPS 2.5 mg·L-1的 DMEM溶液 0.20 mL)、模型+NGN 100 和 200 μmol·L-1组、模型 +NGN-NL 100 和 200 μmol·L-1组、模型+PTP@NL 100 和200 μmol·L-1及模型+PTP@NGN-NL 载体 100 和200 μmol·L-1组。模型组分别加含相应终浓度载体溶液0.20 mL。细胞置37℃孵箱(相对湿度90%,CO2浓度5%)培养24 h后吸弃培养液。加入DMEM稀释的MTT溶液(5.0 g·L-1)0.02 mL继续置37℃细胞培养箱中培养。4 h后吸弃上清,加入0.15 mL DMSO,37℃避光100 r·min-1振动条件下反应8 min,待蓝色结晶甲臜完全溶解后,用酶标仪在560 nm波长处读取溶液吸光度(A560nm)值。细胞存活率(%)=(药物组A560nm-空白对照组A560nm)/(细胞对照组A560nm-空白对照组A560nm)×100%。以细胞存活率≥80%对应的浓度为安全药物浓度[8]。
1.10 试剂盒测定HepG2细胞甘油三酯含量
将HepG2细胞接种在6孔板中〔每孔(5~6)×105个细胞〕,每组设6个平行孔。培养过夜待细胞贴壁后用DMEM培养基处理12 h,分为细胞对照组、模型组(加含油酸0.3 mmol·L-1及LPS 2.5 mg·L-1的DMEM溶液 1 mL)、模型+NGN 100和200 μmol·L-1组、模型+NGN-NL 50 和 100 μmol·L-1组、模型+PTP@NL 载体 100 和 200 μmol·L-1组和模型+PTP@NGN-NL 50 μmol·L-1组。处理组分别加入含相应终浓度溶液1.00 mL,孵育24 h。用1×PBS洗3次,0.5 mL胰酶消化1 min,吸弃胰酶,加入1.00 mL空白培养基反复吹打细胞,直至细胞完全脱落并装在EP管中。4℃,375×g离心10 min,弃上清,加入1.00 mL 1×PBS再离心,再加入1.00 mL 1×PBS,并将其转移至新玻璃管中,加入2∶1氯仿/甲醇溶液(2∶1)4.00 mL,封盖。涡旋1 min,直至充分混匀,4℃预冷,375×g离心30 min将水相和油相分离,弃最上层水相,取下层有机相用氮气吹干后加入0.50 mL 3%Triton X-100(V/V)溶液,涡旋使玻璃管壁上脂质完全溶解,再将其置55℃恒温摇床,100 r·min-1振荡2 h使脂质完全溶解。用试剂盒测定样品中甘油三酯含量(μmol·L-1)。
1.11 统计学分析
实验结果数据以±s表示,实验中所有统计学分析均采用GraphPad Prism 6.01软件进行,组间比较采用one way-ANOVA检验,两两比较采用t检验。P<0.05为具有差异具有统计学意义。
2 结果
2.1 PTP@NGN-NL的粒径、Zeta电位、包封率和载药量
NGN-NL及PTP@NGN-NL均为圆整的球状粒子(图1),马尔文粒径仪测试结果与电镜检测结果基本一致(表1)。NGN-NL和PTP@NGN-NL的粒径分别为125±4和(159±6)nm;Zeta电位分别为-4.3±0.0和(-23.0±2.5)mV;包封率分别为(94.8±1.2)%和(93.4±0.6)%,载药量分别为(9.1±0.0)%和(8.2±0.1)%。其中PTP@NGN-NL的粒径明显大于NGN-NL(P<0.01),表明PTP已包覆在NGN-NL表面,提示NL作为基底膜材,可使NGN-NL充分包载在PTP囊壳内;PTP包覆后Zeta电位绝对值增加(P<0.01),表明PTP包覆能明显增加NGN-NL制剂稳定性;同时PTP包覆不会影响NGN-NL包封率,但因使用囊材质量增加导致载药量略微降低。
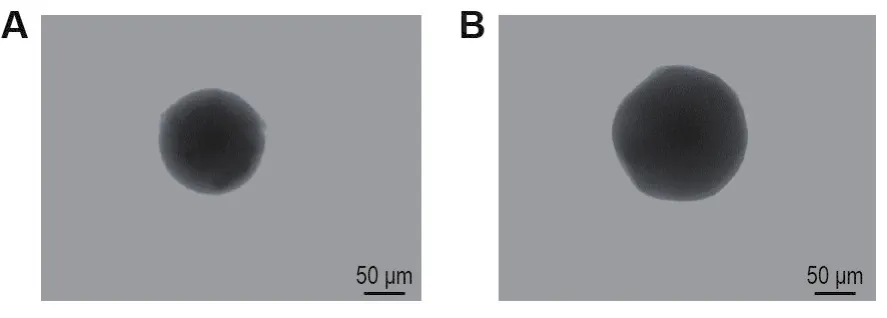
Fig.1 Representative transmission electron microscope(TEM)image of naringenin nanoliposomes(NGN-NL)(A)and poly-tea polyphenol coated NGN-NL(PTP@NGN-NL)(B).
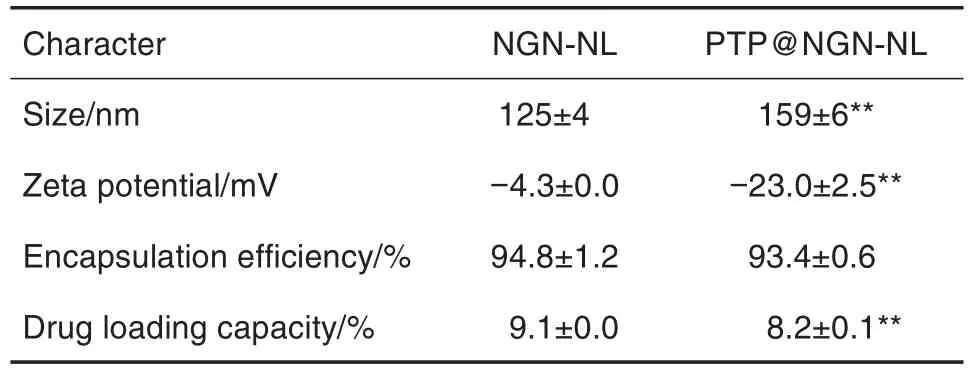
Tab.1 Characterizations of NGN-NL and PTP@NGN-NL measured by Marlvern laser particle size analyzer and hith performance liquid chromatography(HPLC)
2.2 PTP@NGN-NL的稳定性
2.2.1 储存稳定性
与0 h相比,室温储存至第3天和第7天(图2),NGN-NL和PTP@NGN-NL的载药量均明显降低(P<0.01);4℃储存至第3天,二者的载药量均无明显变化,储存至第7天载和PTP@NGN-NL药量均明显降低(P<0.01,P<0.05)。表明 NGN-NL和PTP@NGN-NL在4℃时相较室温更稳定。
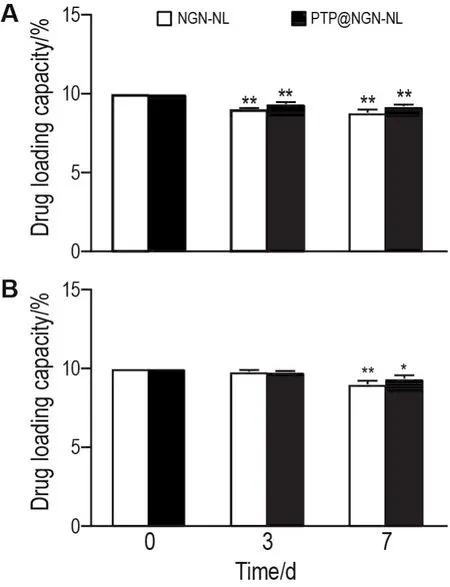
Fig.2 Storage stability of NGN-NL and PTP@NGN-NL at room temperature(A)and 4℃(B)measured by HPLC.±s,n=3.*P<0.05,**P<0.01,compared with the coresponding 0 h group.
2.2.2 在模拟胃液和模拟肠液中稳定性
在模拟胃液中,与0 h相比(图3),4 h时NGN,NGN-NL和PTP@NGN-NL组NGN含量均显著降低(P<0.01,P<0.01,P<0.05),PTP@NGN-NL组 NGN含量显著高于NGN原料药组(P<0.05)和NGN-NL组(P<0.05),表明PTP@NGN-NL在胃液中稳定性高于NGN原料药和NGN-NL。在模拟肠液中,与0 h相比,4 h,NGN,NGN-NL和 PTP@NGN-NL组NGN含量均显著降低(P<0.01,P<0.01,P<0.05),NGN原料药与NGN-NL组相当,PTP@NGN-NL组明显高于NGN-NL和NGN原料药组(P<0.05)。表明PTP@NGN-NL在胃肠液中稳定性均优于NGN-NL。

Fig.3 Stability of NGN,NGN-NL and PTP@NGN-NL in simulated gastric fluid(A)and simulated intestinal fluid (B)measured by HPLC.x± s,n=3.*P<0.05,**P<0.01,compared with corresponding 0 h of the same group;#P<0.05,compared with NGN group at the same time;ΔP<0.05,compared with NGN-NL group at the same time.
2.3 PTP@NGN-NL的体外累积释放率
如图4所示,NGN-NL和PTP@NGN-NL中NGN的24 h累积释放率明显高于NGN原料药(P<0.01),提示NL和PTP包覆均能增加NGN原料药体外释放;与NGN-NL相比,PTP@NGN-NL释药曲线中24 h时NGN含量仍在缓慢上升未达到稳态(P<0.01),表明PTP包覆增加了 NGN-NL缓释作用。
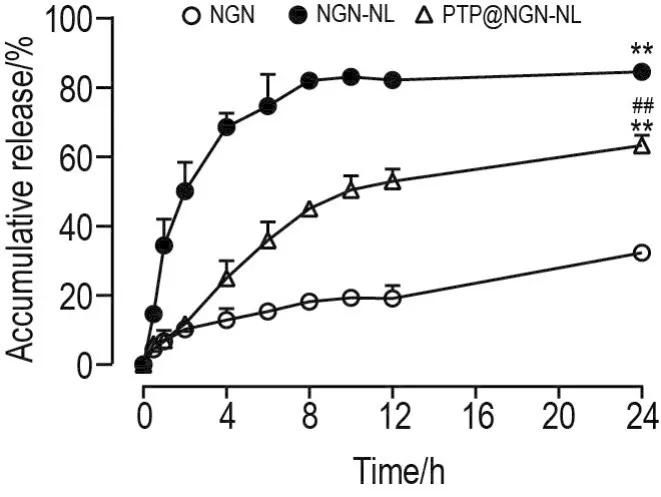
Fig.4 In vitro accumulative release profile of NGN,NGN-NL and PTP@NGN-NL detected by dialysis bag method.±s,n=3.**P<0.01,compared with NGN group;##P<0.01,compared with NGN-NL group.
2.4 PTP包覆对NGN-NL小鼠体内药动学的影响
如图5所示,NGN-NL组和PTP@NGN-NL组均在0.083 h(约5 min)达Cmax值,均出现双峰,说明药物在体内出现了肝肠循环现象。如表2所示,NGN-NL 12.5 mg·kg-1组与NGN-NL 25.0 mg·kg-1组相比,药动学参数 AUC 和Cmax均有明显差异(P<0.01,P<0.05),PTP@NGN-NL 12.5 mg·kg-1组与 NGN-NL 12.5 mg·kg-1组药动学参数AUC,t1/2和Cmax均无明显差异,表明PTP包覆可能不影响NGN-NL的体内药动学。
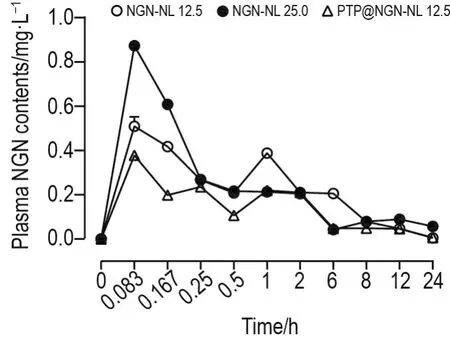
Fig.5 Plasma NGN-time curves of NGN-NL and PTP@NGN-NL after single ig administration in mice.Male mice were ig given NGN-NL 12.5,25.0 mg·kg-1or PTP@NG-NL 12.5 mg·kg-1,and plasma concentrations of NGN were measured by HPLC.±s,n=3.

Tab.2 Pharmacokinetic parameters of NGN-NL and PTP@NGN-NL in mice
2.5 PTP@NGN-NL对HepG2细胞脂质沉积的影响
2.5.1 PTP@NGN-NL安全浓度
MTT结果(表3)可见,NGN 100,200 μmol·L-1、NGN-NL 100,200 μmol·L-1、PTP@NL载体100,200 μmol·L-1和 PTP@NGN-NL 100,200 μmol·L-1组HepG2细胞存活率均高于80%。
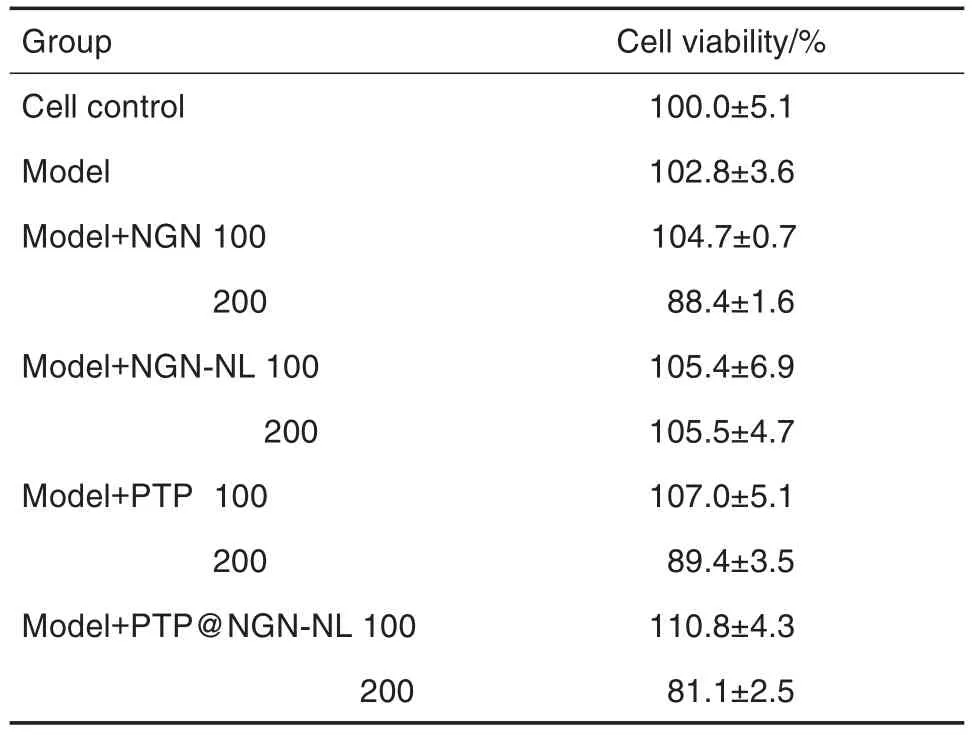
Tab.3 Cell viability of HepG2 treated with NGN formulations by MTT
2.5.2 PTP@NGN-NL对HepG2细胞甘油三酯含量的影响
与细胞对照组相比,模型组细胞甘油三酯含量显著增加(P<0.01),模型+NGN-NL 50 μmol·L-1与模型+NGN 200 μmol·L-1组甘油三酯含量相当,模型+PTP@NGN-NL 50 μmol·L-1组甘油三酯含量明显低于模型+NGN-NL 50 μmol·L-1组(P<0.05)(表4),表明NGN-NL抑制肝细胞脂质沉积作用优于NGN原料药组,且PTP可增加NGN降低肝细胞脂质沉积作用。同时,模型+PTP@NGN-NL组与模型+NGN 200 μmol·L-1组甘油三酯含量相当,表明PTP也具有抑制细胞脂质沉积的作用。

Tab.4 Effects of NGN formulations on triglycerides(TG)in HepG2 cells induced by oleic acid and lipid polysaccharide.
3 讨论
本研究结果表明,茶多酚不仅因氧化成膜增加NGN-NL的稳定性,还能增加NGN-NL的缓释作用,还可因其药理作用增加NGN抗肝细胞脂质沉积作用。
PTP含有邻位酚羟基,在pH驱动下可自行发生氧化聚合反应,贾鑫教授课题组前期研究结果表明,多酚氧化聚合24 h可达到聚合稳态[24]。因此,本课题在上述条件下制备了PTP@NGN-NL,通过电子显微镜及马尔文粒径仪均观察到PTP在NGN-NL表面形成了约20 nm厚的薄膜,这一结果与文献报道结果基本一致[25]。储存稳定性和胃肠液稳定性实验结果表明,PTP包覆后,NGN-NL稳定性明显增加。
体外释放实验结果表明,在肠液中释放24 h时,NGN-NL累积释放率比原料药高2.7倍,达85.2%;PTP@NGN-NL累积释放率为68.1%,且释药曲线中NGN含量还在缓慢上升尚未达到稳态,表明PTP包覆增加了NGN-NL在肠液中的缓释作用。
本研究肝细胞脂质抽提结果表明,PTP@NL空载体(相当于给予PTP@NGN-NL 100 μmol·L-1的载体量)与NGN 200 μmol·L-1具有相似的抗油酸和LPS诱导的HepG2细胞脂质沉积作用,说明PTP具有抑制肝细胞脂质沉积药理活性。NGN-NL抑制肝细胞脂质沉积的作用是NGN原料药的4倍,且PTP@NGN-NL具有比NGN-NL更好的抑制肝细胞脂质沉积的作用。上述结果表明,NGN与PTP存在协同抗肝细胞脂质沉积作用。
本课题组前期研究结果表明,NGN-NL抗NAFLD 最低有效剂量为 25 mg·kg-1[13]。因此,在小鼠药动学实验中,以NGN-NL 25 mg·kg-1体内药动学行为做为参考。若PTP与NGN存在协同药理活性,PTP@NGN-NL12.5 mg·kg-1也许可增强NGN抗NAFLD作用。因此,分别选用NGN-NL 12.5和25.0 mg·kg-1及PTP@NGN-NL12.5 mg·kg-1观察PTP包覆对NGN-NL体内吸收的影响。NGN-NL 12.5 mg·kg-1与PTP@NGN-NL12.5 mg·kg-1的AUC(0-t)无明显差异,表明PTP包载不影响NGN-NL体内吸收。
综上所述,PTP包覆不影响NGN-NL的包封率、载药量及体内吸收,可增加其的稳定性,并具有比NGN-NL更好的缓释作用;PTP可与NGN-NL协同抑制肝细胞脂质沉积。提示PTP在体内可能具有与NGN协同抑制NAFLD的作用。
