超高压预处理对西番莲果皮抗氧化能力及对HepG2细胞氧化损伤保护作用的影响
2022-02-15孙朋真曹建新赵天瑞程桂广
孙朋真,曹建新,赵天瑞,程桂广*
(昆明理工大学食品科学与工程学院,云南 昆明 650500)
紫色西番莲(Passiflora edulisSims)属西番莲科,俗称热情果和鸡蛋果,在我国云南、海南、台湾等地区种植历史悠久[1]。紫色西番莲果皮(the peel ofPassiflora edulisSims,PEP)具有抗氧化、抗炎、抗糖尿病等作用,这些作用归因于生物活性化合物如酚类化合物、黄酮类化合物和多糖等[2-4]。然而,西番莲果实多被用于果汁生产,PEP却被当作工业废料处理,造成极大的浪费。
酚类化合物以游离态、酯化态和不溶性结合态存在于植物中[5]。先前的研究表明,PEP富含可溶性酚类化合物(游离态酚类化合物:用不同溶剂通过超声波辅助提取、超临界流体萃取等传统方法获得的酚类物质)[6],而忽略了酯化态和结合态(与某些大分子、细胞壁多糖或蛋白质结合)[7],因此PEP中酚类物质的含量及其生物活性可能被低估。另外,多酚类物质是公认的抗氧化剂,在饮食中添加抗氧化剂以增强人体抗氧化机制是预防各种慢性疾病的重要手段[8]。因此,提高PEP的多酚提取率和生物活性具有重要意义。
近年来,超高压预处理已成为提高某些化合物提取率和生物活性的有效手段[9]。超高压(压力范围在100~600 MPa)预处理可用于提取水果、果汁等物料中的生物活性物质[10]。对植物材料施加压力可以破坏其三维结构,破坏材料大分子间的氢键、离子键以及疏水键等非共价键,还可以破坏细胞膜中的盐桥和疏水相互作用,提升渗透率,从而促进酚类等生物活性物质的释放[11-12]。此外,超高压已经成功地被应用到棕榈果、龙眼果皮、茶多酚等活性成分的提取[9,13-14],但是,目前鲜有关于超高压预处理对PEP中游离态、酯化态和不溶性结合态多酚提取的研究。因此,本研究旨在探讨超高压预处理对PEP中不同形态酚类及其抗氧化能力和细胞保护作用的影响。
1 材料与方法
1.1 材料与试剂
紫色西番莲果实于2018年从中国云南省昆明当地市场购买,并在中国科学院昆明植物研究所进行鉴定。将这些水果人工分成果肉和果皮,然后将果皮切成小块,用冷冻干燥机冻干。
福林-酚试剂、2,2-二苯基-1-三硝基苯肼(2,2-diphenyl-1-picrylhydrazyl,DPPH)、2,2’-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ehtylbenzothiazoline-6-sulfonic acid),ABTS)、噻唑蓝(methylthiazol-2-yl-2,5-diphenyl tetrazolium bromide,MTT)、2’,7’-二氯荧光黄双乙酸盐(2’,7’-dichlorofluorescin diacetate,DCFH-DA)、胰蛋白酶消化液 美国Sigma-Aldrich公司;HepG2细胞中国科学院昆明野生动物细胞库;胎牛血清(fetal bovine serum,FBS)、青霉素、链霉素、培养基(Dulbecco’s modified Eagle’s medium,DMEM) 美国Gibco公司;Annexin V-FITC/PI凋亡试剂盒 北京四正柏生物科技有限公司;没食子酸(gallic acid,GA)、芦丁(rutin,R)(纯度≥98%) 成都曼斯特生物科技有限公司;其他试剂是国产分析级纯度。
1.2 仪器与设备
HHP-600型超高压设备 包头科发高压科技有限责任公司;Hei-VAP型旋转蒸发仪 德国Heidolph公司;ALPHA 1-2 LD plus冷冻干燥机 德国Christ公司;Epoch 2微孔板分光光度计 美国伯腾公司。
1.3 方法
1.3.1 超高压预处理及PEP游离态、酯化态和结合态多酚的提取
取上述冷冻干燥的PEP,将其研成粉末。称取20 g PEP粉末(3 份)放入真空包装密封,根据预实验结果,确定最合适的超高压条件:500 MPa下超高压处理10 min,以水作为压力传递介质,电压380 V,温度25 ℃,将此记为超高压组。
未超高压组和超高压预处理组的果皮粉游离态、酯化态和不溶性结合态多酚的提取参考Zhang Chengting等[15]的方法。首先用石油醚以料液比1∶10混合脱脂处理未超高压组和超高压预处理组果皮粉5 min,重复3 次。脱脂样品在空气中干燥后,两组样品(10 g)用体积分数70%甲醇溶液(1∶10,m/V)100 mL在25~30 ℃下超声提取30 min,抽滤后,滤渣按照上述料液比和超声条件重复提取两次。收集3 次滤液,用旋转蒸发仪浓缩至黏稠状,用D101大孔树脂富集,用水洗脱除糖后,再用95%乙醇洗脱,收集乙醇洗脱液并浓缩[16],滤渣保留用于结合态多酚的收集。浓缩后液体用6 mol/L HCl溶液调至pH 2.0,然后用乙酸乙酯萃取5 次,收集上层萃取液,采用旋转蒸发仪真空浓缩后,所得浸膏采用真空冷冻干燥机冻干得到游离态多酚。萃余相(水相)先用4 mol/L NaOH溶液以体积比1∶10水解4 h,然后将pH值调至2.0,接着按照游离态多酚的提取方法进行萃取、收集、浓缩、冻干,从而得到酯化态多酚。对于结合态多酚的提取,首先用4 mol/L NaOH以体积比1∶10水解滤渣4 h,将pH值调至2后过滤,然后按照提取游离多酚的方法进行萃取、收集、浓缩、冻干得到结合态多酚。
1.3.2 PEP不同形态多酚和黄酮含量的测定
精准称取各提取物5 mg(3 份),配制成质量浓度1 mg/mL的溶液,采用福林-酚法[17]对PEP超高压前后的游离态、酯化态和结合态多酚含量进行测定,结果用每克多酚提取物含没食子酸当量(gallic acid equivalent,GAE)(mg GAE/g提取物)表示,提取率用每克PEP含没食子酸当量(mg GAE/g PEP)表示。参考刘南波等[18]的方法测定PEP超高压前后的游离态、酯化态和不溶性结合态黄酮含量,结果用每克多酚提取物含芦丁当量(rutin equivalent,RE)(mg RE/g提取物)表示,提取率用每克PEP含芦丁当量(mg RE/g PEP)表示。
1.3.3 PEP不同形态多酚抗氧化活性测定
1.3.3.1 DPPH自由基清除能力测定
参考Thaipong等[19]的方法通过DPPH自由基清除实验对PEP超高压前后的游离态、酯化态和结合态多酚的抗氧化活性进行测定,DPPH自由基清除能力按公式(1)计算。

式中:A1为空白组的吸光度;A2为样品组的吸光度。
计算PEP超高压前后不同形态多酚DPPH自由基清除能力的半数抑制浓度(half maximal inhibitory concentration,IC50)(DPPH自由基清除能力达到50%时的多酚质量浓度)。
1.3.3.2 ABTS阳离子自由基清除能力测定
参照沙玉欢等[20]的方法测定超高压前后PEP的3 种多酚的ABTS阳离子自由基清除能力, ABTS阳离子自由基清除能力按公式(2)计算。

式中:A1为空白组的吸光度;A2为样品组的吸光度。
计算PEP超高压前后不同形态多酚ABTS阳离子自由基清除能力的IC50(ABTS阳离子自由基清除能力达到50%的多酚质量浓度)。
1.3.3.3 铁离子还原能力测定
铁离子还原能力(ferric-reducing antioxidant power capacity,FRAP)测定在李新原等[10]的方法上稍作修改,用FeSO4当量(μmol Fe2+/g提取物)表示各种形态多酚的FRAP。
1.3.4 HepG2细胞氧化损伤模型的建立
1.3.4.1 细胞培养及样品细胞毒性测定
用含有10% FBS和1%抗生素(青霉素和链霉素混合物)的DMEM培养基在37 ℃、5% CO2的条件下培养HepG2细胞。通过MTT法[9]检测PEP不同形态多酚对HepG2细胞的毒性,以此确定合适浓度进行后续实验。
1.3.4.2 HepG2细胞活性氧含量的测定
采用Yang Meilian等[21]的方法稍作修改,测定H2O2诱导的HepG2细胞内活性氧(reactive oxygen species,ROS)的水平。将HepG2细胞以1×105细胞/孔密度接种2 mL于6 孔培养板中,培养24 h,然后样品组加入含PEP超高压处理前后的游离态、酯化态和不溶性结合态多酚(终质量浓度100 μg/mL)的培养基,阳性对照组加入含质量浓度10 μg/mL VC的培养基,空白组和模型组更换DMEM培养基。24 h后,去除培养基,各组(不含空白组)加入0.7 mmol/L H2O2孵育6 h,收集细胞,用预冷的磷酸盐缓冲液冲洗2 次,37 ℃黑暗中用10 mmol/L DCFHDA孵育20 min。孵育结束后,用无FBS的预冷培养基冲洗细胞两次,然后立即用流式细胞仪检测每组的荧光信号,并计算细胞内ROS的含量。
1.3.4.3 细胞凋亡率的测定
根据凋亡试剂盒说明书检测细胞凋亡率,分析PEP不同形态多酚对H2O2诱导细胞凋亡的保护作用。
1.4 数据处理与统计分析
实验数据测量重复3 次,所有数据均以平均值±标准差表示。用SPSS 17.0和Origin 8.5软件对实验数据进行处理,采用单因素方差分析和Duncan法确定差异显著性,P<0.05表示差异显著。
2 结果与分析
2.1 超高压预处理对PEP中不同形态多酚提取率的影响
未超高压组的游离态、酯化态和结合态多酚的提取率分别为(3.25±0.49)、(0.61±0.02)、(0.21±0.03)mg GAE/g PEP。如表1所示,经超高压预处理后,游离态、酯化态和结合态多酚的提取率均显著增加(P<0.05),分别为(6.90±0.13)、(0.80±0.07)、(0.28±0.02)mg GAE/g PEP(P<0.05)。对于PEP而言,不同形态多酚的提取率由高到低依次为游离态多酚>酯化态多酚>结合态多酚。超高压预处理后不同形态黄酮的提取率也都显著增加,尤其是酯化态和结合态黄酮的提取率,分别提升了4.63 倍和3.80 倍。可能是因为超高压更大程度上改变了PEP的细胞壁结构,破坏了多酚、黄酮类物质与蛋白质、多糖等生物大分子的结合,使多酚、黄酮类化合物最大限度释放出来,尤其是酯化态和结合态多酚、黄酮类化合物,从而提高其提取率[10,22]。
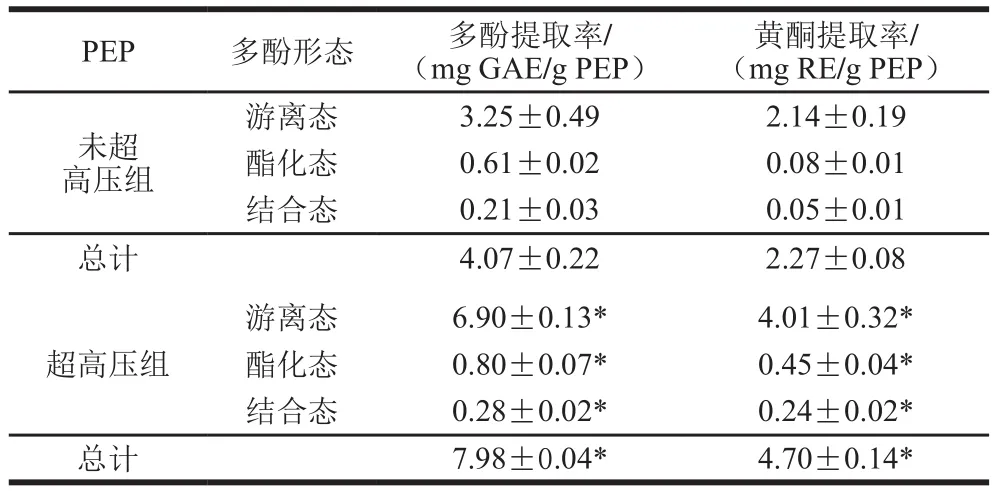
表1 超高压预处理对PEP中不同形态多酚提取率的影响Table 1 Extraction rates of free, esterified, and insoluble bound phenolic fractions from non-treated and UHP-treated peel of P.edulis
2.2 超高压处理对PEP提取物中多酚和黄酮含量的影响
如图1所示,就提取物而言,未超高压组的PEP的3 种形态多酚中,游离态多酚和黄酮含量最高,分别为(78.52±1.14)mg GAE/g提取物和(51.65±1.06)mg RE/g提取物,其次是结合态多酚和黄酮,酯化态多酚和黄酮含量最少,分别为(53.77±0.71)mg GAE/g提取物和(6.67±0.71)mg RE/g提取物。之前的报道发现紫色马铃薯皮[23]和红辣椒[24]中也主要含有游离态多酚,而花生皮中酯化态多酚含量更高[25],棠梨果皮中结合态多酚最多[7]。超高压预处理后显著提高了游离态多酚和黄酮含量,分别为(174.30±0.80)mg GAE/g提取物和(101.25±2.01)mg RE/g提取物,较未超高压组提高了1.22 倍和0.96 倍。之前有研究报道超高压预处理可以提高游离态多酚含量[9]。与游离态多酚不同的是,超高压预处理后,酯化态多酚含量降低,但酯化态黄酮含量升高,结合态多酚含量降低,而结合态黄酮含量无显著变化(P>0.05)。这可能是未超高压的PEP中部分多酚和黄酮类化合物与其他大分子结合,导致正常条件下提取困难,超高压预处理破坏了PEP中多酚和黄酮类物质与生物大分子间化学键的连接,从而显著提高了游离态多酚、游离态和酯化态黄酮类物质含量[9]。
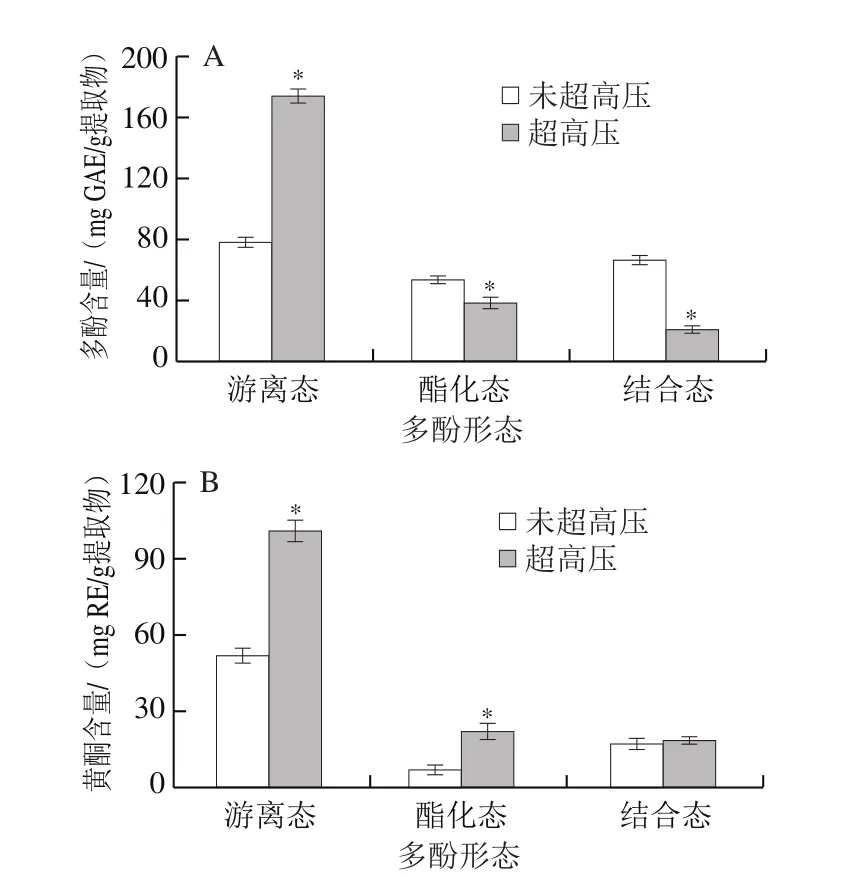
图1 未超高压和超高压处理的紫色西番莲果皮提取物的游离态、酯化态和结合态多酚和黄酮的含量Fig.1 Phenol and flavonoid contents of free, esterified, and insoluble bound phenolic fractions from non-treated and UHP-treated peel of P.edulis
2.3 超高压预处理对PEP提取物不同形态多酚抗氧化活性的影响
2.3.1 超高压预处理对PEP提取物不同形态多酚DPPH自由基清除能力的影响
如图2所示,超高压预处理前后,所有形态的多酚对DPPH自由基的清除能力与不同形态多酚含量呈剂量效应关系,其中相同剂量下,无论是否经过超高压预处理,游离态多酚的DPPH自由基清除率都是3 种多酚中最强的。未超高压游离态多酚IC50为(126.75±6.71)μg/mL,超高压游离态多酚IC50为(71.25±6.65)μg/mL,与未超高压处理组相比,超高压预处理能显著提高游离态多酚的DPPH自由基清除能力(P<0.05)。

图2 未超高压和超高压预处理的紫色西番莲果皮提取物游离态、酯化态和结合态多酚的DPPH自由基清除能力Fig.2 DPPH radical scavenging activity of free, esterified and insoluble bound phenolic fractions from non-treated and UHP-treated peel of P.edulis
2.3.2 超高压预处理对PEP提取物不同形态多酚ABTS阳离子自由基清除能力的影响
由图3可知,超高压预处理前后的6 组提取物均表现出良好的ABTS阳离子自由基清除能力,且清除能力大小顺序为超高压游离态多酚>未超高压游离态多酚>未超高压结合态多酚>未超高压酯化态多酚>超高压酯化态多酚>超高压结合态多酚。未超高压的PEP中,游离态多酚表现出最高的清除活性,其IC50为(176.35±4.56)μg/mL。经过超高压处理后,不仅游离态多酚和游离态黄酮含量升高,其ABTS阳离子自由基清除能力也显著升高(P<0.05),IC50为(91.28±6.34)μg/mL,明显低于未超高压的游离态多酚。
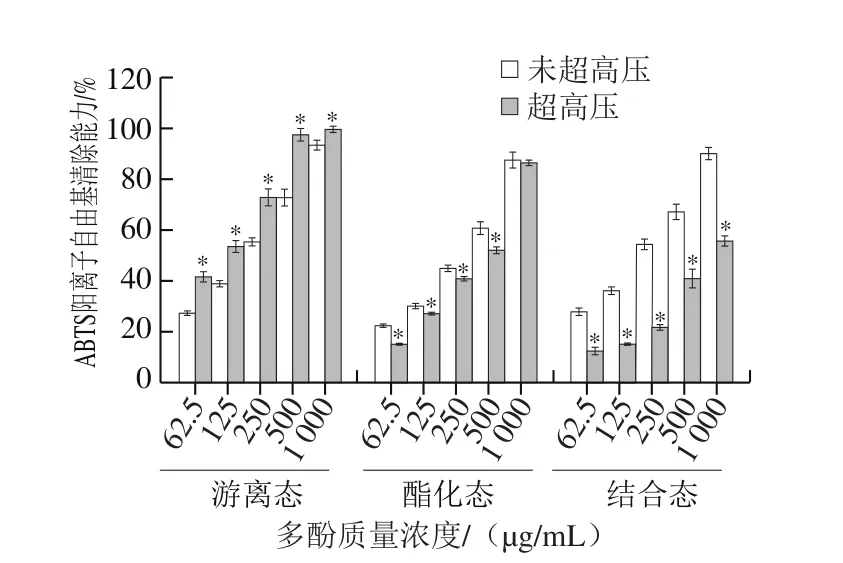
图3 未超高压和超高压预处理的紫色西番莲果皮提取物游离态、酯化态和结合态多酚的ABTS阳离子自由基清除能力Fig.3 ABTS cation radical scavenging activity of free, esterified and insoluble bound phenolic fractions from non-treated and UHP-treated peel of P.edulis
2.3.3 超高压预处理对PEP提取物不同形态多酚铁离子还原能力的影响
超高压预处理前后,PEP 3 种形态多酚的FRAP如图4所示,6 个组的FRAP均表现出与DPPH自由基和ABTS阳离子自由基清除能力相同的规律。超高压预处理前后,相同质量浓度、同种形态多酚组的FRAP有显著性差异(P<0.05),与各组多酚含量表现出相同变化规律,各组FRAP可能与多酚类物质良好的抗氧化作用有关。另外,经过超高压预处理的游离态多酚的FRAP最大,达到(970.26±22.85)μmol Fe2+/g提取物。
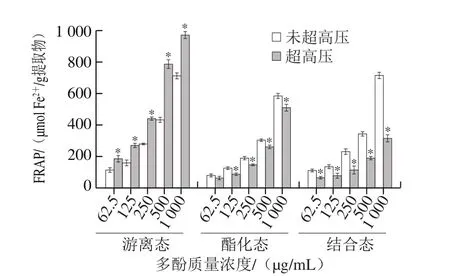
图4 未超高压和超高压预处理的紫色西番莲果皮提取物的游离态、酯化态和结合态多酚的FRAPFig.4 Ferric reducing antioxidant power (FRAP) of free, esterified and insoluble bound phenolic fractions from non-treated and UHP-treated peel of P.edulis
2.4 超高压预处理对PEP提取物不同形态多酚对HepG2细胞氧化损伤保护作用的影响
2.4.1 超高压预处理PEP提取物不同形态多酚对HepG2细胞内ROS相对含量的影响
ROS是正常细胞代谢产生的内源性自由基之一[26]。ROS可以作为体内的信号传递物质,但如果ROS过量积累则将攻击身体组织、器官和细胞,导致慢性疾病[27]。H2O2容易穿透细胞膜,是最常见的ROS产生源,因此本实验采用H2O2诱导HepG2细胞构建氧化损伤模型[28]。MTT实验结果表明样品在100 μg/mL对该细胞无毒,故后续实验采用此浓度。如图5A所示,经H2O2处理的模型组荧光信号明显向右偏移(P<0.05),说明经过处理后模型组细胞产生了大量的ROS。将空白组ROS水平设为100%,由图5B定量结果可知,H2O2处理后细胞产生的ROS相对含量高达(172.36±5.13)%,经过VC处理后,细胞产生的ROS相对含量为(101.43±2.31)%,显著低于模型组(P<0.05)。经过样品处理后,未超高压和超高压预处理的PEP中3 种形态多酚处理组的细胞内ROS相对含量较模型组显著降低(P<0.05),尤其是酯化态多酚处理组中细胞内ROS相对含量(未超高压组为(105.46±2.84)%、超高压组为(101.74±3.46)%)与VC组相比没有显著性差异(P>0.05)。超高压预处理后,游离态多酚处理组细胞内ROS相对含量与未超高压组相比没有显著性差异,而结合态多酚处理组细胞内ROS含量显著升高(P<0.05),可能是因为超高压预处理PEP中结合态多酚显著减少。有研究报道,棕榈果超高压预处理后多酚提取物对H2O2诱导HepG2细胞的氧化损伤所引起ROS含量增加的抑制作用均强于未超高压组[9],这与本实验得到的结果不完全相同。然而棕榈果中结合态多酚保护作用最优,使用质量浓度为120 μg/mL,高于本实验所用质量浓度,但效果与本研究同条件下得到的结合态多酚接近,因此可推知PEP中各类形态多酚都有很好的细胞氧化损伤保护作用。


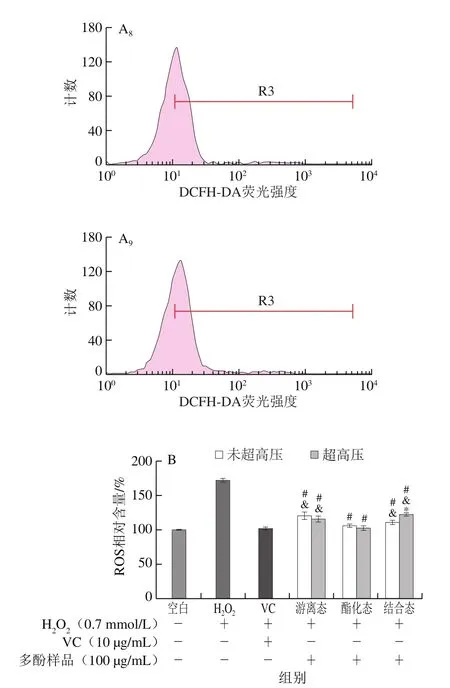
图5 未超高压和超高压预处理的紫色西番莲果皮提取物游离态、酯化态和结合态多酚对H2O2引起的细胞内ROS生成的抑制作用Fig.5 Inhibitory effects of free, esterified and insoluble bound phenolic fractions from non-treated and UHP-treated P.edulis peel on H2O2-induced formation of intracellular ROS in HepG2 cells
2.4.2 超高压预处理PEP提取物不同形态多酚对HepG2细胞凋亡水平的影响
细胞凋亡本来是机体正常运转的一种生理现象,然而氧化损伤等原因会造成细胞不正常凋亡[21]。由图6可知,与空白组相比,H2O2处理显著增加了模型组HepG2细胞的凋亡率(P<0.05)。经过VC处理,细胞凋亡率较模型组显著降低(P<0.05)。经过样品处理后,不同形态多酚的细胞凋亡率较模型组均显著下降(P<0.05),其中未超高压处理的酯化态和结合态多酚的细胞凋亡率与阳性对照组没有显著性差异(P>0.05)。超高压预处理后的PEP提取物中酯化态和结合态多酚的细胞凋亡率较未超高压组显著增高(P<0.05),可能是因为超高压预处理后总酚含量有所下降。整体来看,PEP中游离态、酯化态和结合态多酚均能对氧化损伤引起的细胞凋亡起到良好的保护作用。
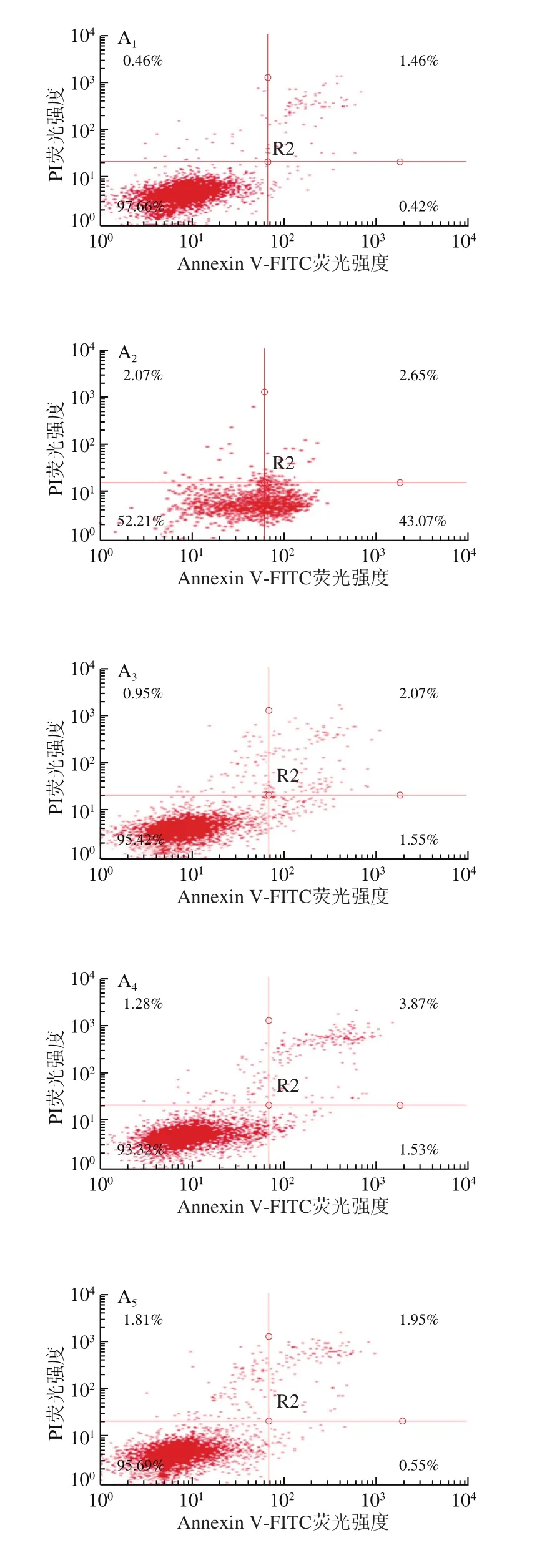

图6 未超高压和超高压预处理的紫色西番莲果皮提取物的游离态、酯化态和结合态多酚对H2O2造成的HepG2细胞凋亡的保护作用Fig.6 Cytoprotective effect of free, esterified and insoluble bound phenolic fractions from non-treated and UHP-treated P.edulis peel on H2O2-induced HepG2 cells
3 结 论
本实验以PEP为原料,研究超高压预处理对其游离态、酯化态和结合态多酚抗氧化能力和细胞保护能力的影响。结果表明,超高压预处理显著提高了PEP中3 种形态多酚的提取率,同时显著提高了PEP中游离、酯化和结合态多酚和黄酮含量。对于不同提取物而言,游离态多酚和黄酮含量及其体外抗氧化活性显著升高,然而结合态和酯化态多酚含量及体外抗氧化能力降低。对于3 种不同形态多酚,超高压处理后游离态多酚和黄酮含量最高,并显示出最强的DPPH自由基和ABTS阳离子自由基清除能力以及最高的FRAP,各类多酚的抗氧化能力与其含量呈正相关,与之前的报道结果[24,29]相似。未超高压和超高压预处理的PEP中3 种提取物均表现出很好的细胞保护作用,可以有效地降低H2O2诱导HepG2细胞产生ROS的含量和H2O2诱导HepG2细胞的凋亡率,其中酯化态多酚的效果最好。可能是因为西番莲果皮提取物中酯化态酚类物质具备更好的自由基清除能力,已有研究人员发现,花生皮中酯化态酚类化合物具有最强的抗氧化能力,其主要成分为儿茶素和表儿茶素等黄酮类成分[25],西番莲果皮经超高压预处理后,黄酮类物质显著升高,但主要成分有待进一步考证。综上,超高压预处理可显著提高PEP的游离态多酚含量和抗氧化能力,能更高效地增加其在功能食品和营养食品工业中的应用和经济价值。
