色氨酸抑制体外模型中晚期糖基化终末产物形成机理
2022-02-15刘炜妍郑晓燕郑丽丽艾斌凌盛占武张伟敏
刘炜妍,郑晓燕,杨 旸,郑丽丽,艾斌凌,钟 爽,校 导,盛占武,*,张伟敏,*
(1.海南大学食品科学与工程学院,海南 海口 570228;2.中国热带农业科学院海口实验站,海南 海口 570102)
晚期糖基化终产物(advanced glycation end products,AGEs)是通过氨基酸的游离氨基和生物大分子(糖类、蛋白质、核酸等)的游离羰基发生非酶褐变产生的一系列化合物。目前已发现的AGEs有20 种,依据荧光性特性可分为荧光AGEs和非荧光AGEs,其中Nε-羧甲基赖氨酸(Nε-carboxymethyllysine,CML)和Nε-羧乙基赖氨酸(Nε-carboxyethyllysine,CEL)是非荧光AGEs的重要代表[1]。已有研究表明,AGEs与许多人体慢性疾病息息相关,如糖尿病、肾脏疾病、阿尔茨海默症、心脑血管疾病等[2-3]。约10%食源性AGEs能够进入人体血液循环,其中1/3通过肾脏排出,其余的2/3蓄积在肾脏中[4]。食源性AGEs的产生通常会受到食品成分、加工和贮藏方法等因素的影响[1,5]。控制食品中AGEs常见的方法有改进加工工艺、调整食品配方或添加具有抑制作用的物质等[5-6],其中添加天然产物抑制剂被认为是抑制AGEs形成的有效干预方法之一。目前国内外研究较多的是在食品中添加植物多酚,如将迷迭香酸加入到高蛋白中间水分食品模型中以抑制AGEs产生[7];在曲奇中添加根皮素可抑制AGEs的形成[8];将儿茶素添加于食用醋中,可减少AGEs和5-羟甲基糠醛的产生[9]。虽然植物多酚抑制效果较好,但会影响食品感官品质,如造成颜色加深、风味改变等[10-11]。因此探寻一种安全、稳定、有效的AGEs抑制剂对食品加工行业具有重要意义。
氨基酸因其同时具有氨基和羧基,从而可以通过捕获美拉德反应中间产物——活性二羰基化合物抑制AGEs的形成,如含硫氨基酸和富硫蛋白可以通过捕集电子化合物和中间体来减少或抑制AGEs的形成;其次,氨基酸还可抑制糖基化蛋白之间的交联,进而减少AGEs的生成,例如,精氨酸通过防止蛋白质聚集和提高蛋白质的溶解度来抵抗糖基化作用[12]。此外,氨基酸作为糖基化抑制剂,还能提升食品的风味。在土豆模型体系中添加甘氨酸能够促进2,3-二甲基吡嗪、三甲基吡嗪、2-乙基-3,5-二甲基吡嗪、四甲基吡嗪和2,5-二乙基-3-甲基吡嗪(熟土豆香气的关键成分)的形成,提高总挥发性物质的产量[13];在对牛肉酶解液美拉德反应模型研究中发现,最佳牛肉调味基料组合为半胱氨酸3.5%(质量分数,下同)、丙氨酸1.2%、甘氨酸1.2%、天冬氨酸1.05%[14]。因此,氨基酸有望成为一种既能减少AGEs形成又能改善食品风味的食源性AGEs抑制剂。
目前关于氨基酸抑制AGEs形成的研究基本上都是针对内源性AGEs,而对食品体系中AGEs的抑制鲜有报道。鉴于此,本实验选取文献中报道的可能具有抗糖基化作用的13 种氨基酸[12,15-17],利用牛血清白蛋白(bovine serum albumin,BSA)-果糖、BSA-丙酮醛(methylglyoxal,MGO)模型评估其抑制AGEs的能力,从中选出抑制效果最好的氨基酸,并建立美拉德反应不同阶段化学模型,即BSA-果糖模型、BSA-MGO模型、BSA-乙二醛(glyoxal,GO)模型和精氨酸(arginine,Arg)-MGO模型,分析氨基酸对荧光AGEs、CML和CEL的抑制效果,并进一步探究其抑制机理。
1 材料与方法
1.1 材料与试剂
半胱氨酸(cystine,Cys)、苯丙氨酸(phenylalanine,Phe)、蛋氨酸(methionine,Met)、甘氨酸(glycine,Gly)、谷氨酸(glutamicacid,Glu)、精氨酸(Arg)、赖氨酸(lysine,Lys)、脯氨酸(proline,Pro)、色氨酸(tryptophan,Trp)、苏氨酸(threonine,Thr)、天冬氨酸(asparticacid,Asp)、缬氨酸(valine,Val)、组氨酸(histidine,His)、GO(质量分数40%溶液)、MGO(质量分数40%溶液)上海源叶生物科技有限公司;BSA 中科瑞泰(北京)生物科技有限公司;果糖 上海麦克林生化科技有限公司;氨基胍(amino guanidine,AG) 美国Sigma公司;甲酸(质谱级)、乙腈(质谱级) 上海易恩化学技术有限公司;磷酸二氢钠、磷酸氢二钠、叠氮化钠、硼氢化钠、硼砂、三氯乙酸、丙酮、盐酸、氨水均为分析纯。
1.2 仪器与设备
SPX-250B-2型恒温生化培养箱 上海博迅实业有限公司;S20K型pH计、PL303 型电子天平 瑞士梅特勒-托利多仪器有限公司;F-7000荧光分光光度计日本岛津公司;DL SK-5/20旋转蒸发仪 郑州科泰实验设备有限公司;JP-080B超声清洗仪 深圳市洁盟清洗设备有限公司;0.22 μm水系针筒过滤器 上海亚兴试剂公司;SCIEX Triple Quad 6500+超高效液相色谱串联质谱(ultra-high liquid chromatograph-tandem mass spectrometer,UPLC-MS/MS)仪 美国Agilent公司。
1.3 方法
1.3.1 氨基酸抑制剂的筛选
1.3.1.1 BSA-果糖模型的建立
利用BSA-果糖模型监测BSA蛋白糖基化过程。用0.2 mol/L、pH 7.4的磷酸盐缓冲溶液(含质量分数0.06%的叠氮化钠,用于防止微生物生长)分别配制1.5 mol/L的果糖和60 mg/mL BSA溶液。将1.5 mL BSA溶液和1.5 mL果糖溶液、0.5 mL氨基酸溶液(300 μg/mL)在带有螺帽的10 mL试管中混匀后在50 ℃下反应24 h。分别用0.5 mL磷酸盐缓冲溶液(0.2 mol/L、pH 7.4)和0.5 mL、300 μg/mL AG溶液代替氨基酸溶液作为空白和阳性对照。然后,通过F-7000荧光分光光度计在370 nm的激发波长和440 nm的发射波长下测定所有反应溶液的荧光强度,每组实验重复3 次,取其平均值,按式(1)计算AGEs抑制率。

式中:F氨基酸样品组为氨基酸样品组相对荧光强度;F空白组为空白组相对荧光强度。
1.3.1.2 BSA-MGO模型的建立
参考文献[18]建立BSA-MGO糖基化模型以评估氨基酸捕获AGEs中间体——活性二羰基化合物的能力。用0.2 mol/L、pH 7.4的磷酸盐缓冲溶液(含质量分数0.02%叠氮化钠)分别配制300 μg/mL氨基酸溶液、60 mmol/L MGO溶液和30 mg/mL BSA溶液。向试管中依次加入0.5 mL 300 μg/mL的氨基酸溶液和1.5 mL、60 mmol/L的MGO溶液,混匀后在37 ℃下反应2 h,然后再加入1.5 mL质量浓度为30 mg/mL的BSA溶液。在37 ℃下反应3 d后,用F-7000荧光分光光度计在350 nm的激发波长和440 nm的发射波长下测定所有反应溶液的荧光强度。分别用0.5 mL磷酸盐缓冲溶液(0.2 mol/L、pH 7.4)和0.5 mL、300 μg/mL AG溶液代替氨基酸溶液作为空白和阳性对照。每组实验重复3 次,取平均值,按照公式(1)计算AGEs抑制率。
1.3.2 氨基酸对糖基化模型荧光性AGEs的抑制作用分析
1.3.2.1 BSA-果糖模型的建立
根据Sheng Zhanwu等[19]的研究方法并稍作修改建立BSA-果糖模型。用0.2 mol/L、pH 7.4的磷酸盐缓冲溶液(含0.02%叠氮化钠)配制1.5 mol/L果糖溶液、60 mg/mL BSA溶液及(200、500、1 000、1 500 μg/mL和2 000 μg/mL)Trp溶液。向带有螺帽的10 mL试管中分别加入1.5 mL BSA溶液、1.5 mL果糖溶液和0.5 mL不同质量浓度的Trp溶液,混匀后在50 ℃条件下恒温反应24 h。分别用0.5 mL磷酸盐缓冲溶液(0.2 mol/L、pH 7.4)和0.5 mL AG溶液(质量浓度同Trp)代替氨基酸溶液作为空白和阳性对照。然后,通过F-7000荧光分光光度计在370 nm的激发波长和440 nm的发射波长下测定所有反应溶液的荧光强度,每组实验重复3 次,取平均值,按照公式(1)计算AGEs抑制率。
1.3.2.2 BSA-GO/MGO模型的建立
根据Shen Yixiao等[18]的研究方法并稍作修改建立BSA-GO/MGO模型。将0.5 mL的Trp溶液(200、500、1 000、1 500 μg/mL和2 000 μg/mL)或AG溶液(质量浓度同Trp)(均由0.2 mol/L、pH 7.4的磷酸盐缓冲溶液配制)分别与1.5 mL、60 mmol/L MGO或GO溶液混匀,随后在37 ℃孵育2 h,然后再加入1.5 mL的30 mg/mL BSA溶液(所有反溶液均用0.2 mol/L、pH 7.4的磷酸盐缓冲溶液配制)。在37 ℃下反应3 d后,用F-7000荧光分光光度计在350 nm的激发波长和440 nm的发射波长下测定所有反应溶液的荧光强度。分别用0.5 mL磷酸盐缓冲溶液(0.2 mol/L、pH 7.4)和0.5 mL AG溶液(质量浓度同Trp)代替氨基酸溶液作为空白和阳性对照。每组实验重复3 次,取平均值,按照公式(1)计算AGEs抑制率。
1.3.2.3 Arg-MGO模型的建立
Arg-MGO模型按照Sheng Zhanwu等[19]描述的方法建立并稍作修改。用0.2 mol/L、pH 7.4的磷酸盐缓冲溶液(含质量分数0.02%叠氮化钠)分别配制0.5 mL(200、500、1 000、1 500 μg/mL和2 000 μg/mL)Trp溶液、AG溶液(质量浓度同Trp)和1.5 mL、60 mmol/L MGO溶液,Trp溶液和MGO溶液混匀后在37 ℃下反应2 h,然后再加入1.5 mL、30 mg/mL的Arg溶液(由含有0.02%叠氮化钠的0.2 mol/L、pH 7.4的磷酸盐缓冲溶液现用现配)。在37 ℃下反应3 d后,用F-7000荧光分光光度计在350 nm激发波长和440 nm发射波长下记录荧光强度。用0.5 mL磷酸盐缓冲溶液(0.2 mol/L、pH 7.4)和0.5 mL质量浓度同Trp的AG溶液分别代替氨基酸溶液作为空白和阳性对照,每组实验重复3 次,取平均值,按照公式(1)计算AGEs抑制率。
1.3.2.4 荧光AGEs荧光强度的测定
利用F-7000荧光分光光度计记录添加和未添加Trp溶液的天然和糖基化的BSA荧光强度。激发波长下从200~600 nm扫描发射光谱。带宽、激发狭缝和发射狭缝均设置为5.0 nm,扫描速率为2 400 nm/min。将所有样品扫描3 次,计算荧光强度平均值。
1.3.3 氨基酸对非荧光性CML/CEL形成的抑制作用分析
参考Chen Yuanyuan等[20]的方法并作适当的修改分析氨基酸对非荧光性CML/CEL形成的抑制作用,将上述BSA-果糖模型反应体系溶液加入带有螺帽的10 mL试管中,在50 ℃下恒温反应2 d,用不添加氨基酸的反应体系溶液作为空白组。取0.2 mL反应体系溶液、0.2 mL硼酸盐缓冲液(0.2 mol/L、pH 9.2)和0.2 mL、2 mol/L的硼氢化钠(利用0.1 mol/L氢氧化钠溶液现用现配),充分涡旋振荡,置于4 ℃冰箱避光还原12 h。还原结束后,向样品溶液中加入1 mL体积分数20%三氯乙酸溶液,并在4 ℃、14 000×g的条件下离心10 min,弃去上清液,收集蛋白质沉淀。使用200 μL、体积分数5%丙酮溶液洗涤蛋白质沉淀2 次,并用氮气吹干。加入1 mL、6 mol/L的盐酸,氮气保护,在110 ℃条件下水解24 h,然后氮吹除去盐酸。将干燥的蛋白质水解物重新溶于2 mL超纯水中,取0.5 mL蛋白水解溶液通过固相萃取柱。固相萃取柱(Cleanert PCX,150 mg/6 mL)萃取条件如下:分别使用3 mL甲醇和3 mL蒸馏水依次通过固相萃取柱活化,上样后按顺序依次使用3 mL甲醇和3 mL蒸馏水对样品进行淋洗,使用6 mL氨化甲醇(V(甲醇):V(氨水)=95∶5)洗脱目标化合物。旋转蒸发除去甲醇后再重新溶解于2 mL的体积分数0.1%甲酸-水溶液中,使用0.22 μm的有机滤头过滤后通过UPLC-MS/MS分析样品,每组实验重复3 次取平均值,按照公式(2)计算AGEs抑制率。

式中:ρ氨基酸样品组为氨基酸样品组样品质量浓度/(ng/mL);ρ空白组为空白组样品质量浓度/(ng/mL)。
UPLC条件:色谱柱:X-Bridege C18(4.6 mm×150 mm,5 μm);流速0.3 mL/min;进样量2 μL;柱温:30 ℃;运行时间:5 min。流动相A:0.2%甲酸-水溶液、B:乙腈。梯度洗脱条件:0~0.5 min,90% A;0.5~3.5 min,90%~40% A;3.5~4.5 min,40%~90% A;4.5~5.0 min,90% A。
MS/MS条件:将电喷雾电离(electrospray ionization,ESI)离子源设置为正离子极性模式。采用多反应监控模式(multiple reaction monitoring,MRM);离子源温度300 ℃;锥孔电压1.03×105Pa;毛细管电压4 kV;MRM模式的设置:m/z205.0~84.2、m/z205.0~130.2、m/z219.0~84.2、m/z219.0~130.6。
1.3.4 UPLC-MS/MS鉴定色氨酸-羰基衍生物
参照Tang Yao等[21]的方法并略作修改鉴定Trp-羰基衍生物。将Trp和MGO溶解在新鲜制备的0.01 mol/L、pH 7.4的磷酸盐缓冲溶液中,定容至100 mL,使得Trp溶液和MGO溶液的终浓度均为10 mmol/L,取50 mL样品溶液于锥形瓶中,在37 ℃、60 r/min的水浴恒温振荡器中振荡。然后在30、60、120 min和16 h时取反应样品,于-80 ℃的冰箱中备用。
运用UPLC-MS/MS对反应后的衍生物进行测定。UPLC条件:色谱柱:X-Bridege C18(4.6 mm×150 mm,5 μm);柱温:25 ℃;运行时间:8.5 min;流动相A:体积分数0.1%甲酸-水溶液,B:体积分数0.1%甲酸-乙腈溶液。洗脱梯度:0~0.1 min,95% A;0.1~3.0 min,95%~25% A;3.0~7.0 min,25% A;7.0~8.0 min,25%~95% A;8.0~8.5 min,95% A。
MS/MS条件:离子化方式:ESI;毛细管电压:1.8 kV;鞘气:氮气,流速:35 psi;辅助气流速:10 psi;高纯度氩气用作诱导碰撞解离(collision-induced dissociation,CID)及冷却气;CID中碰撞能量:35 eV;一级、二级离子扫描范围:m/z190~1 000;仪器控制、数据采集及分析应用UPLC-MS/MS solution 3.41软件。
1.4 数据处理与分析
所有实验均进行3 次重复,采用GraphPad Prism 5、ChemDraw 19.0、Origin 2019软件作图,采用SPSS Statistics 25软件进行数据统计分析,模型体系中添加和未添加氨基酸处理及AG对照组之间的抑制能力变化使用单因素方差分析检验有统计学意义后再用最小显著性差异法(least significant difference,LSD)检验进行组间两两比较,以P<0.05为具有差异统计学意义。
2 结果与分析
2.1 13 种氨基酸在抑制AGEs活性比较
BSA-果糖模型通常用于评估蛋白质糖基化,在BSA-果糖模型中,果糖和果糖的氧化产物都与蛋白质反应生成AGEs。BSA-MGO模型通常用于评估蛋白质糖基化的中间阶段,因为省略了从糖到羰基的转化[18,22],MGO与蛋白质的氨基酸残基发生不可逆的反应,最终导致AGEs的形成[23]。本研究利用BSA-果糖模型(图1)与BSAMGO模型(图2)评估13 种可能具有抗糖基化作用的氨基酸(Cys、Phe、Met、Gly、Glu、Arg、Lys、Pro、Trp、Thr、Asp、Val和His)[12,15-17]在抑制荧光AGEs形成方面的能力。在BSA-果糖模型中,除Glu和Asp外,其他11 种氨基酸均对BSA的早期糖基化表现出不同程度的抑制活性,这与以往的研究结果[22]一致。His对荧光AGEs的抑制效果最好,抑制率为15.02%,其次是Trp,抑制率为8.37%。氨基酸对BSA的早期糖基化表现出不同的抑制活性,这主要是由于早期糖基化过程中氨基酸对活性氧和早期糖基化产物果糖胺的抑制效果不同引起的[16-17]。这种在糖基化早期阶段的抑制,有利于避免形成反应性更高的中间产物(活性二羰基化合物)和毒性更高的AGEs。
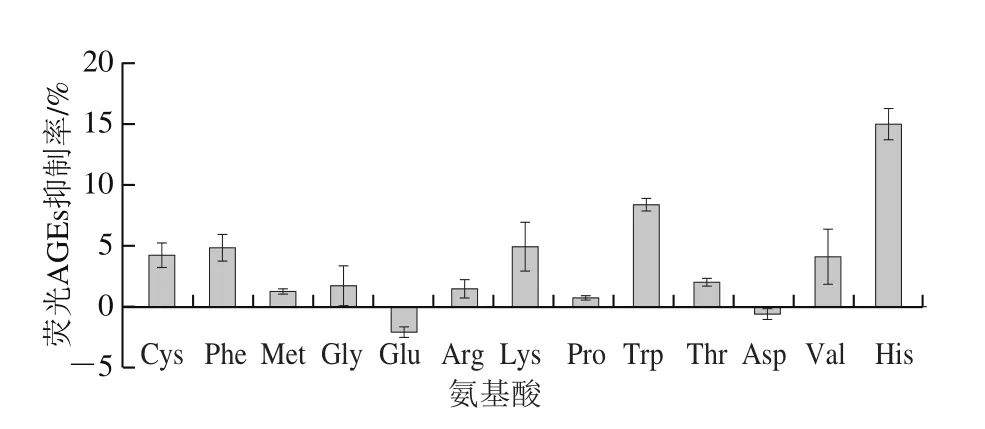
图1 BSA-果糖模型中13 种氨基酸对荧光AGEs抑制率的影响Fig.1 Inhibitory effects of 13 amino acids on the formation of fluorescent AGEs in BSA-fructose model
如图2所示,在BSA-MGO模型中,13 种氨基酸只有7 种氨基酸(Glu、Lys、Pro、Trp、Thr、Val和His)具有抑制荧光AGEs形成的能力。其中,Trp的抑制活性最高,达到81.66%,其次是Gly和His,抑制率分别为77.10%和64.13%。这种差异可能是由于不同氨基酸对美拉德反应期间产生的活性二羰基化合物捕获能力不同,也可能是不同氨基酸中氨基数量不等,导致其在抗糖基化能力上存在差异[17]。已有研究证明,Trp衍生物吲哚及5-羟色胺具有良好的捕获MGO、GO、2,3-丁二酮和2,3-戊二酮等醛类物质的能力[24-25]。因此,本实验选择具有较好荧光AGEs抑制效果的Trp进行后续研究。
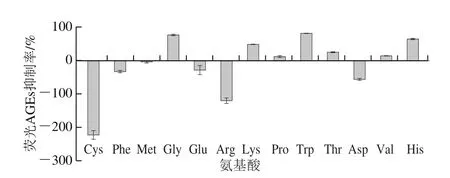
图2 BSA-MGO模型中13 种氨基酸对荧光AGEs抑制率的影响Fig.2 Inhibitory effects of 13 amino acids on the formation of fluorescent AGEs in BSA-MGO model
2.2 Trp对BSA-果糖、BSA-MGO、BSA-GO及Arg-MGO模型体系中AGEs抑制率的影响
非酶糖基化是蛋白质、核酸、脂质等生物大分子与还原糖之间发生的复杂美拉德反应,可产生AGEs[26]。其中,AGEs含量可以直接反映美拉德反应中生物大分子的羰基化程度[27]。鉴于此,本研究评价了Trp在BSA-果糖模型(早期糖基化)、BSA-MGO与BSA-GO模型(中期糖基化)以及Arg-MGO模型(易被MGO攻击并引起不可逆蛋白质修饰)体系中对荧光AGEs的抑制活性。如图3A所示,在BSA-果糖模型中,Trp对荧光AGEs的抑制效果与其质量浓度呈正相关,在200~2 000 μg/mL之间,其抑制率从(-2.41±1.55)%增加到(15.82±1.36)%,抑制率较低,原因可能是Trp主要是通过作为羰基捕获剂来实现对AGEs的抑制[24-25],而在美拉德反应初期,活性二羰基化合物的生成量还很低;因此,在美拉德反应的初期,抑制效果并不是十分明显。
在糖基化中间阶段BSA-MGO和BSA-GO模型体系中,Trp对荧光AGEs的抑制也显示出显著的质量浓度依赖性(P<0.05)。如图3B所示,在BSA-MGO模型中,在Trp质量浓度为200 μg/mL时,对荧光AGEs的抑制率为(23.59±9.81)%,当Trp质量浓度增加到2 000 μg/mL时,其抑制率增加到(86.78±0.67)%。在质量浓度分别为1 500 μg/mL和2 000 μg/mL时,Trp与阳性对照组(AG)对荧光AGEs的抑制率差异不明显。如图3C所示,在BSA-GO模型中,当Trp质量浓度为200 μg/mL时,对荧光AGEs的抑制率为(26.38±6.74)%,随着Trp质量浓度增加到2 000 μg/mL时,抑制率增加到(89.89±4.11)%,与阳性对照(AG)的抑制率差异不明显。与BSA-MGO模型体系相比,Trp在BSA-GO模型体系中对荧光AGEs的抑制能力更强。相对于副作用较大的AG[12,15],Trp作为无毒无害的天然AGEs抑制剂具有更大的优势。
如图3D所示,在Arg-MGO模型中,含有Trp的反应溶液对荧光AGEs的抑制率随着质量浓度的提高而增大,从200 μg/mL时的(11.79±3.36)%显著增加到2 000 μg/mL时的(69.83±1.02)%(P<0.05),此时,与阳性对照(AG)的抑制率差异明显。以往的研究证明,某些氨基酸在糖基化的后期阶段具有较强的AGEs抑制作用,如Asp可以与Arg残基作用,从而稳定蛋白质;His结构中的伯胺可以抵抗蛋白质交联[28],此外,氨基乙酰化也是氨基酸抑制糖基化的原因之一[15,21]。图3结果说明Trp在BSA-GO模型体系中的抑制效果最佳,其次是在BSA-MGO和Arg-MGO模型体系中,而在BSA-果糖模型中抑制效果较不明显。因此,在糖基化中间阶段具有较高荧光AGEs抑制能力的Trp,可以作为羰基化合物的有效清除剂,这与以往的研究结果[16]一致。
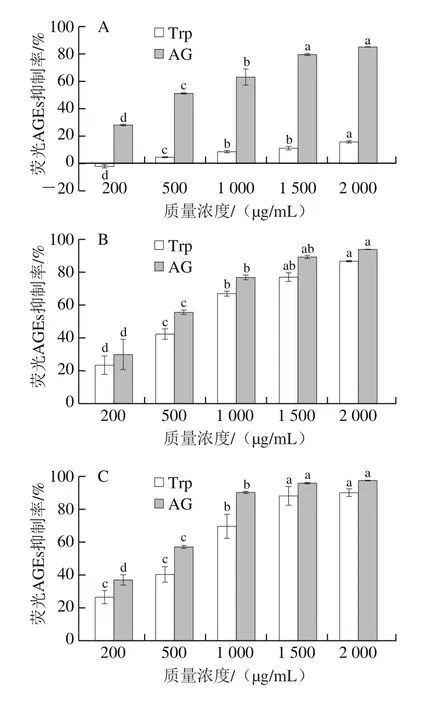
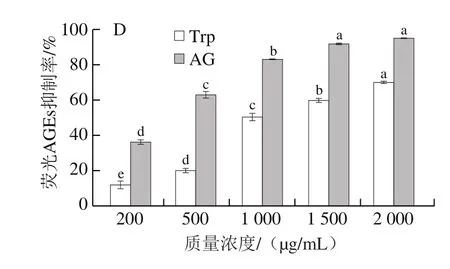
图3 BSA-果糖(A)、BSA-MGO(B)、BSA-GO(C)和Arg-MGO(D)模型中Trp对荧光AGEs抑制率的影响Fig.3 Inhibitory effect of Trp on the formation of AGEs in BSA-fructose (A), BSA-MGO (B), BSA-GO (C) and Arg-MGO (D) models
2.3 Trp抑制BSA-果糖体系中CML及CEL形成的活性
CML和CEL是在美拉德反应过程中产生的两个典型的非交联性AGEs[29],也是非荧光AGEs的重要代表[30-31]。因此,本实验考察了Trp在BSA-果糖体系中对CML和CEL的抑制效果。结果如图4、5所示,当质量浓度在200~1 000 μg/mL之间时,随着Trp质量浓度的提高,其对CML的抑制率从(-5.83±1.37)%增加到(41.81±12.05)%,继续提高质量浓度时,Trp对CML的抑制率又呈现出显著的下降趋势;当质量浓度为2 000 μg/mL时,对CML的抑制率降低到(6.35±0.50)%。因此,不同质量浓度Trp对CML抑制率的影响大体上呈钟形曲线趋势,在1 000 μg/mL时,Trp对CML的抑制率达到最大,为(41.81±12.05)%。与CML相比,体系中CEL的含量相对较少(图4),但Trp对CEL的抑制趋势与CML的基本一致。当质量浓度从200 μg/mL提高到1 000 μg/mL时,Trp对CEL的抑制率达到最大值((38.41±3.16)%),当继续提高Trp质量浓度时,抑制率呈现显著的下降趋势(P<0.05),质量浓度达2 000 μg/mL时,抑制率降低至(9.16±5.34)%。已有研究证明,GO是CML形成的中间产物,MGO是CEL形成的中间产物[31-32],一些氨基酸可以通过清除醛类物质(如GO、MGO)的方式来抑制AGEs的形成[22]。因此,Trp可能是通过捕获活性二羰基化合物(GO、MGO)的方式来抑制CML和CEL的产生,这与4 个模型体系中Trp对荧光性AGEs的抑制情况一致。
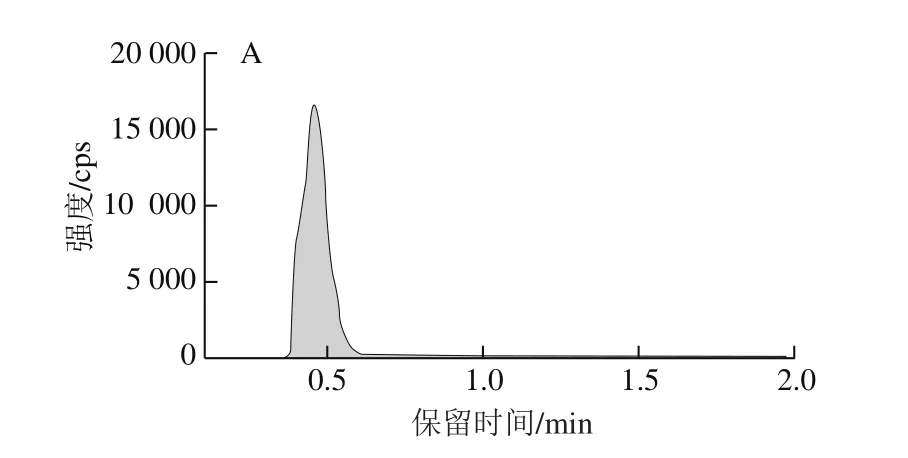
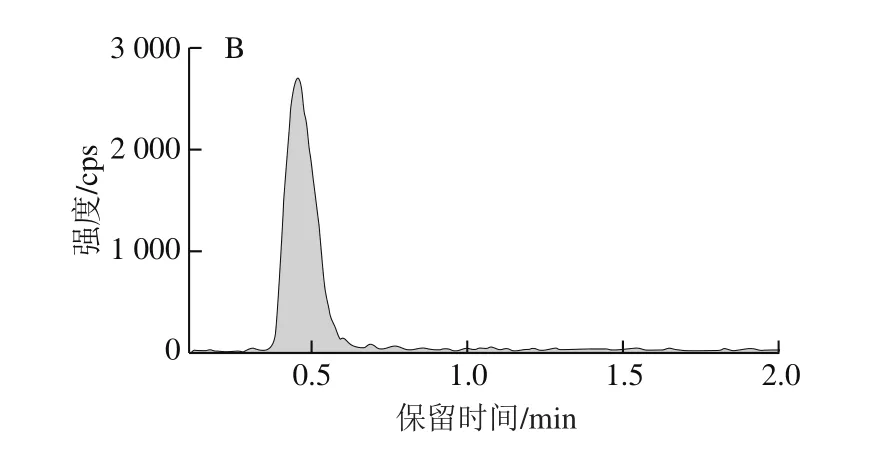
图4 CML(A)及CEL(B)的离子色谱图Fig.4 Ion chromatogramas of Nε-carboxymethyllysine (CML) (A) and Nε-carboxyethyllysine (CEL) (B)

图5 BSA-果糖模型中Trp对CML及CEL抑制率的影响Fig.5 Inhibitory effect of Trp on fluorescent CML and CEL in BSA-fructose model
2.4 UPLC-MS/MS鉴定Trp-羰基衍生物
以往的文献已经报道,氨基酸和一些短肽具有抗糖基化活性[28]。因此,为进一步证实上述研究结果中的推测,厘清Trp抑制AGEs形成的原因,本研究利用UPLCMS/MS分析并鉴定Trp与MGO反应的产物。本研究共测得4 个加合产物,具体如表1与图6所示。根据检测到的4 种主要产物的相对分子质量,提出了两种可能的反应途径(图7)。路径1为Trp与MGO在C3位置发生亲电子芳香取代反应,在2.93 min时生成Trp-单-MGO加合物([M+Na]+=299.200)。路径2是在37 ℃生理条件下(0.01 mol/L、pH 7.4的磷酸盐缓冲溶液中),Trp在脱水后首先通过Pictet-Spengler缩合反应在1.89 min时产生脱水Trp-单-MGO加合物([M+K]+=297.200),而后又经过亲电子芳香取代和Pictet-Spengler反应在2.19 min时生成Trp-双-MGO加合物([M+H]+=331.200),最后在2.20 min时进一步发生Pictet-Spengler缩合反应产生Trp-三-MGO加合物([M+H]+=403.200)。Trp捕获MGO的方式与文献报道的某些Trp衍生物类似,例如,Trp热解产物吲哚可以在吲哚的C2和C3位置与醛类物质发生亲电芳香取代反应[24];5-羟色胺可以通过Pictet-Spengler缩合路径形成5-羟色胺-MGO加合物[21]。结果表明,Trp可以通过芳香亲电子取代和Pictet-Spengler反应形成4 种Trp-MGO加合物,进而减少以MGO为前体物质的AGEs的产生,其最高捕获MGO能力为3 mol(图6D),这与荧光AGEs、CML和CEL的研究结果一致。
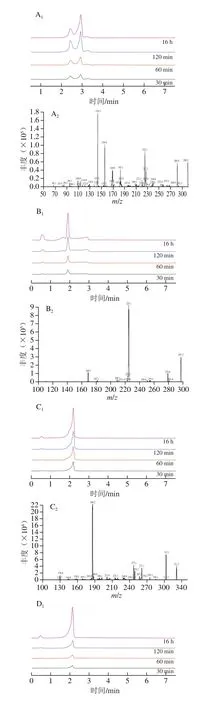

图6 不同反应时间下提取的4 种Trp-MGO加合产物离子色谱图和MS/MS光谱Fig.6 Ion chromatograms and tandem mass spectra of four Trp-MGO adducts extracted at different reaction times

图7 Trp与MGO反应生成Trp-MGO衍生物的模拟反应路径Fig.7 Possible reaction pathways for the reaction between tryptophan and MGO
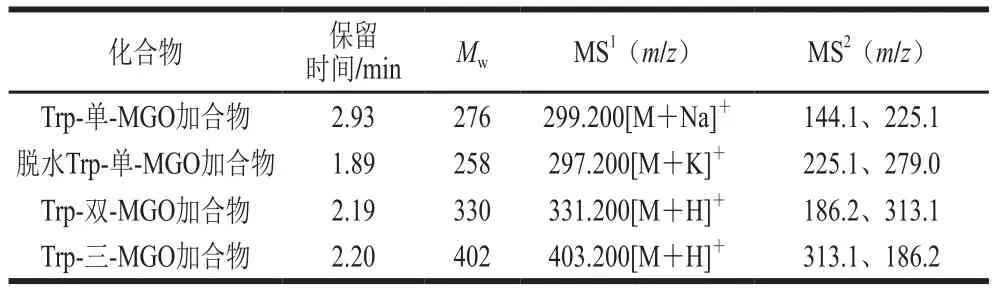
表1 不同反应时间下提取的Trp-MGO加合产物的ESI-MS/MS碎片离子Table 1 ESI-MS/MS fragment ions of Trp-MGO adducts at different reaction times
3 结 论
在本研究中,Trp对荧光AGEs、非荧光AGEs(CML和CEL)的形成均具有抑制作用,Trp在BSA-果糖、BSA-MGO、BSA-GO和Arg-MGO模型中的抗糖基化能力呈质量浓度依赖性。在这4 种模型中,Trp在美拉德反应中间阶段BSA-GO模型对荧光AGEs表现出最高的抑制率,抑制率可达89.89%,其次是在BSA-MGO模型和Arg-MGO模型。在Trp对CML和CEL抑制研究中发现,Trp对CML和CEL的抑制趋势与荧光AGEs的趋势不同,Trp质量浓度为1 000 μg/mL时抑制率最大,Trp抑制趋势呈钟形曲线。利用UPLC-MS/MS对Trp与MGO反应产物进行分析,共鉴定出4 个加合产物,分别为2 个Trp-单-MGO加合物、1 个Trp-双-MGO加合物以及1 个Trp-三-MGO加合物。Trp可以通过芳香亲电子取代和Pictet-Spengler反应的方式来捕获MGO,进而抑制AGEs的形成,其最高捕获能力为3 mol。
