苦丁茶对高胆碱饮食小鼠肝、肾及氧化应激的影响
2022-02-15吕鑫肖颖李荧庞钰鑫刘思静赵婉妤杨飞裴晓方许欣
吕鑫,肖颖,李荧,庞钰鑫,刘思静,赵婉妤,杨飞,裴晓方,许欣
(四川大学 华西公共卫生学院/华西第四医院,四川 成都 610041)
当今社会经济快速发展,人们生活水平得到了极大提高,富含胆碱、磷脂酰胆碱和左旋肉碱的食物(红肉、家禽、鱼及蛋类等)已成为日常食材。但摄入过量,会促进心脑血管疾病(cardiovascular disease,CVD)的发生,进而影响人们的生活质量。有研究预测,到2030年,全球死于心血管疾病的人数将达到2 330万,心血管疾病将继续占据全球死亡原因的榜首[1-2]。其中动脉粥样硬化(atherosclerosis,AS)被认为是CVD发病的重要病理基础[3]。众多研究结果表明,氧化应激贯穿于AS发生发展的整个过程当中[4],有研究证实高胆碱饮食会对AS病理过程中的氧化应激水平产生上调作用[5],但目前关于高胆碱饮食对健康影响的研究尚浅,值得进一步探究。
作为我国西南地区日常茶饮——苦丁茶,学名粗壮女贞,资源丰富,价格低廉。苦丁茶是一种富含多糖、多酚、黄酮、苯乙醇苷和生物碱等成分的天然植物,已有研究证实黄酮可通过抑制TLR4/NF-κB和PI3K/Akt信号通路显著改善高脂饮食诱导的肝脂肪变性和肝细胞损伤;酚类化合物的存在与茶籽油的抗氧化能力密切相关[6-9]。并且已有人群实验和动物实验表明苦丁茶能够有效地控制CVD的相关指标,具有促进心血管健康的功效[10]。苦丁茶的抗氧化、降“高血脂、高血糖、高血压”、减肥、保肝等作用,可能也有利于改善高胆碱饮食小鼠的健康问题[11]。
故本研究将对苦丁茶活性成分进行定性研究,再以高胆碱饮食C57BL/6J小鼠为实验对象,观察高胆碱饮食对小鼠体重、肝脏、肾脏以及氧化应激的影响,并探究不同剂量苦丁茶水提物对其改善作用,为后续研究提供数据支撑,奠定实验基础。
1 材料与方法
1.1 材料
1.1.1 实验样品
苦丁茶:青山绿水茶叶专业合作社(中国四川筠连)。
1.1.2 实验动物
C57BL/6J小鼠(雌性,8 周龄,体重 19 g~22 g,SPF级):成都达硕生物科技有限公司 [许可证号:SCXK(川)2015-030]。
屏障级动物房饲养,环境温度20℃~25℃,相对湿度40%~70%,每天照明12 h,由四川大学华西公共卫生学院实验动物中心提供[使用许可证号:SYXK(川)2018-011]。
1.1.3 动物饲料
基础饲料(按照实验动物需求,配合饲料营养成分GB14924.3—2010《实验动物配合饲料营养成分》)、高胆碱饲料(基础饲料中加入1.3%胆碱):成都达硕实验动物有限公司。
1.1.4 实验试剂与仪器
甲酸、乙腈(色谱纯):德国CNW科技公司;小鼠丙二醛(malondialdehyde,MDA)酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA) 试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)酶联免疫吸附法ELISA试剂盒:上海酶联生物科技有限公司;全自动生化仪检测试剂:贝克曼库尔特生物实验有限公司。
高分辨质谱仪(Xevo G2-XS QTof)、高效液相色谱仪(ACQUITY UPLC)、色谱柱(ACQUITY UPLC BEH C18,100 mm×2.1 mm,1.7 μm):美国沃特世有限公司;全自动生化分析仪(AU480):美国贝克曼库尔特有限公司;全波长酶标仪(multiskan GO 1510)、低温高速离心机(Sorvall Stratos):美国赛默飞世尔科技公司;组织匀浆机(Fastprep-24):美国 MP Biomedicals公司;光学显微镜(Eclipse Ci-L):日本尼康公司。
1.2 实验方法
1.2.1 苦丁茶样品制备
将苦丁茶研磨并用其10倍质量的超纯水在80℃下水浴提取1 h。将残余物再次水浴提取2次,过滤上清液。合并3次所得溶液的上清液,在60℃旋转蒸发仪中浓缩至1 g/mL。将苦丁茶水提物在115℃下灭菌15 min,在-20℃避光保存[12]。每日灌胃苦丁茶水提物现配现用,取适量1 g/mL苦丁茶水提物37℃水浴溶解,加入超纯水,稀释至35、70、140 mg/mL 3个浓度,装至1.5 mL无菌避光离心管中待用。
1.2.2 超高效液相色谱-飞行时间-质谱联用技术定性测定
吸取200 μL苦丁茶水提物,0.22 μm的有机相针孔过滤后,直接进行超高效液相色谱-飞行时间-质谱分析。色谱条件:柱温45℃;流动相:A-水(含0.1%甲酸),B-乙腈(含 0.1%甲酸);流速 0.4 mL/min;进样体积2 μL;梯度洗脱:16 min。质谱条件为离子源:电喷雾,120℃,+3/-2 kV;信号采集:正负离子扫描模式,m/z范围为50~1 000。UNIFI 1.8.1.软件采集原始数据,Progenesis QI v2.3软件处理数据,人类代谢组学数据库(the human metabolome database,HMDB) 和 Lipidmaps(v2.3)以及代谢物质谱数据库进行定性。
1.2.3 动物分组与处理
25只C57BL/6J小鼠适应喂养1周后,随机分为5组,每组5只,分别为空白对照组、模型对照组、苦丁茶低、中、高剂量组,按1 mL/kg bw灌胃,剂量设置见表1,连续灌胃4个月后处死。

表1 实验动物分组与处理情况(n=5)Table 1 Grouping and treatment of experimental animals(n=5)
1.2.4 标本采集及检验方法
1.2.4.1 小鼠一般情况观察
每天观察记录各组小鼠进食量、活动、毛色与精神状态及粪便情况。每周称重,记录体重变化,以样本采集前一天体重为终体重,计算各组小鼠在灌胃结束后的体重增量。
1.2.4.2 小鼠脏器相关检查
各组小鼠禁食不禁水12 h后,开始正式采集。处死小鼠后,分离小鼠内脏,尽量剥离周围结缔组织和脂肪组织,称重记录。根据样本采集当天记录的小鼠终体重以及其对应的肝脏、脾脏和肾脏的重量,分别计算各组小鼠的脏器指数(肝指数、脾指数、肾指数),公式如下。
脏器指数/%=脏器重量(g)/小鼠体重(g)×100
1.2.4.3 组织切片病理学检查
处死小鼠后,分离小鼠内脏,尽量剥离周围结缔组织和脂肪组织,4%多聚甲醛固定肝脏、肾脏24 h,蒸馏水洗涤,酒精脱水后,石蜡包埋切片,苏木精伊红(hematoxylin-eosin,HE)染色法染色后,在光学显微镜下200倍放大倍数观察并拍摄各组小鼠组织病理学改变。
1.2.4.4 肝、肾功能相关指标检测
小鼠经眼眶取血于1.5 mL离心管中,室温(21℃~25℃)下静置 30 min,3 000 r/min离心 30 min,取上层血清,于-80℃保存。采用全自动生化分析仪检测小鼠血尿素(blood urea,BU)、血肌酐(serumcreatinine,Scr)的水平;以及小鼠血清中总蛋白(total protein,TP)、白蛋白(albumin,ALB)、谷草辅酶(aspartate transaminase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、碱性磷酸酶(alkaline phosphatase,ALP)以及谷氨酰转肽酶(glutamyl transpeptidase,GGT)的水平。
1.2.4.5 小鼠肝脏氧化应激相关指标检测
取冻存-80℃小鼠肝脏组织标本(25 mg~30 mg),称重记录,置于匀浆管,加入500 μL磷酸盐缓冲液,匀浆机彻底打碎混匀,3 000 r/min离心10 min~15 min,取上层清液待测。将小鼠丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)的ELISA试剂盒从冷藏环境中取出,室温(21℃~25℃)下平衡1 h,按照说明测定小鼠肝脏组织匀浆中两指标的吸光值,并计算小鼠肝组织中两种指标水平。
1.3 统计分析
使用SPSS 22.0进行数据分析,以平均数±标准差表示,组间差异比较采用单因素方差分析(one-way ANOVA)比较处理,多组间两两比较时,方差齐采用最小显著性差异法,若方差不齐,采用Dunnett’s T3法,以α=0.05为检验水准。
2 结果与分析
2.1 苦丁茶活性成分
苦丁茶中含有的活性成分有四大类,各类中相对含量排列前五的代表性成分如表2所示,分别为黄酮类(1-5)、酚类(6-10)、三萜类(11-15)、生物碱(16-20)。
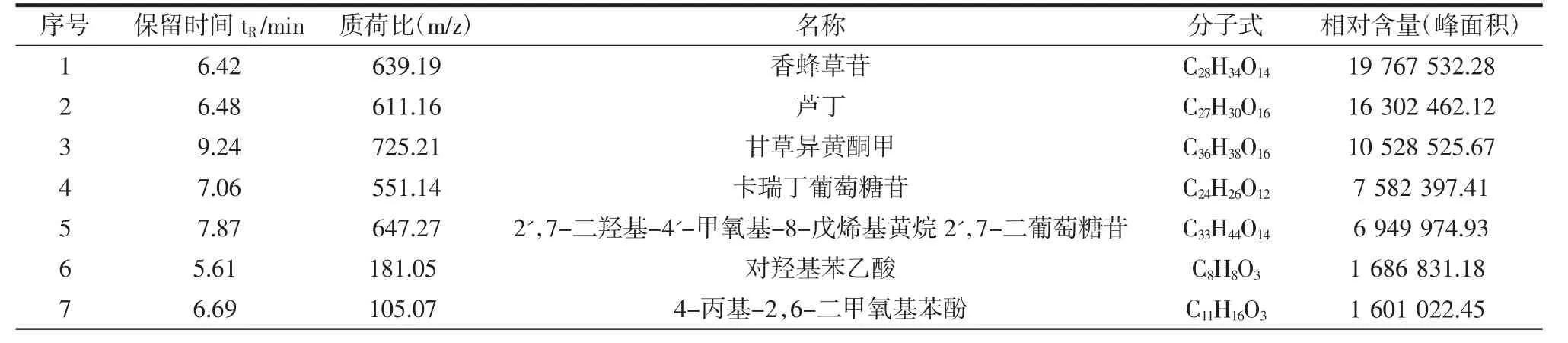
表2 苦丁茶中20种主要的活性成分超高效液相色谱-飞行时间-质谱定性结果Table 2 Identification of the main representative compounds in Kuding Cha by ultra performance liquid chromatography-time of flight-mass spectrometry

续表2 苦丁茶中20种主要的活性成分超高效液相色谱-飞行时间-质谱定性结果Continue table 2 Identification of the main representative compounds in Kuding Cha by ultra performance liquid chromatography-time of flight-mass spectrometry
由表2可见,苦丁茶水提物中含有丰富的黄酮类成分,且香蜂草苷含量最高,Feng等[8]发现其具有抗炎、抗氧化和保肝作用,主要通过抑制TLR4/NF-κB和PI3K/Akt信号通路显著改善高脂饮食诱导的肝脂肪变性和肝细胞损伤,该成分可能与苦丁茶改善高胆碱饮食小鼠肝脏损伤作用相关。Wang等[9]从自由基清除活性、氧自由基吸收能力、蛋白羰基吸收和蛋白氢过氧化物研究发现酚类化合物的存在与茶籽油的抗氧化能力密切相关,苦丁茶水提物中同样含有丰富的酚类成分,可能与苦丁茶对氧化应激水平的调控相关。此外苦丁茶水提物还含有三萜类和生物碱成分,一定程度上参与苦丁茶对高胆碱饮食小鼠健康问题的改善。
2.2 各组小鼠体重变化情况
喂养期间,各组小鼠摄食、饮水、粪便、生长发育情况与精神状态良好,反应灵敏,皮毛有光泽,未见行为改变或中毒表现,而体重呈现不同的变化趋势如图1所示。
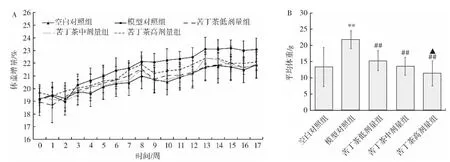
图1 各组小鼠体重变化情况(n=5)Fig.1 Changes of body weight of mice in each group(n=5)
图1A显示各组小鼠的体重均呈增长趋势,其中模型对照组小鼠体重增量最大,高达(21.84±2.77)%。图1B显示模型对照组小鼠体重增量极显著高于空白对照组,差异具有统计学意义(P<0.01);各剂量组小鼠体重增量极显著低于模型对照组,差异具有统计学意义(P<0.01),且各剂量组小鼠体重增量随剂量增加而减小,即呈负相关;高剂量组小鼠体重增量显著低于低剂量组(P<0.05),提示高胆碱饮食将引起体重异常增长,苦丁茶水提物可减缓由于高胆碱饮食引起的体重增长。
2.3 各组小鼠脏器指数情况
各组小鼠脏器指数计算结果见表3。
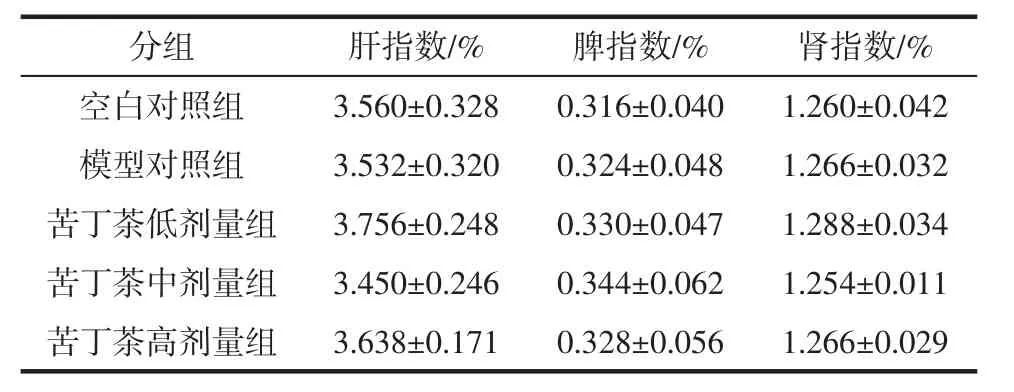
表3 各剂量组小鼠脏器系数(n=5)Table 3 Organ coefficient of mice in each dose group(n=5)
如表3所示,各组小鼠间的肝指数、脾指数和肾指数均无统计学差异,提示本研究中高胆碱饮食和苦丁茶水提物对肝、脾、肾无明显影响。
2.4 肝、肾组织切片病理学检查
当肝脏出现损伤时,可在染色切片中观察到肝细胞明显水肿坏死、变性,细胞核碎裂溶解,胆管及纤维组织增生及炎症细胞浸润等现象;当肾组织损伤时,可在染色切片中观察到明显的肾小管上皮细胞肿胀,肾小管扩张及粒细胞、淋巴细胞浸润等现象[13]。各组小鼠的肝、肾组织切片检查结果如图2所示。

图2 肝、肾组织切片病理学检查结果(×200)Fig.2 Results of pathological examination of liver and kidney tissue sections(×200)
小鼠的肝组织切片HE染色结果显示:各组均有部分肝细胞细胞质内出现微小空泡,但细胞核完整,细胞轮廓较清晰;模型对照组肝细胞部分变性,胞体肿胀,胞质疏松淡染。小鼠的肾组织切片HE染色结果显示:空白对照组、苦丁茶低剂量组、苦丁茶中剂量组的肾小球毛细血管较清晰,肾小管排列紧密,上皮细胞形态正常;模型对照组和苦丁茶高剂量组小鼠肾组织局部可见肾小管上皮细胞肿胀,胞质疏松淡染。该结果提示,高胆碱饮食且没有任何干预措施下,小鼠的肝、肾组织可能会受到轻微的影响,而高胆碱饮食并给予高剂量苦丁茶干预也有可能对小鼠的肾组织产生一定影响,但暂时并未发现苦丁茶会对小鼠产生明显的肝、肾组织损伤。
2.5 肝、肾功能检测结果
肝脏是机体内重要的代谢器官,当其受到损伤或产生病变时,代谢功能也将受到干扰,引起血液中某些化学成分水平变化,因此可以通过检测血液中这些指标的变化来反映肝脏功能[14]。肝脏是血浆ALB的主要合成场所,ALB和TP水平的降低可能表明肝脏合成蛋白质功能障碍;肝脏中含有丰富的酶类,如负责氨基酸合成与代谢分解的ALT和AST,当肝细胞损伤或细胞膜通透性增高时,这些酶会渗入血液,使血液中ALT和AST水平增加;血清中的ALP和GGT主要来源于肝脏,两者的血清水平变化一般保持平行,其水平升高是临床上肝胆类疾病的标志[15-16]。血清中的小分子代谢产物BU和Scr通过肾小球的滤过作用被排泄到尿中,当肾脏发生病变并影响肾小球功能时,BU和Scr在血清中滞留且含量增高,因而可作为评价肾脏功能的指标[17]。各组小鼠肝、肾功能的检测结果见表4。

表4 不同剂量的苦丁茶水提物对小鼠肝、肾功能的影响(n=5)Table 4 Effects of different doses of aqueous extract of Kuding Cha water extract on liver and kidney function in mice(n=5)mmol/L
与模型对照组相比,高剂量组的血清TP水平较高,差异具有统计学意义(P<0.05);与空白对照组相比,模型对照组的ALP水平较高,高剂量组的Scr水平较低,差异具有统计学意义(P<0.05);其余指标差异均无统计学意义。但与模型对照组相比苦丁茶水提物干预后各组小鼠血清TP水平均出现不同程度的上升趋势,BU水平均出现不同程度的下降趋势。Scr本身是一种代谢废物,正常情况下在血液中的水平较低,有研究表明Scr偏低可能和生成量减少有关,而在临床上这种现象最常见于营养不良、极度瘦弱以及骨骼肌含量低等症状[18],且高剂量苦丁茶水提物干预后,小鼠体重的增长量下降最多,为(11.39±3.86)%,提示高剂量的苦丁茶灌胃可能会对小鼠体重的正常增长产生影响,甚至导致其营养不良。
2.6 小鼠肝脏氧化应激指标结果
氧化应激是指生物体内ROS过多的生成,降低机体抗氧化物质如SOD、谷胱甘肽过氧化物酶、过氧化氢酶的活性,最终和机体抗氧化系统失衡而产生的一种应激状态[19]。MDA是脂质过氧化反应产生的一种短链醛,也是机体评价机体氧化应激程度的标志物之一,SOD则是机体抗氧化系统的重要组成,其活力水平可反映机体清除自由基的能力[20]。各组小鼠肝脏氧化应激相关指标结果如表5所示。

表5 苦丁茶水提物对小鼠氧化应激相关指标的影响(n=5)Table 5 Effects of aqueous extract of Kuding Cha on oxidative stress in mice(n=5)
与空白对照组相比,模型对照组的MDA含量较高,差异具有统计学意义(P<0.05),许多研究表明,高胆碱饮食可引起小鼠机体产生氧化应激损伤,Ren等[21]发现给予昆明小鼠3%胆碱含量的饮用水可以导致氧化反应标志物MDA水平的升高以及抗氧化物质SOD和谷胱甘肽过氧化物酶活力的降低,本实验与Li等[22]的研究结果一致。与模型对照组相比,各剂量组的MDA含量均下降,差异具有统计学意义(P<0.01),其中,苦丁茶中剂量组的MDA含量最低,为(0.285±0.032)nmol/mg;与模型对照组相比,各剂量组的SOD活力均上升,其中,苦丁茶中剂量组的SOD活力显著升高,差异具有统计学意义(P<0.05),该结果说明,中剂量苦丁茶水提物对小鼠体内氧化应激反应的调控效果较好。
3 结论
高胆碱饮食会引起实验小鼠体重异常增长,可能对其肝、肾组织造成一定影响,并增加小鼠肝组织中的MDA含量、降低SOD活性;苦丁茶水提物可降低小鼠体重增长幅度,其中,苦丁茶高剂量组的体重增长量最低且伴有Scr下降及血清TP上升,提示高剂量苦丁茶水提物可能会引起小鼠营养不良,但各组肝、肾组织切片观察尚未出现明显病理学损伤,尚不能说明对肝肾组织造成损伤;苦丁茶水提物均能降低小鼠MDA水平,中剂量苦丁茶水提物干预还可增强小鼠SOD活力,该结果表明高胆碱饮食小鼠体内氧化应激水平增加,抗氧化能力减弱,苦丁茶水提物的干预可以降低小鼠体内的氧化损伤并增强抗氧化酶的活力,从而减轻氧化应激程度,改善高胆碱饮食的健康问题。
