真姬菇菌丝体发酵藜麦产物中多糖的抗氧化和α-淀粉酶抑制活性
2022-02-15李奕葶王文振赵嘉伟孙宁黄亮杨红澎王玉班立桐
李奕葶,王文振,赵嘉伟,孙宁,黄亮,杨红澎,王玉,班立桐
(天津农学院 农学与资源环境学院,天津 300384)
真姬菇又名斑玉蕈,含有丰富的蛋白质、维生素、膳食纤维等营养物质及多糖、多酚、黄酮等天然活性产物,而且具有抗氧化、抗疲劳、调节血糖等诸多生理活性,是一种药食兼用的食用菌[1]。食用菌多糖具有抗氧化、抗衰老、调节血脂、血糖、抑制炎症、抑制肿瘤、抗辐射、增强免疫系统功能等活性[2-3]。食用菌多糖的生理活性与其分子量大小、空间构型及理化性质等相关,若其分子立体机构改变,活性将会丧失[4]。通过大量研究发现,具有三螺旋构型的真菌多糖具有最佳的生理活性[5],而且分子质量小于10 kDa或大于200 kDa的真菌多糖一般没有活性[6]。
藜麦是一种起源于南美洲的全能型谷物,各营养物质占干重的比例:蛋白质16%~22%、脂类1.8%~9.5%、总酚0.7%~0.9%、皂苷0.7%~3.1%,物质含量随种类不同而变化[7]。目前,藜麦被开发成多种产品,藜麦啤酒、藜麦酸奶、藜麦功能性饮料等[8-10]。固体发酵是一种传统的利用固体基质发酵的方式,可以使微生物维持原来的自然生长状态,有利于发酵的各种代谢产物积累[11]。藜麦富含微生物可利用的各种营养成分,可以作为食用菌生长的固体培养基。有研究表明,用香菇菌丝体发酵藜麦后,发酵产物中多糖含量与未发酵时相比增加了31倍[12]。
由于真姬菇引入我国的时间较晚,目前大部分研究均集中在子实体栽培与营养分析方向,缺乏菌丝体发酵等相关研究。因此,本研究利用真姬菇菌丝体发酵藜麦,通过单因素试验,探讨不同条件对多糖提取量的影响,筛选较优方法提取发酵物多糖。对粗多糖进行分离纯化,评价纯化前后多糖的抗氧化和α-淀粉酶抑制活性。本研究为真姬菇菌丝体的应用提供了新的思路,为真姬菇与藜麦固体发酵产物作为功能性食品应用的可行性奠定了一定的理论与数据基础,也为发酵产物中生理活性物质的利用提供了研究方向。
1 材料与方法
1.1 试验菌种与原料
真姬菇菌种HB-1:保藏于天津农学院食用菌研发中心;白色藜麦:市售。
1.2 试剂
氯仿(分析纯):天津市风船化学试剂科技有限公司;正丁醇(分析纯):天津市光复科技发展有限公司;纤维素酶(50 U/mg固体):上海麦克林生化科技有限公司;2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐 [2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS]:北京索莱宝科技有限公司;1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH):东京化成工业株式会社;阿卡波糖片(每片含阿卡波糖50 mg):拜耳医药保健有限公司;枯草芽孢杆菌α-淀粉酶(≥4 000 U/g固体)、猪胰腺α-淀粉酶(≥10 U/mg固体):上海鼓臣生物技术有限公司。
1.3 仪器设备
电热恒温培养箱(DNP-9272BS-III):上海新苗医疗器械制造有限公司;微波炉(G80F20CN2L-B8):广东格兰仕集团有限公司;超声波细胞粉碎机(JY88-II):宁波新芝生物科技股份有限公司;旋转蒸发器(RE-2000A):上海亚荣生化仪器厂;冷冻干燥机(Alpha1-2LDplus):德国克莱斯特;台式高速离心机(Centrifuge5430):德国艾本德股份公司;酶标仪(Enspire):美国珀金埃尔默仪器有限公司。
1.4 试验方法
1.4.1 真姬菇发酵藜麦
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:200 g马铃薯、20 g葡萄糖、20 g琼脂粉、蒸馏水1 000 mL。
扩大培养:将真姬菇菌种转接到斜面PDA培养基中,25℃培养10 d。待菌丝长满斜面后,继续转接到平板PDA培养基中,25℃培养10 d。
种子液培养:在平板培养基中,选取5块0.5 cm2大小的菌块,转接至锥形瓶液体培养基中(同PDA固体培养基,无琼脂),25℃160 r/min条件下恒温振荡培养7 d。
固体发酵:藜麦挑拣后磨粉,过200目筛,称取藜麦干粉25 g,倒入250 mL三角瓶中,配制成含水量约为80%的固体培养基,加入糊精(2.5 g/100 g干重)、酵母粉(0.5 g/100 g干重)、真姬菇菌丝体接种量为10 mL/100 g干重,25℃静置培养20 d,得发酵产物。
发酵后处理:将发酵产物取出并于50℃烘干,磨粉后过200目筛,收集粉末放置于干燥箱中保存。
1.4.2 多糖含量测定
采用苯酚-硫酸法[13]测定真姬菇与藜麦发酵产物中多糖的含量。取1 mL多糖样品,0.5 mL 5%苯酚以及2.5 mL浓H2SO4,充分混匀、煮沸,20 min后将其取出,冷却后于490 nm处测定吸光值。代入葡萄糖标准曲线方程,y=0.011 1x+0.006 3,决定系数r2=0.997,计算多糖浓度进一步换算出含量。
1.4.3 多糖提取单因素试验
1.4.3.1 微波辅助提取法
精确称取1 g发酵物粉末,加入20 mL蒸馏水,使用微波炉辅助提取,具体方法:1)分别采用微波功率70、210、350、490、700 W 对样品进行处理,微波时间为100 s,微波后沸水浴2 h,测定多糖含量,筛选较优微波功率;2)在较优微波功率条件下,微波时间选取30、60、90、120、150、180 s,微波后沸水浴 2 h,测定多糖含量,并确定较优微波时间。
1.4.3.2 超声波辅助提取法
精确称取1 g发酵物粉末,加入20 mL蒸馏水,使用超声波细胞破碎仪辅助提取,具体方法:1)分别采用超声波功率 50、100、150、200、250 W 对样品进行处理,超声时间20 min,超声后沸水浴2 h,测定多糖含量,筛选较优超声功率;2)在较优超声功率条件下,超声时间选取 5、10、15、20、25 min,超声后沸水浴 2 h,测定多糖含量,并确定较优超声时间。
1.4.3.3 酶解辅助提取法
精确称取1 g发酵物粉末,加入20 mL蒸馏水,使用纤维素酶辅助提取,具体方法:1)提取液中分别加入 0.2、0.4、0.6、0.8、1.0 g/100 mL 纤维素酶进行处理,作用时间为1 h,然后沸水浴2 h,测定多糖含量,筛选较优酶添加量;2)在较优酶添加量条件下,酶解时间选取 0.5、1.0、1.5、2.0、2.5、3.0 h,酶解结束后沸水浴 2 h,测定多糖含量,筛选较优酶解时间。
1.4.4 发酵产物粗多糖的制备与分离纯化
在单因素较优提取条件下,提取发酵物的多糖成分。将提取液离心并收集上清液,旋蒸后用4倍体积乙醇沉淀,放入4℃冰箱静置12 h,再次离心,收集沉淀,待溶剂全部挥发后,以适当比例溶于蒸馏水,利用Sevage试剂(氯仿、正丁醇体积比为5∶1)去除提取物中的蛋白质成分,重复3次~5次[14]。用大孔树脂AB-8去除色素[15],浓缩与冷冻干燥后称重,并采用下式计算多糖保留率。

使用DEAE-52纤维素离子交换柱纯化提取的粗多糖,柱填料经过碱-酸-碱的前处理后,利用湿法装柱(2.6 cm×50 cm),并避免气泡产生[16]。利用蒸馏水、0.1、0.5、1.0 mol/L NaCl溶液依次对层析柱洗脱。流速为1.0 mL/min,每管收集2 mL。利用苯酚硫酸法测定多糖含量。收集并标记好含有不同组分的多糖样品,冷冻干燥后称重,采用下式计算多糖得率。

1.4.5 抗氧化试验
1.4.5.1 DPPH自由基清除能力
将纯化前后的多糖以及阳性对照VC,配制成10.00、5.00、2.50、1.25、0.63、0.31、0.16 mg/mL 的不同浓度梯度的溶液。取125 μL多糖样品溶液,加入500 μL DPPH乙醇溶液(25 μg/mL),混合均匀后,置于黑暗处反应30 min,并在517 nm波长下测得吸光度值为A1,用蒸馏水代替多糖样品反应后的吸光值为A0,蒸馏水替DPPH乙醇溶液反应后的吸光值为A2[17],采用下式计算DPPH自由基清除率。

1.4.5.2 ABTS+自由基清除能力
样品及阳性对照溶液配制方法同1.4.5.1。取50 μL多糖样品,加入450 μL ABTS溶液,混合均匀后反应10min,在734nm处测吸光值,记为A1,取蒸馏水0.9mL加入0.1 mL待测样品,测734 nm处吸光值,记为A2,取ABTS溶液0.9 mL加入0.1 mL蒸馏水,测734 nm处吸光值,记为A0[18],采用下式计算ABTS+自由基清除率。

1.4.5.3 羟基自由基(·OH)清除活性
样品及阳性对照溶液配制方法同1.4.5.1。取9 mmol/L FeSO4与9 mmol/L水杨酸-乙醇溶液各1 mL,摇匀后加入1 mL多糖溶液、1 mL 8.8 mmol/L H2O2溶液,37℃水浴反应1 h后,冷却至20℃左右,在510 nm下测吸光值记为A1,用蒸馏水代替多糖样品后的吸光值记为A0,蒸馏水替代水杨酸溶液反应后的吸光值记为A2[19],采用下式计算羟基自由基清除率。

1.4.6 α-淀粉酶活性抑制试验
采用碘-淀粉比色法分别测定阳性对照阿卡波糖、纯化与未纯化多糖对猪胰腺、枯草芽孢杆菌来源α-淀粉酶的抑制活性[20]。试验在0.1 mol/L pH值为7.0的磷酸钾缓冲液酶活力测定体系中进行。多糖溶液配制方法同1.4.5.1。在试管中加入0.05 mL不同浓度的多糖待测样品以及1 mL 0.3 g/L的淀粉溶液,于37℃温育5 min后加入0.05 mL 0.01 mg/mL α-淀粉酶。45℃反应3 min后,加入1 mL 0.01 mol/L碘液进行检测,在660 nm处测定吸光值为A1,淀粉溶液与碘液反应后的吸光值记为A0,采用下式计算α-淀粉酶活性抑制率。

2 结果与分析
2.1 多糖提取单因素试验
2.1.1 微波辅助提取法对多糖提取量的影响微波辅助对多糖提取量的影响见图1。
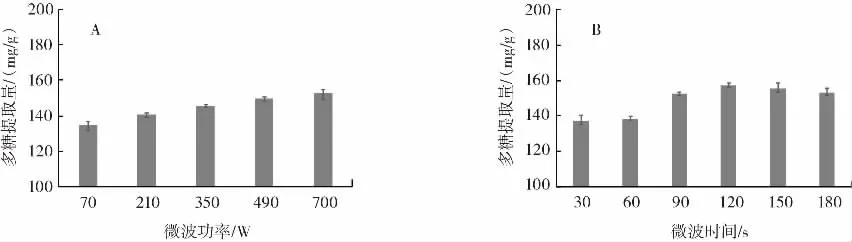
图1 微波辅助对多糖提取量的影响Fig.1 Effect of microwave-assisted on polysaccharide extraction
如图1A所示,多糖提取量随微波功率的增高而增长,在700 W微波辅助条件下,多糖提取量达到峰值,为(152.24±2.52)mg/g。如图 1B 所示,随着时间的推移,多糖的提取量先增大后减小,可能是由于微波时间过长导致多糖降解。在时间为120 s时,多糖提取量最高,为(157.13±1.13)mg/g。微波辅助法提取多糖较优功率为700 W,较优微波时间为120 s。
2.1.2 超声辅助提取法对多糖提取量的影响
超声波辅助对多糖提取量的影响见图2。
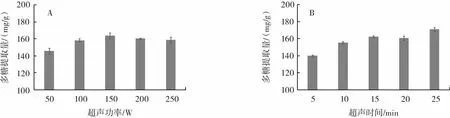
图2 超声波辅助对多糖提取量的影响Fig.2 Effect of ultrasonic assisted on polysaccharide extraction
如图2A所示,随着超声功率的提高,多糖的提取量先增高后降低,超声功率过高可能会引起多糖糖苷键断裂,降解为小分子片段,从而降低提取率。在功率为150 W 时,提取量达峰值,为(163.52±3.29)mg/g。如图2B所示,多糖的提取量随超声时间的增长而增多,在15 min~20 min时多糖含量有所下降,可能是由于超声导致多糖降解率大于多糖溶出率。超声时间为25 min 时,多糖提取量达峰值,为(170.73±2.28)mg/g。较优超声功率为150 W,较优超声时间为25 min。
2.1.3 纤维素酶辅助提取法对多糖提取量的影响
纤维素酶辅助提取法对多糖提取量的影响见图3。
如图3A所示,在酶添加量0.2%~0.4%时,多糖提取量略有下降;当添加量增加到0.4%~0.8%时,提取量随着酶添加量增长而增高,在1.0%时降低,可能是由于过量的酶会抑制酶解的正常进行。当酶添加量为0.8%时,多糖提取量达到最高,为(196.77±2.93)mg/g。如图3B所示,多糖提取量随时间的增长先增高后降低,可能是由于随着酶解时间的延长,降解产物对纤维素酶产生抑制作用导致的。在2.0 h时,多糖提取量达峰值,为(207.67±2.52)mg/g。纤维素酶较优添加量为0.8%,较优酶解时间为2.0 h。将3种辅助提取方法的提取结果进行比较,选取纤维素酶辅助法提取发酵产物多糖。

图3 纤维素酶辅助对多糖提取量的影响Fig.3 Effect of cellulase on polysaccharide extraction
2.2 真姬菇发酵藜麦产物粗多糖的分离纯化
提取的粗多糖用Sevage法除蛋白、AB-8大孔树脂脱色后,多糖保留率仅为30.82%。将多糖进一步用DEAE-52纤维素离子交换柱纯化,依次用蒸馏水、0.1、0.5、1.0 mol/L NaCl作为洗脱液,分离发酵产物的粗多糖成分。结果如图4所示。
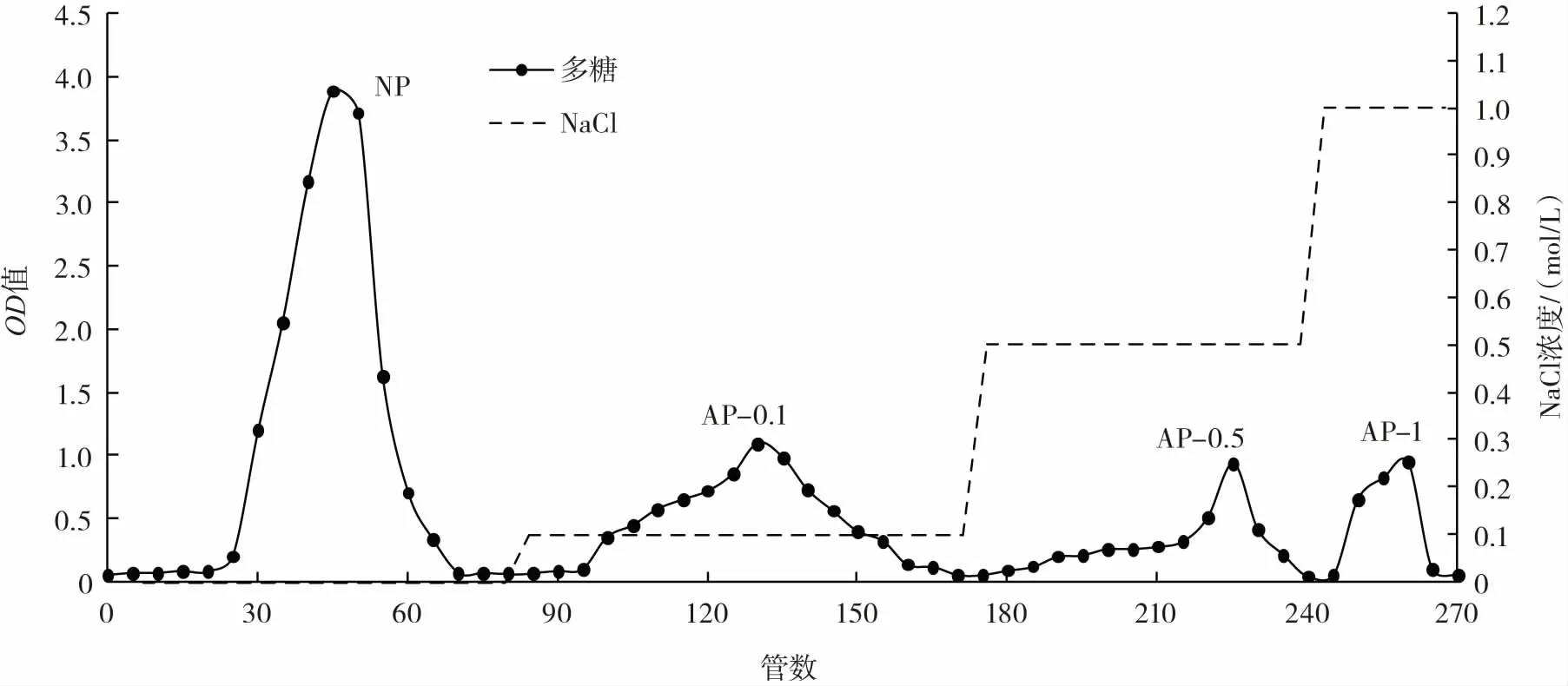
图4 DEAE-52纤维素离子交换层析纯化后多糖组分Fig.4 Polysaccharide components purified by DEAE-52 cellulose ion exchange chromatography
用蒸馏水洗脱时,在20管~75管出现峰值,收集洗脱液,为中性多糖(neutral polysaccharide,NP)组分。用0.1mol/LNaCl溶液洗脱,在95管~160管之间出现峰值,收集洗脱液,为酸性多糖-0.1(acid polysaccharide-0.1,AP-0.1)组分。用0.5mol/LNaCl溶液洗脱,在 185管~240管之间出现峰值,收集洗脱液,为酸性多糖-0.5(acid polysaccharide-0.5,AP-0.5)组分。用1.0 mol/L NaCl溶液洗脱,在245管~265管出现峰值,收集洗脱液,为酸性多糖-1(acid polysaccharide-1,AP-1)组分。将 4 个组分洗脱液分别进行旋蒸浓缩、冷冻干燥。称量后,贴好标签,放在干燥箱里保存。4个组分多糖得率:NP为30.67%,AP-0.1为10%,AP-0.5为22.67%,AP-1为36.67%。
2.3 抗氧化试验
2.3.1 DPPH自由基清除试验
多糖对DPPH自由基清除率见图5。
如图5所示,VC具有显著的DPPH自由基清除能力,当VC浓度在0.16 mg/mL时,清除率就已达到81.48%。而 NP、AP-0.1、AP-0.5、AP-1以及未纯化的多糖(unpurified polysaccharide,UP),在测试浓度范围内对DPPH自由基的清除率均没有超过30%。在多糖浓度为10 mg/mL时,UP对DPPH自由基清除率最高,达到了28.95%,可能是由于未纯化多糖含有其他抗氧化成分对DPPH自由基具有清除作用,NP的DPPH自由基清除率为18.94%,AP-0.1为28.29%,AP-0.5为19.42%,AP-1为21.11%。总体来看,这5种多糖对DPPH自由基均具有较弱的清除作用。

图5 多糖对DPPH自由基清除率Fig.5 Scavenging rate of DPPH free radical by polysaccharide
2.3.2 羟基自由基(·OH)清除试验
多糖对·OH的清除率见图6。

图6 多糖对·OH清除率Fig.6 Scavenging rate of·OH by polysaccharide
如图6所示,VC对·OH的清除效果非常显著。5种组分多糖在浓度为0.16 mg/mL~1.25 mg/mL时,对·OH的清除率随浓度增加逐渐增强,但增长缓慢;当浓度在2.5 mg/mL~10 mg/mL时,清除率迅速提升;当浓度达到 10 mg/mL 时,UP、NP、AP-0.1、AP-0.5、AP-1对·OH的清除率均达到最大值,分别为43.36%、37.89%、39.69%、37.92%以及30.91%。总体来看,5种多糖对·OH起到了一定的清除作用,UP组分表现最为显著,表明未纯化多糖中可能含有对·OH具有清除作用的其他活性成分。
2.3.3 ABTS+自由基清除试验
多糖对ABTS+自由基清除率见图7。

图7 多糖对ABTS+自由基清除率Fig.7 Scavenging rate of ABTS+free radical by polysaccharide
如图7所示,VC对ABTS+自由基具有较强的清除效果。NP、AP-0.1、AP-0.5、AP-1、UP 对 ABTS+自由基的清除率随着浓度的升高而增强。当多糖浓度均为10 mg/mL 时,UP、NP、AP-0.1、AP-0.5、AP-1 对 ABTS+自由基的清除率分别是41.12%、51.22%、48.79%、35.34%以及47.18%。这5种组分多糖对ABTS+自由基均具有一定的清除效果,其中NP清除效果最佳,UP与AP-0.5的清除效果相对较差。说明,多糖的抗氧化活性与其理化性质等因素相关,发酵产物的中性多糖组分具有较好的ABTS+自由基清除能力。
2.4 α-淀粉酶抑制活性
2.4.1 多糖对枯草芽孢杆菌来源α-淀粉酶抑制活性
多糖对枯草芽孢杆菌来源α-淀粉酶抑制率见图8。
如图8所示,阳性对照阿卡波糖对α-淀粉酶的抑制作用显著,并且具有浓度依赖性,而5组多糖组分的抑制效果均低于阳性对照。NP、AP-0.1、AP-0.5、AP-1、UP对枯草芽孢杆菌来源α-淀粉酶均有一定的抑制作用,但是没有明显的波动。AP-0.1比其他组分多糖的抑制作用显著,抑制率最高,达到了60.22%;其次是AP-0.5,最高抑制率为49.37%,而UP的抑制效果较差,最高抑制率为仅25.32%。AP-0.1与AP-0.5为酸性多糖组分,其对枯草芽孢杆菌来源α-淀粉酶抑制活性可能不仅与多糖的分子量、分子大小、空间构型等相关,而且可能与酸性多糖特有的糖醛酸结构密切相关。
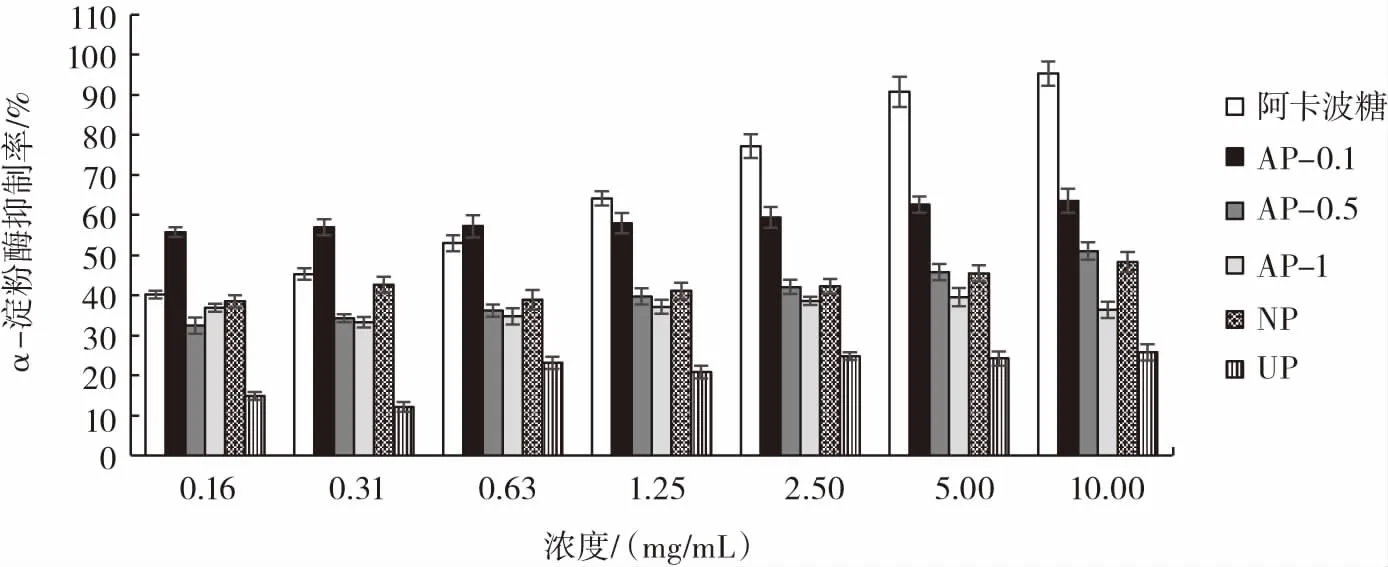
图8 多糖对枯草芽孢杆菌来源α-淀粉酶抑制率Fig.8 Inhibition rate of polysaccharide on Bacillus subtilis α-Amylase
2.4.2 多糖对猪胰腺来源α-淀粉酶抑制活性
多糖对猪胰腺来源α-淀粉酶抑制率见图9。
如图9所示,阳性对照阿卡波糖对猪胰腺来源α-淀粉酶的抑制作用显著,并且具有浓度依赖性,而5组多糖组分的抑制效果均低于阳性对照。当多糖浓度为10 mg/mL时,5组多糖中AP-0.5对猪胰腺来源α-淀粉酶的抑制效果最佳,且抑制率达到了50.36%,其次是AP-0.1,最高抑制率为48.96%,其余组分抑制效果均较弱。AP-0.1与AP-0.5为酸性多糖组分,其对猪胰腺来源α-淀粉酶的抑制机制可能与对枯草芽孢杆菌来源α-淀粉酶抑制机制类似,与酸性多糖的糖醛酸结构等理化因素相关。

图9 多糖对猪胰腺来源α-淀粉酶抑制率Fig.9 Inhibition rate of polysaccharide on porcine pancreas α-amylase
3 讨论与结论
对比文献[12]研究结果,在多糖浓度为10 mg/mL时,香菇菌丝体发酵藜麦产物中粗多糖对DPPH自由基清除率,为真姬菇菌丝体发酵藜麦产物各组分多糖的2倍左右,而两种食用菌发酵藜麦产物中多糖对ABTS+自由基清除率却基本相似。聂莹等[21]研究结果显示,真姬菇子实体多糖浓度为10 mg/mL时,对DPPH自由基清除率为28%,对·OH清除率为92%,而对ABTS+自由基清除率只有12%。真姬菇菌丝体发酵藜麦产物中多糖与真姬菇子实体多糖相比,·OH清除率较低,DPPH自由基清除率相近,而ABTS+自由基清除率则较高。与其他食用菌多糖活性相比较,杏鲍菇菇头多糖浓度在5 mg/mL时对ABTS+自由基清除率为70.9%[22],而此时真姬菇菌丝体发酵藜麦产物中多糖只有40%左右,清除能力远低于杏鲍菇菇头多糖。姬松茸胞外多糖具有非常显著的α-淀粉酶抑制活性,浓度为1 mg/mL时,其抑制效果高达90%左右,明显高于真姬菇菌丝体发酵藜麦产物中多糖[23]。
综上所述,多糖提取较优条件:纤维素酶添加量为 0.8%,酶解时间为 2.0 h。对比 NP、AP-0.1、AP-0.5、AP-1、UP这 5种多糖的抗氧化试验,UP对DPPH·、·OH清除效果较为显著,清除率最高达28.95%与43.36%;NP对ABTS+自由基清除效果最佳,最高清除率为51.22%。AP-0.1和AP-0.5分别对枯草芽孢杆菌、猪胰腺来源的α-淀粉酶抑制效果最佳。本研究为真姬菇在固体发酵方向的应用提供了新的思路,为发酵产物中活性物质作为功能性食品添加剂提供了理论依据与数据基础,也为其他食药用真菌在固体发酵方向上的应用做了铺垫。
