抗肿瘤血清胸腺因子9肽的急性毒性和遗传毒性
2022-02-15黄雅理
杨 玉,黄雅理,林 飞,汤 龙,*
(1.佳木斯大学基础医学院,黑龙江 佳木斯154007;2.中国食品药品检定研究院,北京100050;3.海关总署国际检验检疫标准与技术法规研究中心,北京 100013)
血清胸腺因子9肽(facteur thymique sérique,FTS)是胸腺T细胞所分泌的多种激素之一,相对分子质量为876.8,是由9个氨基酸残基组成的小分子肽[1],目前已可化学合成。作为一类新药进行临床前研究,发现其具有抗肿瘤、抗炎、抗氧化、提高免疫力等作用[2-5],尚未见其相关毒理学安全性试验报道。为此,参照国家食品药品监督管理总局相关药物研究技术指导原则[6-7],对血清胸腺因子9肽进行了急性毒性和遗传毒性检测。
1 材料与方法
1.1 受试药物及主要试剂
血清胸腺因子9肽为白色粉末,溶于水,纯度>95.0%,由深圳市某生物工程有限公司生产,生产批号080701,于-20℃密闭保存。试验前称取药粉,用0.9%氯化钠注射液(NS,北京双鹤药业有限公司)溶解并稀释。代谢活化剂,多氯联苯诱导的雄性SD大鼠肝微粒体酶(S9),购于北京安宝迪有限公司(批号08120411),-80℃冷冻密闭保存。
阿的平(atabrine,Ata)、正定霉素(daunomycin,DMC)、丝裂霉素C(mitomycin,MC)和环磷酰胺(cyclophosphamide,CP)均为国产药品,购于北京医院药房;2-乙酰氨基芴(2-acetamidofluorene,2-AF)、叠氮钠(sodium azide,NaN3)、4-硝基喹啉-N-氧化物(4-nitroquinoline N-oxide,4NQO)为化学试剂,购于北京化学试剂商店。以上均为阳性对照试剂。
1.2 实验动物
SPF级昆明种小鼠(体质量19~21 g)和Wistar大鼠(体质量120~140 g),雌、雄各半,由中国食品药品检定研究院实验动物资源研究所提供,实验动物生产许可证号SCXK(京)2014-0013,实验动物使用许可证号SYXK(京)2016-0004。6~8个月龄Beagle犬雌、雄各3只,由上海市新冈实验动物场提供,生产合格证号为SCXK(沪)2012-0014,质量合格证号为沪动合证字119号。动物均在实验动物室检疫观察后进行试验。
1.3 试验方法[6-7]
1.3.1 急性毒性试验 预试验按70.0 mg/kg静脉注射FTS溶液,6只小鼠均未见死亡。正式试验采用最大耐受量法,取禁食16 h的小鼠和大鼠(雌、雄各半),每组20只。配制3.5 mg/mL的FTS溶液,根据体质量差异,按0.02 mL/g一次性皮下注射或尾静脉注射FTS溶液(总量为70.0 mg/kg),确定药物的最大耐受量。犬采用近似致死剂量法(50%递增法),配制70.0 mg/mL的FTS溶液,根据体质量差异,按1.0 mL/kg一次性皮下注射给药,连续观察4 h,以后每日观察1次,共观察14 d,记录给药前、给药后7 d和14 d存活动物的体质量、体温。收集Beagle犬的尿液,尿液的检测指标包括pH、亚硝酸盐、葡萄糖、比重、隐血、蛋白质、尿胆红素、尿胆素原、酮体和白细胞数等10项;心电图检测包括R-R间期、P-R间期、Q-T间期、S-T段、T波和心率等6项指标;血液学检测包括白细胞数(WBC)、红细胞数(RBC)、血红蛋白浓度(HGB)、红细胞压积(HCT)、平均红细胞体积(MCV)、平均红细胞血红蛋白(MCH)、平均红细胞血红蛋白浓度(MCHC)、血小板数(PLT)、淋巴细胞(L)、单核细胞(M)和粒细胞(G)等11项指标;血清生化学检测包括谷丙转换酶(GOT)、谷草转换酶(GPT)、碱性磷酸酶(ALP)、葡萄糖(Glu)、总胆红素(TBIL)、总胆固醇(CHO)、甘油三酯(TG)、尿素氮(BUN)、肌酐(Cre)、总蛋白(TP)、白蛋白(Alb)等11项指标。根据犬出现的毒性反应确定药物的近似致死量。
1.3.2 Ames试验 选用组氨酸营养缺陷型鼠伤寒沙门菌TA97、TA98、TA100、TA102和TA1535。菌株经鉴定符合要求。根据预试验,5 000μg/皿浓度未见背景菌苔减少,存在浅白色透明状析出的受试药物小颗粒,不影响观察计数回变菌落数,故本次FTS溶液选用1、10、100、1 000、5 000μg/皿,同时设溶剂对照和阳性对照。各组在加和不加S9条件下进行试验,在37℃培养48 h,观察细菌背景菌苔生长正常后,计数回变菌落数。
1.3.3 CHL染色体畸变试验 中国仓鼠肺成纤维细胞(CHL)传代培养,预实验用结晶紫法确定FTS溶液对CHL细胞的半数抑制浓度(IC50)>5 600μg/mL。故以5 600μg/mL作为高剂量组,2 800和1 400μg/mL分别作为中、低剂量组,同时设溶剂对照和阳性对照组,加和不加S9同时进行。每个剂量设3个平行皿,分别培养24或48 h。常规方法收获细胞、制片、染色,每个剂量在显微镜下计数100个分裂中期细胞,分析染色体畸变类型。
1.3.4 微核试验 小鼠以70.0 mg/kg为高剂量组,35.0 mg/kg组和17.5 mg/kg为中、低剂量组,另设溶剂对照组和阳性对照组,每组10只。受试药物第1次皮下注射给药后24 h进行第2次皮下注射给药,溶剂对照组给予同体积的生理盐水,阳性对照组经腹腔注射环磷酰胺40.0 mg/kg。第2次给药后6 h处死小鼠,取股骨骨髓,涂片、甲醇固定、Giemsa染色。每只小鼠在油镜下计数1 000个嗜多染红细胞(polychromatic erythrocytes,PCE)中出现微核(micronucleus,MN)的细胞数,并计数200个PCE与正染红细胞(normochromatic erythrocyte,NCE)的比例。
1.4 统计学方法
试验动物的体质量、回变菌落数、微核率等指标的统计以±s表示。染色体畸变试验的畸变细胞率采用χ2检验;微核试验的数据采用SPSS 17.0软件,经泊松分布或双侧t检验,以α=0.05为检验水准。
2 结果
2.1 急性毒性试验
大鼠和小鼠1次给予70.0 mg/kg血清胸腺因子9肽后连续观察14 d均未发现异常反应或死亡,小鼠体质量平均增长12~17 g,大鼠体质量平均增长69~125 g。Beagle犬雌、雄各1只皮下1次给药,连续14 d观察,其精神好、行为正常、活动自如、吠叫响亮、未出现明显毒性反应和死亡,体质量增长0.1~0.6 kg。犬的体温在37.2~37.5℃范围,尿液10项指标、心电图6项指标、血液学11项指标和血清生化学11项指标,均在正常值范围内,其数值未显示升高或降低变化。见表1~3。
表1 血清胸腺因子9肽对小鼠、大鼠、犬体质量的影响(±s)
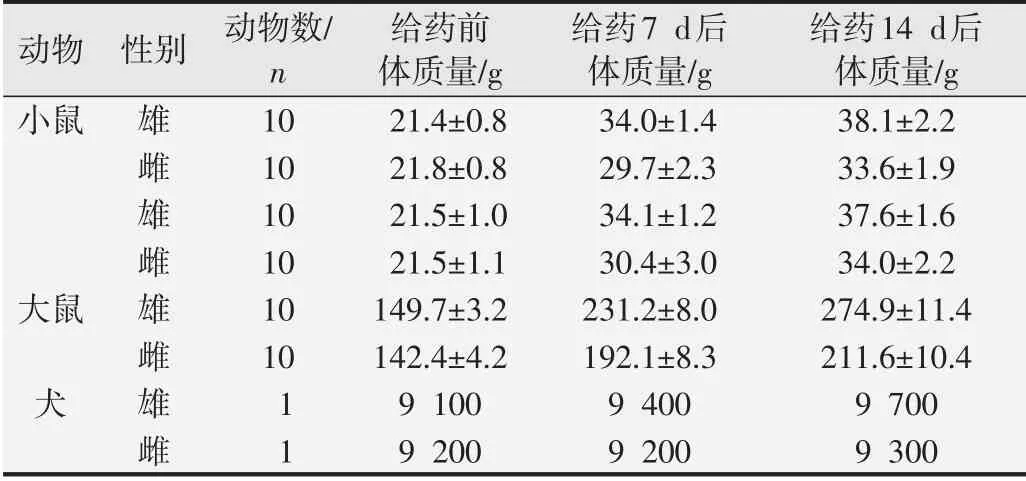
表1 血清胸腺因子9肽对小鼠、大鼠、犬体质量的影响(±s)
动物小鼠大鼠犬性别雄雌雄雌雄雌雄雌动物数/n 10 10 10 10 10 10 11给药前体质量/g 21.4±0.8 21.8±0.8 21.5±1.0 21.5±1.1 149.7±3.2 142.4±4.2 9 100 9 200给药7 d后体质量/g 34.0±1.4 29.7±2.3 34.1±1.2 30.4±3.0 231.2±8.0 192.1±8.3 9 400 9 200给药14 d后体质量/g 38.1±2.2 33.6±1.9 37.6±1.6 34.0±2.2 274.9±11.4 211.6±10.4 9 700 9 300

表2 血清胸腺因子9肽对犬血常规的影响
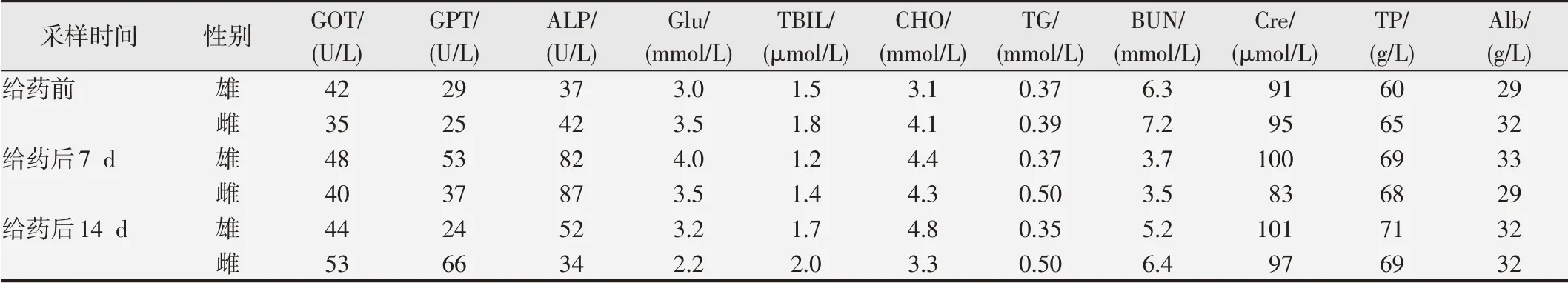
表3 血清胸腺因子9肽对犬血清生化指标的影响
2.2 Ames试验
溶剂对照组各菌株的回变菌落数均在正常范围内。阳性对照组各菌株的回变菌落数明显增多,与溶剂对照组比较,各菌株的平均回变菌落数增加值均超过2倍以上,说明检测系统可靠;血清胸腺因子9肽各浓度组各菌株的平均回变菌落数均与溶剂对照组相比,未见明显增加,差异均无统计学意义(P>0.05)。见表4。
表4 Ames试验回变菌落数观察(±s)

表4 Ames试验回变菌落数观察(±s)
*-S9:TA97菌株,Ata,1 000μg/皿;TA98菌株,DMC,10μg/皿;TA100菌株,NaN3,2.5μg/皿;TA102菌株,MC,4μg/皿;TA1535菌株,4NQO,0.5μg/皿.+S9:TA97、TA98、TA100菌株,2-AF,10μg/皿;TA102菌株,MC,4μg/皿;TA1535菌株,CP,50μg/皿.
组别溶剂对照FTS 1μg/皿10μg/皿100μg/皿1 000μg/皿5 000μg/皿阳性对照*TA97-S9 159±5 158±7 155±5 157±4 146±6 139±6 1 797±168+S9 162±5 160±8 160±5 164±6 149±7 146±4 1 242±161 TA98-S9 41±3 38±2 40±2 39±2 37±2 35±2 2 196±175+S9 41±3 40±2 41±2 40±3 39±2 37±2 1 525±89 TA100-S9 179±9 175±6 178±7 177±8 169±4 149±6 1 629±60+S9 184±5 186±3 184±6 184±5 180±5 169±5 1 660±83 TA102-S9 296±10 293±13 305±10 293±12 282±10 276±7 1 429±157+S9 304±5 305±10 305±7 301±10 293±11 265±6 956±60 TA1535-S9 16±3 13±3 15±2 13±2 14±2 15±2 745±63+S9 13±2 17±2 18±3 13±1 14±3 21±3 914±81
2.3 CHL染色体畸变试验
溶剂对照各组收获的细胞染色体畸变率均≤3%;阳性对照各组的染色体畸变率则显著增加,丝裂霉素C组-S9条件下在24和48 h时染色体畸变率分别72%和68%,环磷酰胺组+S9条件下在24 h时染色体畸变率为64%,畸变类型为染色单体断裂(ctb)、染色单体互换(cte)、染色体断裂(csb)、易位(t)、断片(f)、环(r)、双着丝粒(dic)、多倍体(pol)、粉碎化(pvz)等9种,与溶剂对照组比较,差异具有统计学意义(P<0.01);血清胸腺因子9肽(FTS)在1 400~5 600μg/mL剂量范围内染色体畸变率均≤3%,畸变类型为ctb、csb、f、dic、pol等5种,与溶剂对照组比较,差异均无统计学意义(P>0.05)。见表5。

表5 CHL染色体畸变试验结果(n=100)
2.4 小鼠骨髓微核试验
溶剂对照组的微核细胞率为1.2‰,而阳性对照组的微核细胞率为27.9‰,与溶剂对照组比较,差异显著(P<0.01)。血清胸腺因子9肽各剂量组的微核细胞率均<2.0‰,与溶剂对照组比较,差异均无统计学意义(P>0.05)。见表6。
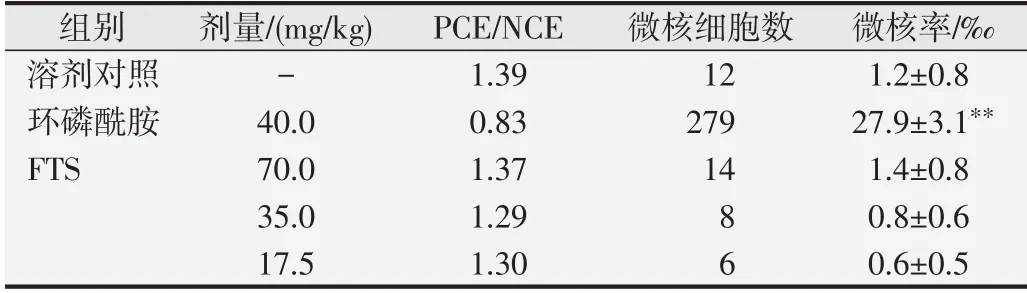
表6 小鼠骨髓微核试验结果(n=1×104)
3 讨论
一类创新药物的急性毒性和遗传毒性试验是新药临床前安全性评价的必检项目[8-9]。血清胸腺因子类化合物的抗肿瘤机制与一般化疗药物不同,它主要是通过获得性和先天免疫的细胞产生作用,影响IL-2受体和IFN-γ受体的表达,诱导白介素-2和干扰素的产生,刺激胸腺T淋巴细胞并激活吞噬细胞,使细胞更易被细胞因子刺激,达到抗肿瘤、增强免疫力的作用[10-14]。本文使用血清胸腺因子9肽,是人工化学合成品,制备成本较低,纯度较高,刺激免疫低下机体细胞因子产生抑瘤等药理学作用明显,作为新药应用于临床具有广阔的前景。
对血清胸腺因子9肽的急性毒性研究表明,昆明小鼠一次皮下注射和静脉注射给药,Wistar大鼠和Beagle犬一次皮下注射给药70.0 mg/kg,连续观察14 d,均未见明显毒性反应。临床人拟用量4.5 mg/d。成人按60 kg体质量计算,用药量0.075 mg/kg,本试验给药剂量相当于临床人拟用量的930倍。遗传毒性结果表明,Ames试验在5 000μg/皿浓度以下未见回复突变菌落数显著增加;CHL染色体畸变试验在5 600μg/mL浓度以下未出现细胞染色体畸变率的显著升高;小鼠骨髓微核试验在70.0 mg/kg剂量以下未诱发骨髓微核细胞率的显著增加。这些结果提示:血清胸腺因子9肽在本试验剂量范围内,动物的急性毒性较低,安全系数较大;未发现体外基因突变和体内、外染色体畸变;这与一般细胞毒类抗肿瘤药物的毒性实验结果有明显的不同[15-18]。目前该药正在进行注射局部的刺激性、致敏性、长期给药的全身毒性和生殖毒性等多项毒理学试验,期待能够尽快进入临床试验。
