基于网络药理学和分子对接法预测甘草干姜汤抗乳腺癌的主要活性成分及作用机制
2022-02-15辛雨濛梁桓熙余悦华孙震晓
辛雨濛,梁桓熙,余悦华,孙震晓*
(北京中医药大学生命科学学院,北京 102488)
据世界卫生组织国际癌症研究机构(International Agency for Research on Cancer,IARC)发布的2020年全球最新癌症数据显示,乳腺癌发病率高于肺癌,成为全球第一大癌症[1-2]。乳腺癌在中医常归为“乳癌”“石榴翻花发”“乳岩”“乳石”“乳毒”“奶岩”等。现代中医治疗乳腺癌的原则为补虚益肾,疏肝健脾,行气养血,其与肝经、脾经、肾经的关系最为密切[3]。
甘草干姜汤来自张仲景《伤寒杂病论》,也在《金匮要略》中有所记载[4]。甘草甘温而补中益气,干姜辛温而温复脾肺之阳,全方躁烈性不强、药性平和、具有补中复阳之功,因此可用于脾肺阳虚兼有阴亏的病证[5]。同时甘草或干姜提取物的相关抗肿瘤实验研究发现:甘草查尔酮B处理MCF-7细胞后可激活p53及其下游效应物p21,然后诱导S期停滞[6];甘草次酸可显著抑制乳腺癌MDA-MB-231细胞增殖和迁移,可能与抑制ERK1/2通路活化,下调MMP-9蛋白表达有关[7];6-姜酚引起的Notch信号下调(Hes1和CyclinD1基因)导致乳腺癌细胞凋亡[8];异甘草素通过抑制NF-κB信号通路的活化,抑制NF-κB p65入核诱导NCI-H460肺癌细胞凋亡[9]等。但有关甘草干姜汤药效成分的文献报道较少,仅杨颜芳等[10]研究了甘草干姜汤中8种关键的药效成分。
近年来,随着蛋白组学、基因组学、代谢组学等组学理论的快速发展以及系统生物学和生物信息学的应用,网络药理学出现在人们的视野里。它通过“疾病-基因-靶点-药物”的相互作用网络来系统地分析药物对疾病的干预和影响[11],进而解释中药多种成分在人体内的协同作用。网络药理学可以很好的从多成分、多靶点、多途径来解释中药中复杂成分的作用机制,对中医药的现代化发展提供了很大的帮助[12]。随着研究不断推进,越来越多的三维蛋白质结构得到确认,使具有潜在治疗功能的药物靶标逐渐增多。本文利用网络药理学筛选出甘草干姜汤抗乳腺癌可能的作用靶点,并利用文献报道的甘草干姜汤的8种药效成分(甘草苷、异甘草苷、甘草素、异甘草素、甘草酸、6-姜酚、6-姜烯酚、8-姜酚)与潜在的关键靶点进行分子对接,预测甘草干姜汤产生抗乳腺癌作用潜在的主要活性成分及相关作用靶点,为甘草干姜汤抗乳腺癌作用及机制研究提供数据支持。
1 材料与方法
1.1 甘草干姜汤化学成分收集及药物靶点预测
登录中药系统网络药理学数据库[13](Traditional Chinese Medicine Database and Analysis Platform,TCMSP,http://tcmsp-e.com),设置搜索条目为Herb name。为筛选甘草、干姜的有效化学成分,在搜索条目下分别输入复方的药物组成:甘草、干姜。设置筛选条件为OB(口服生物利用度)≥30%、DL(类药性指数)≥0.18,另外通过文献调研,将不符合类药筛选但在甘草、干姜中含量高或具有良好抗肿瘤活性的成分加入成分集。完整复制各中药符合筛选条件的所有成分于文本文档中。为筛选LDGD的目标靶点,在输入界面选择Related Targets,完整复制各中药符合筛选条件的所有目标靶点于文本文档中。数据库所获得的药物有效化学成分及靶点信息应用Drugbank(https://www.drugbank.ca)使其格式标准化。
1.2 疾病靶点的来源
登录Genecards人类基因数据库[14](https://www.genecards.org/)。设置搜索条目为关键词搜索。搜索条目下以breast cancer为关键词筛选,设置物种为人,获取乳腺癌的疾病靶点。为保证数据的准确性,选择Relevance score>30的疾病靶点。对数据库检索到的疾病靶点进行合并去重,作为最终的疾病靶点来源。
1.3 复方-疾病交集靶点的获取
在R语言Bioconductor(https://www.bioconductor.org)网站中安装VennDiagram程辑包,将1.1与1.2中获得的复方药物靶点与疾病靶点数据导入到R软件,应用Draw Venn Diagrams程序对获取到的甘草干姜汤药物靶点与疾病靶点进行匹配,获得交集基因靶点,并绘制Venn图。
1.4 成分-靶点网络图构建
将1.3中获取到的交集基因导入到网络可视化软件Cytoscape 3.8.0中,构建成分-靶点相互作用网络。对网络进行分析,以节度中心性作为评价节点在网络中重要性的标准。
1.5 PPI网络的构建及甘草干姜汤抗乳腺癌关键靶点的筛选
登录String数据库(https://string-db.org)。选择Multiple proteins,在搜索条目下输入1.3获取到的交集基因,限定物种为Homo Sapiens,其余设置保持不变,构建PPI功能蛋白作用网络,并绘制网络图。为筛选核心蛋白,将生成的蛋白相互作用条目Node1、Node2以及Combined-scorce导入到Cytoscape3.8.0,应用Network Analyse插件分析网络,选择APP条目下的CytoNCA插件进行网络分析。
1.6 GO功能和KEGG信号通路富集分析
使用R语言对甘草干姜汤抗乳腺癌的作用靶点进行GO功能富集分析。富集内容包括细胞成分(celluar component,CC),生 物 学 过 程(biological process,BP),分子功能(molecular function,MF)。富集条件为PCutoff=0.05且QCutoff=0.05(为P值校订值,以此为标准进行GO、KEGG分析),其余默认原始设置。在R语言中Bioconductor(https://www.bioconductor.org)网站安装所需要 的Biocmanager,org.Hs.eg.db,Colorspace,Stringi,ggplot2,DOSE,ClusterProfiler,enrichplot,Pathview等程序包。首先将基因Symbol转化为基因ID,选择物种为人,设定阈值为P<0.05,输出富集结果并绘制条形图与气泡图。
1.7 分子对接
将文献报道的甘草干姜汤中8种药效成分和PPI结果中排名靠前的靶点进行分子对接,验证LDGD中的药效成分是否能与相关靶点结合。
从PDB(http://www.rcsb.org)数据库中得到以上靶点的晶体结构,对蛋白结构进行预处理,后续的对接将使用预处理之后的蛋白结构。
本研究中,将与蛋白晶体复合的原配体所在位点初步定义为活性口袋。为了验证活性口袋的可靠性,先将原配体取出,使用Discovery Studio 2.5中的Libdock功能来将原配体和蛋白进行对接,后选取打分值最高的构象来和原配体本来的构象进行比对,采用计算均方根偏差(root-mean-square deviation,RMSD)的方法,将其结果作为活性口袋是否符合标准的参数。当RMSD≤2.0Å时,我们认为用来进行对接的活性口袋能够良好的重现原配体的作用模式,并记录原配体与蛋白晶体相互作用的关键氨基酸以及打分值,并将原配体打分值的80%设置为阈值[15]。当RMSD>2.0Å时,调整活性口袋的坐标,直到RMSD≤2.0Å。在确定活性口袋的坐标后,将事先准备好的中药小分子与上述靶标进行对接,并按照原配体打分值的80%和与原配体相互作用的关键氨基酸进行筛选。
2 结果
2.1 甘草干姜汤的化学成分及靶点
通过TCMSP数据库共收集甘草干姜汤中101个在TCMSP中符合类药筛选或在甘草、干姜中有报道的成分,将收集的成分对应的靶点进行合并去重处理后,共得到LDGD成分相关靶点220个。
2.2 药物靶点和疾病靶点的Venn图绘制
LDGD成分相关靶点有220个;利用Genecards数据库收集到499个疾病靶点,两者取交集共得到88个交集靶点,结果如图1所示,后续会利用交集靶点进行分析。

图1 LDGD化学成分和乳腺癌关键靶点Venn图
2.3 构建成分-靶点网络图
运用Cytoscape 3.8.0中的Import Network插件构建甘草干姜汤化学成分-靶点作用网络,如图2所示。
2.4 PPI网络的构建及LDGD抗乳腺癌关键靶点筛选
将从2.2中获得的88个交集基因导入String数据库,把得到的string_interactions.txt文件导入到Cytoscape 3.8.0,使用Network Analyse插件构建PPI网络,选择CytoNCA插件进行网络拓扑分析,筛选网络中的关键节点,节点代表靶蛋白,边代表靶蛋白与靶蛋白之间的作用关系,见图3。LDGD抗乳腺癌核心靶点筛选指标:介度中心性(betweenness centrality),紧密中心性(closeness centrality),节度中心性(degree centrality),特征向量(eigenvector centrality),局部连通性(local average connectivity-based method)。筛选条件:应用R软件的在线程辑包,对各交集基因的上述筛选指标数值进行测算,各组数值中大于本组中位值的基因予以保留,运行R脚本,筛选核心靶点,将筛选结果按照Degree数值进行排序,筛选出的20个LDGD抗乳腺癌核心靶点结果如表1所示。

图2 LDGD化学成分和癌症靶点的作用网络

图3 LDGD抗乳腺癌作用潜在靶点的PPI网络图
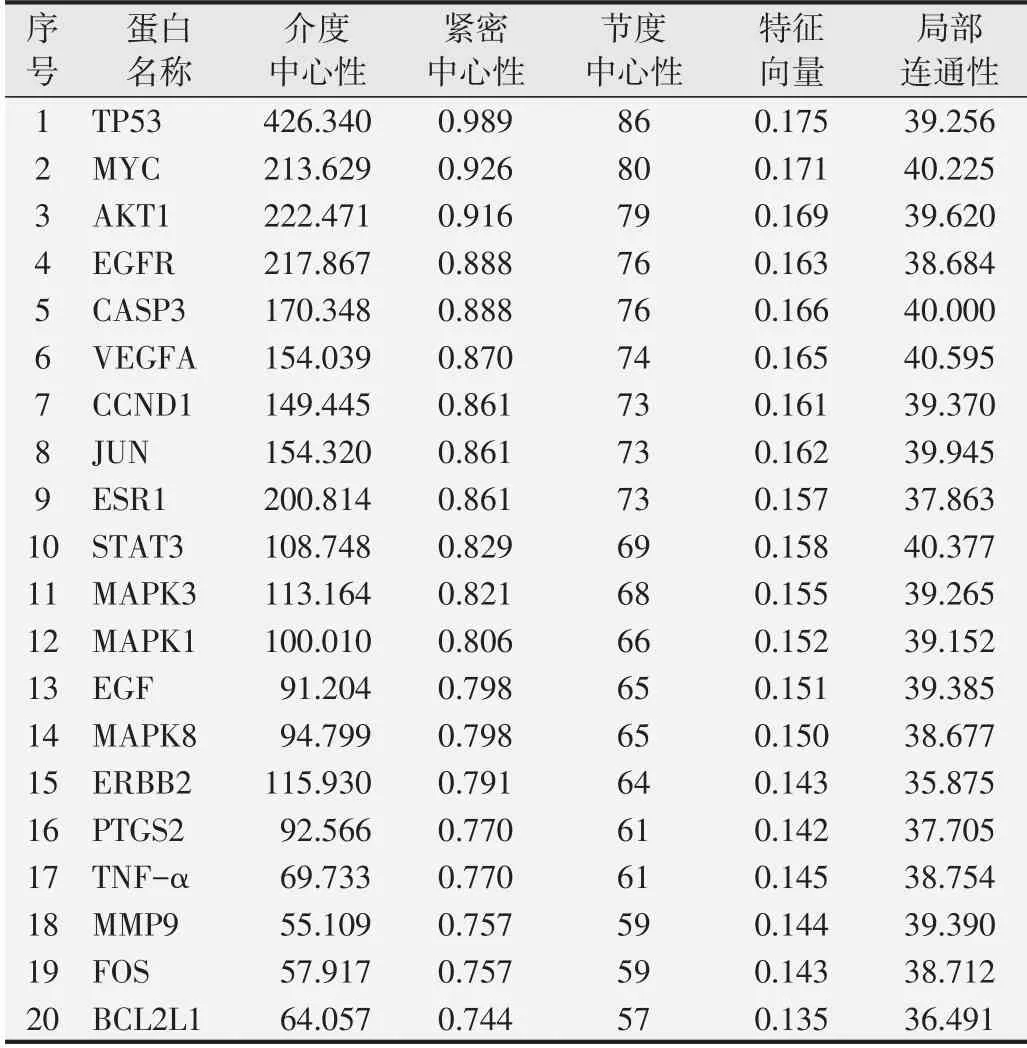
表1 LDGD抗乳腺癌核心靶点拓扑分析结果
LDGD抗乳腺癌核心靶点中关键靶点的进一步筛选流程见图4,将每次PPI网络中大于中位值的靶点再进按照上述步骤对核心靶点进行筛选,共3次,从图中结果可知LDGD抗乳腺癌的关键靶点为AKT1、MYC、TP53、EGF。

图4 LDGD抗乳腺癌关键靶点的筛选
2.5 交集基因的GO功能富集分析
选取排名前10的富集条目,并根据每个项目的P值、Q值及富集在其上的基因数目绘制条形图。结果如图5所示,LDGD抗乳腺癌的功能富集分析结果共得到2 569个GO条目。细胞成分45个,主要有细胞周期蛋白依赖性激酶、质膜筏、核染色质、蛋白激酶复合物、转录因子复合体、丝氨酸/苏氨酸蛋白激酶复合物、膜区、膜微区等。生物学过程2 218个,主要有凋亡信号通路的调节,氧化应激等。分子功能130个,主要有蛋白质丝氨酸/苏氨酸激酶活性、转录因子活性核受体活性、泛素蛋白连接酶结合等。

图5 甘草干姜汤抗乳腺癌的GO功能富集分析
2.6 KEGG通路富集分析
使用R语言的“Pathview”在线程辑包,对交集基因进行KEGG通路富集分析。选取排名前20的富集通路,根据每个通路的P值、Q值及富集在其上的基因数目绘制气泡图,见图6。
如图6所示,LDGD抗乳腺癌主要涉及p53、TNF、IL-17、EGFR、细胞凋亡等信号通路。
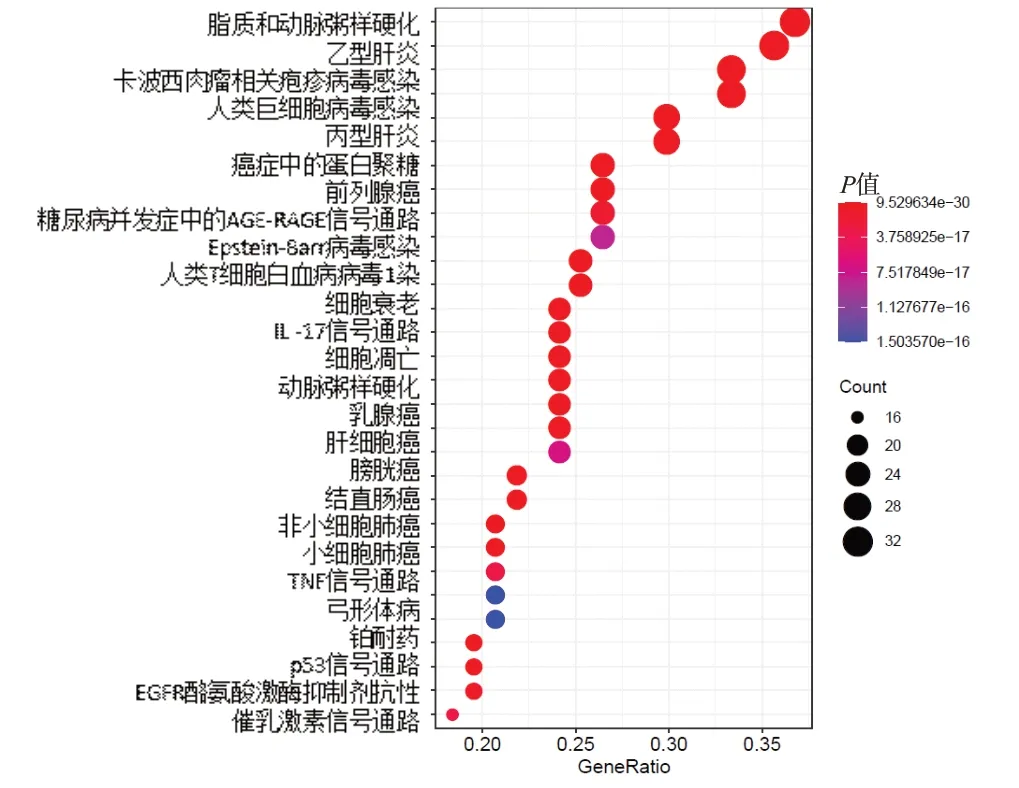
图6 LDGD抗乳腺癌的KEGG通路富集图
2.7 分子对接结果
以AKT1为关键词检索PDB数据库,获得一个蛋白晶体结构,PDB编号为4EKL,分辨度为2.00Å(表2)。以原配体所在位置设置活性口袋,口袋的三维坐标为28.219 521,5.262 347,11.381 138,半径为9.493 813。原配体打分值为142.655,RMSD值为0.744 1。关 键 氨 基 酸 为GLU234,GLU228,GLY159,ALA230。8种成分与活性口袋进行对接,甘草苷、6-姜酚、6-姜烯酚、甘草素、异甘草素、异甘草苷能与活性口袋完成对接(图7)。以原配体打分值的80%为标准:甘草苷、6-姜酚、6-姜烯酚、甘草素均符合对接标准,且均能与关键氨基酸GLU234产生氢键或静电作用。MYC未找到合适的蛋白晶体结构,TP53、EGF均未找到与蛋白晶体结构对应的原配体,因此未列出结果。

表2 甘草干姜汤8种药效成分与AKT1分子对接结果

图7 甘草干姜汤药效成分与靶点AKT1的结合方式
3 讨论
本文利用网络药理学旨在筛选出甘草干姜汤抗乳腺癌可能的药效成分和作用机制,结果表明LDGD抗乳腺癌的潜在关键靶点为AKT1、MYC、TP53、EGF;利用GO功能富集分析LDGD抗乳腺癌的生物学过程主要有凋亡信号通路、氧化应激等,与分子功能相关的有蛋白质丝氨酸/苏氨酸激酶活性、转录因子活性核受体活性、泛素蛋白连接酶结合等;通过KEGG通路富集分析LDGD抗乳腺癌主要涉及p53、TNF、IL-17、EGFR、细胞凋亡等信号通路;与AKT1进行分子对接,结果显示甘草苷、6-姜酚、6-姜烯酚、甘草素与靶点结合较好且打分值较高,并且研究报道甘草苷和6-姜酚在甘草干姜汤中含量较高,为175.68、29.48μg/mL[10],因此这4种成分可能是抗乳腺癌主要活性成分。
由研究报道可知AKT有关通路可发挥调节细胞增殖、细胞凋亡、细胞周期、蛋白质翻译和代谢等作用[16],原癌基因c-MYC控制细胞增殖与细胞死亡之间的平衡[17],p53通过介导增强子调控参与乳腺癌通路[18-19],EGF可以抑制肿瘤细胞的凋亡[20]。而中药复方抗肿瘤是一个多靶点多成分共同作用的结果,本文从“疾病-基因-靶点-药物”的角度出发,预测了甘草干姜汤抗乳腺癌可能的药效成分和作用机制。但研究结果受限于中药成分和疾病靶点的研究报道,比如甘草干姜汤药效成分的研究尚有不足,靶点蛋白晶体结构不准确或没有原配体等可能导致其抗肿瘤作用成分预测的准确性有所欠缺。应结合实验研究和临床研究进一步优化靶点选择,综合考虑药效成分及其含量、与靶点的结合情况等确定主要活性成分,为实验研究提供指导。
