海藻糖对牛未成熟卵母细胞玻璃化冷冻的影响
2022-02-15李晓霞肖红卫曹平华徐志谦张志阳荆鹏华禹学礼栗颖华
李晓霞,肖红卫,曹平华,徐志谦,张 芳,张志阳,荆鹏华,禹学礼,栗颖华
(1.河南科技大学动物科技学院,洛阳 471023;2.动物胚胎工程及分子育种湖北省重点实验室,武汉 430064)
哺乳动物卵母细胞超低温冷冻保存对于维持珍稀或濒危动物的遗传多样性和促进优良品种育种具有重要意义[1],同时也为辅助生殖技术和不孕症治疗产生重大影响[2]。卵母细胞冷冻大多以减数分裂Ⅱ(MⅡ)期为研究对象,但从理论上推测,处于生发泡(GV)和减数分裂Ⅰ(MⅠ)期的未成熟卵母细胞更适于冷冻[3-4]。因为MⅡ期卵母细胞冷冻易造成纺锤体、染色体的紊乱和错位,而未成熟卵母细胞冷冻可避免纺锤体的损伤[3]。目前,未成熟卵母细胞冷冻效果仍远远低于MⅡ期卵母细胞,因此,冷冻技术方法亟待突破。相较于慢速冷冻技术,玻璃化冷冻技术对卵母细胞的损伤更小[5],是一种简单、快速、高效、低成本和低风险的技术[6]。玻璃化是基于含有高浓度冷冻保护剂的玻璃化溶液与液氮直接接触后凝固而不形成冰晶。冷冻保护剂是一种能够减少细胞在冷冻和解冻过程中损伤的化学物质,然而,由于渗透作用和化学毒性,它可能会影响卵母细胞的结构和发育能力[7-8]。目前,常通过加入无毒的冷冻保护剂(如糖)来减少冷冻造成的损伤[9]。
糖在玻璃化过程中能够阻碍渗透性休克,保护和稳定细胞膜蛋白,并提高细胞内冷冻保护剂达到玻璃化状态的能力[10]。海藻糖已被证明在稳定冷冻和干燥细胞方面特别有效[11]。海藻糖是一种自然产生的双糖,在各种应激条件下具有保护细胞的作用,如氧化损伤[12]、脱水[13]和温度变化[14]。这些特性表明海藻糖可能适合作为体外培养基的补充。研究表明,在卵母细胞和胚胎的玻璃化冷冻或解冻液中添加海藻糖可提高超低温保存后的存活率和胚胎发育能力[15-16]。海藻糖作为冷冻保护剂曾被用于不同物种卵母细胞的低温保存,如人[3]、牛[15]、猪[17]和羊[18]。线粒体是参与细胞代谢和凋亡的重要细胞器,在卵母细胞成熟和胚胎发育中起着重要作用[19],研究不同浓度海藻糖对玻璃化冷冻牛卵母细胞活性线粒体分布的影响具有重要意义。本研究在玻璃化冷冻液和解冻液中分别添加不同浓度海藻糖,探讨海藻糖对牛未成熟卵母细胞玻璃化冷冻-解冻后的形态正常率、活性线粒体分布和体外成熟率的影响,以期为将海藻糖用于提高冷冻卵母细胞的发育能力提供参考。
1 材料与方法
1.1 主要试剂
TCM-199购自Gibco公司;胎牛血清(FBS)、牛血清白蛋白(BSA)均购自杭州四季青生物工程有限公司;促卵泡素(FSH)、促黄体素(LH)均购自中国科学院动物研究所;其他试剂除特别注明外均购自Sigma公司。
冷冻基础液(HM):TCM-199+20% FBS。
卵母细胞玻璃化冷冻液(VS):VS1:80% HM+10% (V/V) EG+10% (V/V) DMSO;VS2:60% HM+20% (V/V) EG+20% (V/V) DMSO+0.5 mol/L蔗糖或不同浓度的海藻糖(0.25、0.5和1 mol/L)。
卵母细胞解冻液(WM):WM1:HM+0.5 mol/L蔗糖或不同浓度的海藻糖(0.25、0.5和1 mol/L);WM2:HM+0.25 mol/L蔗糖或不同浓度的海藻糖(0.125、0.25和0.5 mol/L);体外成熟培养液:TCM199+100 μmol/L半胱氨酸+0.5 μg/mL FSH+5 μg/mL LH+5% FBS。
1.2 卵母细胞采集
从洛阳周边屠宰场收集牛卵巢,置于35 ℃含有青霉素、链霉素的生理盐水中,于6 h内运送回实验室,再用生理盐水洗涤3次备用。用带有12号针头的10 mL一次性注射器抽吸卵巢表面直径为2~8 mm卵泡,除去蜘蛛网状卵、透明带变形卵和裸卵,余下的卵母细胞用于玻璃化冷冻。
1.3 卵母细胞OPS玻璃化冷冻和解冻
1.3.1 卵母细胞的冷冻 玻璃化冷冻所需冷冻液提前15 min在39 ℃加热板上预热。首先,将牛未成熟卵母细胞在HM液中洗涤3遍后移入VS1中平衡1 min后,再分别移入含有0.5 mol/L蔗糖或海藻糖(0.25、0.5和1 mol/L)的10 μL VS2微滴中,然后快速地将卵母细胞移入1.5 μL VS2微滴中,立即用OPS管细端轻触液滴,通过虹吸作用将卵母细胞连同VS2液一起吸入OPS管细端(每管装入5~8枚卵母细胞),随后立即浸入液氮中保存。卵母细胞与VS2液吸入OPS管后被投入液氮,整个过程不超过30 s。
1.3.2 卵母细胞的解冻 卵母细胞解冻的操作在39 ℃加热板上进行。解冻时,将OPS细管从液氮罐中取出,在空气中停留3 s后直接将OPS管细端分别浸入预热好的含0.5 mol/L蔗糖或海藻糖(0.25、0.5和1 mol/L)的1 mL WM1液中,用手指封住OPS管粗端,使细管内空气受热膨胀,卵母细胞即可排出到WM1液中,停留5 min。随后,将卵母细胞分别移入含有0.25 mol/L蔗糖或海藻糖(0.125、0.25和0.5 mol/L)的100 μL WM2液滴中,停留5 min;然后将卵母细胞相继移入2个100 μL HM液滴中,均停留5 min。解冻后的卵母细胞可用于形态评估、活性线粒体分布检测和体外成熟培养。
1.4 卵母细胞的形态评估
牛未成熟卵母细胞在冷冻、解冻液中添加0.5 mol/L蔗糖或0.25、0.5和1 mol/L海藻糖经冷冻-解冻后,与新鲜组一同进行形态评估。未冷冻组即新鲜组及解冻后的卵母细胞依据卵丘细胞包裹度、膜完整性和胞质颜色等指标评估其形态正常率。形态正常卵母细胞至少有3层致密卵丘细胞包裹,形状呈球形、对称,胞质均匀光亮,透明带完整光滑,无明显细胞溶解、细胞膜损伤、膨胀、空泡形成、退化或细胞内容物泄露等现象;形态异常卵母细胞会出现透明带破裂或不完整,细胞质颜色偏暗、松散、不均匀,卵周隙的有无、大小等现象。
1.5 卵母细胞活性线粒体分布检测
用线粒体膜电位检测试剂盒(JC-1,Beyotime)检测未冷冻新鲜组和解冻后牛卵母细胞的活性线粒体分布情况,每组重复3次,每次卵母细胞数量不少于20枚。具体操作如下:将卵母细胞置于含0.5% BSA的PBS溶液中,用200 μL移液枪轻轻吹掉卵母细胞周围的卵丘细胞后经0.5% BSA的PBS溶液洗涤2遍;将洗涤后卵母细胞放入50 μL PBS液(含0.5% BSA)+ 50 μL JC-1染色液组成的微滴中避光37 ℃孵育30 min;将卵母细胞在JC-1染色缓冲液中洗涤2遍后置于载玻片预先用记号笔画好的小圆圈中心位,然后在圆圈边缘线上涂少量凡士林后轻轻盖上盖玻片,以免造成卵母细胞的破损;将制好的载玻片置于荧光显微镜绿光(发射波长580~610 nm)和蓝光(发射波长510~520 nm)下,观察卵母细胞的活性线粒体分布。
1.6 卵母细胞的体外成熟及核成熟评估
经形态评估正常的卵母细胞在预先平衡的体外成熟液中洗涤2~3遍,随即放入覆盖石蜡油的成熟液微滴(50 μL/滴)中,每滴25~30枚卵母细胞,最后置于39 ℃、5% CO2和100%饱和湿度的CO2培养箱中静置培养24 h。体外成熟培养24 h后,放入预平衡后的体外成熟液中,然后加入0.1%透明质酸酶去掉其周围的卵丘细胞,即可在体视显微镜下观察卵周隙内是否有第一极体(PB1)排出,排出第一极体则为核成熟的卵母细胞。记录后统计卵母细胞的核成熟率。
核成熟率(%)=排出第一极体卵母细胞数/入孵总卵母细胞数×100%
1.7 统计分析
用SPSS 22.0统计软件进行单因素方差(One-Way ANOVA)分析,用Duncan氏法进行多重比较。结果用平均值±标准差表示,P<0.05表示差异显著。
2 结 果
2.1 海藻糖对OPS法冷冻保存牛未成熟卵母细胞形态的影响
由表1可知,冷冻、解冻液中添加0.5 mol/L海藻糖冷冻-解冻后的形态正常率显著高于0.25、1 mol/L海藻糖组(P<0.05),且后两组间也存在显著差异(P<0.05);0.5 mol/L海藻糖组的形态正常率也显著高于0.5 mol/L蔗糖组(P<0.05),且0.5 mol/L蔗糖组与1 mol/L海藻糖组差异不显著(P>0.05);但各冷冻组的卵母细胞形态正常率均显著低于新鲜组(P<0.05)。
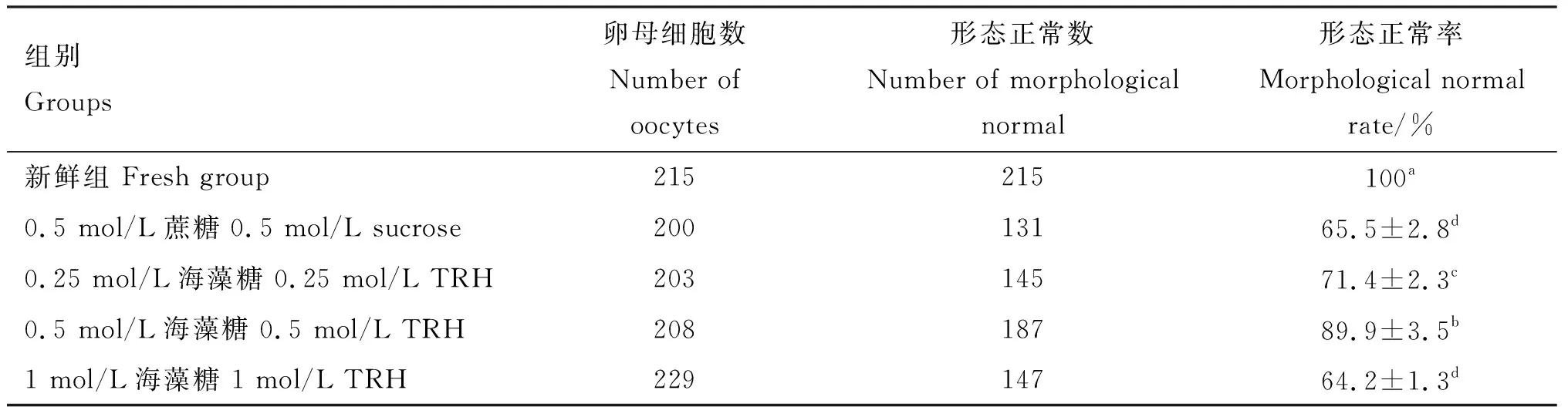
表1 各组牛未成熟卵母细胞玻璃化冷冻后形态正常率
2.2 海藻糖对OPS法冷冻保存牛未成熟卵母细胞活性线粒体分布的影响
线粒体活性检测结果表明:新鲜牛未成熟卵母细胞的活性线粒体均匀地分布在细胞质中,呈现出强烈的荧光(图1A、1a),其中在荧光显微镜蓝光下呈现强的黄绿色荧光;0.5 mol/L海藻糖组卵母细胞的活性线粒体集中分布在细胞膜内侧区域且分布区域明显少于新鲜组,在绿光和蓝光下分别呈现强的红色荧光和黄绿色荧光(图1D、1d);0.25 mol/L海藻糖组(图1C、1c)卵母细胞的活性线粒体分布区域、荧光强度均明显低于0.5 mol/L海藻糖组,其中蓝光下呈现的荧光颜色由新鲜和0.5 mol/L海藻糖组的黄绿色变成了绿色并呈现不连续的散点分布;而0.5 mol/L蔗糖组(图1B、1b)和1 mol/L海藻糖组(图1E、1e)卵母细胞活性线粒体分布区域极少、甚至无线粒体活性,蓝光下观察其荧光颜色则由0.25 mol/L海藻糖组的绿色变成了暗绿色,荧光强度均弱于0.25 mol/L海藻糖组。

①A~E,在荧光显微镜绿光下观察活性线粒体的分布;a~e,在荧光显微镜蓝光下观察活性线粒体的分布。②A、a,新鲜组;B、b,0.5 mol/L蔗糖组;C、c,0.25 mol/L海藻糖组;D、d,0.5 mol/L海藻糖组;E、e,1 mol/L海藻糖组。③箭头所示为活性线粒体分布区域①A-E,The active mitochondrial distribution was tested by excited green light of fluorescence;a-e,The active mitochondrial distribution was tested by excited blue light of fluorescence.②A and a,Fresh group;B and b,0.5 mol/L sucrose group;C and c,0.25 mol/L TRH group;D and d,0.5 mol/L TRH group;E and e,1 mol/L TRH group.③The arrows indicate the distribution area of active mitochondria图1 各组牛未成熟卵母细胞玻璃化冷冻后活性线粒体分布(200×)Fig.1 The distribution of active mitochondrial of bovine immature oocytes after vitrification in different group (200×)
2.3 海藻糖对OPS法冷冻保存牛未成熟卵母细胞体外成熟的影响
牛未成熟卵母细胞冷冻-解冻后,体外成熟培养24 h成熟率结果表明,冷冻、解冻液中添加0.5 mol/L海藻糖冷冻-解冻后卵母细胞的体外成熟率显著高于0.25和1 mol/L海藻糖组(P<0.05),且后两组间无显著差异(P>0.05);0.5 mol/L海藻糖组的成熟率也显著高于0.5 mol/L蔗糖组(P<0.05),且后者与1 mol/L海藻糖组差异不显著(P>0.05);但各冷冻组的卵母细胞体外成熟率均显著低于新鲜组(P<0.05)(表2)。

表2 各组牛未成熟卵母细胞玻璃化冷冻后体外成熟率
3 讨 论
建立一种高效的家畜卵母细胞超低温保存方法对畜牧业具有重要意义[20]。OPS玻璃化冷冻可增加冷冻降温和解冻升温的速率,极大程度上改善细胞冷冻-解冻后的发育能力和妊娠率[21-22],是目前冷冻牛卵母细胞最有效的方法之一。冷冻保护剂组成及浓度是影响OPS玻璃化冷冻效率的关键因素。海藻糖作为一种非渗透性冷冻保护剂,可通过降低在玻璃化过程中达到玻璃化状态所需的浓度来降低渗透性冷冻保护剂可能产生的毒性作用,并减少在OPS玻璃化冷冻和解冻过程中细胞的损伤[16]。
海藻糖的低温保护作用是由于这种双糖优良的玻璃形成特性[23],以及其在低温下的低结晶倾向[24]和玻璃态的高稳定性。本研究用不同浓度海藻糖或蔗糖玻璃化冷冻-解冻牛未成熟卵母细胞发现,0.25和0.5 mol/L海藻糖组的细胞形态正常率均显著高于0.5 mol/L蔗糖和1 mol/L海藻糖组,且0.5 mol/L海藻糖组效果最佳。Fakhrildin等[18]在未成熟绵羊卵母细胞冷冻和解冻液中添加0.25 和0.5 mol/L海藻糖进行玻璃化冷冻-解冻发现,与用0.25 mol/L海藻糖玻璃化处理的结果相比,用0.5 mol/L海藻糖玻璃化处理后可明显提高未成熟绵羊卵母细胞的活力和形态正常率。Sanaei等[16]将成熟的绵羊卵母细胞分别置于含不同浓度海藻糖的冷冻液中进行玻璃化冷冻处理后,0.5 mol/L海藻糖组的卵母细胞活力显著高于其他冷冻组,却明显低于未冷冻新鲜组。对牛卵母细胞的冷冻也得到了相似的结果,Arav等[25]用含0.25、0.5和1 mol/L海藻糖或蔗糖冷冻液玻璃化冷冻牛未成熟卵母细胞后发现,海藻糖降低冷冻对细胞损伤的效果优于蔗糖,且0.25 mol/L海藻糖组卵母细胞受精率最高。以上研究结果说明,玻璃化冷冻过程中使用不同浓度的海藻糖会影响玻璃化冷冻的效果,且海藻糖作为冷冻保护剂比蔗糖更有效和安全[26]。低温保存过程中,卵母细胞的细胞质膜是受冷冻损伤的主要部位。海藻糖在膜稳定方面的作用优于其他糖,也是最有效的糖,在干燥过程中可以稳定脂质体,对保存干燥和冷冻生物材料有其独特的作用[27]。本研究结果发现,0.5 mol/L海藻糖组未成熟卵母细胞经玻璃化冷冻-解冻后的形态正常率显著高于0.5 mol/L蔗糖组,说明了海藻糖作为冷冻保护剂的有效性。但目前海藻糖在牛卵母细胞冷冻后对其形态评估的相关报道还较少,本研究结果可为其广泛应用提供理论参考。
许多研究表明,玻璃化会导致线粒体功能障碍[28]和线粒体分布异常[29]。线粒体是参与多种细胞活动的重要细胞器[30],包括能量供应、胞内钙稳态和细胞器迁移等[31]。因此,线粒体的损伤或线粒体分布的改变可能会导致减数分裂和有丝分裂纺锤体的缺陷,并抑制卵母细胞成熟和胚胎发育[32]。小鼠MⅡ期卵母细胞玻璃化冷冻后线粒体活性和线粒体极性分布率比新鲜组明显降低[33]。活性线粒体的数量在玻璃化冷冻和新鲜的牛成熟卵母细胞间存在显著差异变化[34]。Abe等[35]也得到了相似的结果,他们利用透射电子显微镜观察在含有蔗糖的冷冻液中对牛未成熟卵母细胞进行一步或逐步玻璃化冷冻后,逐步玻璃化冷冻组的超微结构与新鲜组类似且细胞器畸变率低;而一步玻璃化冷冻组的大多数卵母细胞具有多空泡的细胞质和膜破裂的线粒体,冷冻效果明显低于逐步冷冻组和未冷冻新鲜组。这些研究结果说明玻璃化冷冻会造成线粒体功能的变化,而这种变化可能是由于玻璃化冷冻卵母细胞会增加活性氧(ROS)的水平,造成氧化应激。氧化应激与卵母细胞线粒体损伤有关,它会改变线粒体膜电位和结构,使ATP产量减少,进而影响卵母细胞的成熟[36]。海藻糖作为低温保护剂,除了能帮助生物分子维持玻璃空间结构[37]及结合蛋白质表面周围的水分子外[38],还具有潜在的抵抗渗透应激、缺氧和氧化应激的能力[39]。本研究结果也证实了海藻糖的这一特性,在冷冻液中添加0.5 mol/L海藻糖经玻璃化冷冻-解冻处理后的牛未成熟卵母细胞活性线粒体分布区域明显高于0.5 mol/L蔗糖组和0.25和1 mol/L海藻糖组,但各处理组均低于未冷冻新鲜组,说明海藻糖在玻璃化冷冻-解冻过程中可能减少了卵母细胞ROS的产生,从而提高卵母细胞的线粒体活性和体外成熟能力。
目前,细胞外糖作为冷冻保护剂为超快速玻璃化提供了一种新的前景。细胞外糖的作用是吸收细胞内的水。细胞外糖、非渗透性和渗透性冷冻保护剂的结合可以防止冰晶体形成对细胞产生的损害[40]。海藻糖在预防低温损伤[41]和稳定水介质中细胞膜的结构和功能完整性方面具有重要作用[42],糖的稳定作用一般与生物分子在双层膜中的特定相互作用有关[16]。本研究尝试在牛未成熟卵母细胞的OPS玻璃化冷冻和解冻液中添加海藻糖,与其他冷冻组相比,添加0.5 mol/L海藻糖均可显著提高冷冻-解冻后牛未成熟卵母细胞的体外成熟率,但却显著低于未冷冻新鲜组。Park等[15]将牛未成熟卵母细胞经逐步冷冻(先放入含0.1 mol/L海藻糖或蔗糖冷冻液中3 min,后放入含0.25 mol/L海藻糖或蔗糖冷冻液中1 min)后,比较海藻糖、蔗糖对冷冻后发育到MⅡ 期比率及受精后卵裂率和囊胚率的影响,发现海藻糖与蔗糖组发育到MⅡ期的比率无显著变化,但海藻糖组的卵裂率和囊胚率均明显高于蔗糖组。说明海藻糖和蔗糖在低温保存前对未成熟的牛卵母细胞没有毒性,且海藻糖在卵母细胞低温保存的成功率优于蔗糖[26]。Martins等[43]研究表明,牛未成熟卵母细胞在含1 mol/L海藻糖或蔗糖冷冻液中经玻璃化冷冻后,两者发育到MⅡ期的比率均显著低于未冷冻的新鲜组,这与本研究结果一致。而牛未成熟卵母细胞在含40% EG、20%聚乙烯吡咯烷酮(PVP)和0.3 mol/L海藻糖的冷冻液中经玻璃化冷冻-解冻后,卵母细胞的体外成熟率与新鲜组无明显差异[44]。这些结果的不同可能是由于物种、低温保存的载体或渗透性或非渗透性冷冻保护剂类型和浓度的不同造成的[16],这些因素均会影响卵母细胞的玻璃化冷冻效果。
4 结 论
本研究结果表明,0.5 mol/L海藻糖可显著提高牛未成熟卵母细胞玻璃化冷冻-解冻后的形态正常率和体外成熟率,增加活性线粒体分布区域及其荧光强度,其效果优于目前常用的冷冻保护剂蔗糖,可为优化未成熟卵母细胞玻璃化冷冻保存体系、提高玻璃化冷冻后卵母细胞的发育潜能提供参考。
