新疆地区2株驴源马流产沙门菌的分离鉴定及致病性分析
2022-02-15蒲小峰张雨薇李胜男张雪静
蒲小峰,张雨薇,李胜男,张雪静,苏 艳
(新疆农业大学动物医学学院,乌鲁木齐 830052)
近年来,随着新疆地区驴养殖业的快速发展,马流产沙门菌(Salmonellaabortusequi)引起的驴副伤寒已成为影响和阻碍驴产业持续发展的重要传染病之一[1-2],已对驴产业造成严重的经济损失。马流产沙门菌仅侵害马属动物,引起怀孕母驴(马等)流产、子宫内膜炎、公驴(马)睾丸炎、关节突出、幼驴(驹)腹泻、败血症、支气管肺炎、心包炎等症状[3-4]。该病通常呈散发性,有时呈地方性流行,初产母畜和幼驹易感性最高[5]。国内关于猪、禽类沙门菌的报道较多,关于驴源马流产沙门菌的报道较少。目前该病在中国已随马驴产业的快速发展呈多地频发的趋势,冯培祥等[6]在2018年及孙阳阳等[7]在2019年分别从山东地区驴流产胎儿分离得到驴源沙门菌。该病引起马属动物的流产率可达到30%~100%,直接影响了马及驴产业的发展。
鞭毛蛋白FliC不仅是马流产沙门菌的运动器官,还与该菌的黏附、侵袭力、毒性和生物被膜的形成相关[8-9]。生物被膜又是导致该菌的隐性感染与反复感染的重要原因之一[10-11]。此外,FliC保守性良好[12],还有较强的抗原性[13]。目前关于驴源马流产沙门菌鞭毛基因的研究较少。2020年新疆伊犁地区和和田地区出现了驴流产的病例,本试验从新疆2个不同地区采集了驴流产胎儿肝脏和脾脏进行细菌分离培养,得到了2株驴源马流产沙门菌,并进行了生化试验、药敏试验和小鼠致病性分析,还对驴源马流产沙门菌的鞭毛蛋白FliC的氨基酸进行了进化分析与比较,可为进一步研究鞭毛在该菌的致病机制和基因工程疫苗的研究提供基础,并为临床开展驴源马流产沙门菌病的诊断与治疗提供参考依据。
1 材料与方法
1.1 病料及试验动物
新疆地区某2个集约化驴场的驴流产胎儿,通过剖解采集其肝脏、脾脏、肺脏、肾脏等组织器官,共21份,进行细菌的分离鉴定。5周龄健康SPF昆明小鼠54只,雌雄不限,购自新疆医科大学实验动物中心。
1.2 培养基及试剂
胶回收试剂盒、DNA提取试剂盒、TaqDNA聚合酶、DL2000 DNA Marker均购自天根生化科技(北京)有限公司;营养琼脂、SS琼脂、药敏试纸、沙门菌生化发酵管均购自杭州滨和微生物试剂有限公司;其他试剂均为国产分析纯。
1.3 方法
1.3.1 细菌分离纯化及形态学观察 将无菌采集的样品研磨,涂布SS琼脂鉴别培养基,37 ℃划线培养16 h后,观察固体培养基上的菌落形态,符合沙门菌菌落特征的可挑取单菌落,划线挑取反复培养5次,观察到培养基上均为同一种菌落时进行革兰氏染色镜检,观察细菌形态。
1.3.2 生化鉴定 参考《伯杰氏系统细菌学手册》[14]将纯化后的分离菌单菌落接种于微量生化鉴定管中,37 ℃培养24~48 h,观察并记录结果。
1.3.3 鞭毛FliC基因扩增及序列分析 用DNA提取试剂盒提取的分离株基因组DNA,并以此为模板进行PCR扩增。参考马流产沙门菌鞭毛基因FliC(GenBank登录号:HE801377.1)使用Primer Premier 5.0软件设计引物,引物序列:F:5′-CGCGGATCCTTGACCCAGAAT-3′;R:5′-GTG-CTCGAGTCGGAACCTGGTT-3′。引物由生工生物工程(上海)股份有限公司合成。PCR反应总体系25 μL:TaqDNA聚合酶1.25 μL,10×TaqPCR缓冲液6.25 μL,dNTP(2.5 mmol/L)10 μL,DNA模板1.5 μL,上、下游引物各1 μL,加ddH2O至25 μL。PCR反应程序为:95 ℃预变性5 min;95 ℃变性30 s,57 ℃退火30 s,72 ℃延伸90 s,共35个循环;72 ℃延伸10 min。PCR产物经凝胶电泳检测,取结果为阳性的PCR产物送至生工生物工程(上海)股份有限公司测序。经BLAST比对后,用DNAStar软件将分离菌株的FliC氨基酸序列与GenBank中收录的相关沙门菌参考株进行序列及相似性分析,并采用Mega 7.0软件,构建系统发育树。
1.3.4 小鼠致病性试验 将分离菌株分别接种于LB培养基,37 ℃、180 r/min过夜培养,每株菌用分光光度计检测细菌数量分别至1×108、5×108、1×109、5×109CFU/mL 4个梯度组(Ⅰ、Ⅱ、Ⅲ、Ⅳ组)。将54只健康昆明小鼠随机分成9组,每组6只,每只小鼠腹腔注射1 mL,对照组小鼠注射1 mL PBS,连续观察7 d,每12 h记录一次死亡情况。
1.3.5 脏器荷菌量检测及病理切片观察 对死亡小鼠剖检,每组取3只小鼠无菌采集脾脏和肾脏组织,一部分进行研磨,用灭菌生理盐水梯度稀释后涂固体培养平板,37 ℃培养18~24 h,统计菌落数,计算荷菌量;另一部分制作病理切片,通过HE染色观察小鼠脏器病理组织学变化。
1.3.6 药敏试验 采用药敏纸片琼脂扩散法测试分离菌对21种抗菌药的敏感性。分别取2株分离菌的培养液80 μL,均匀涂布于营养琼脂平板上,将药敏试纸片贴于平板上,37 ℃培养18~24 h,测量其抑菌圈直径,按照WS/T125-1999标准判定分离菌对抗生素的敏感性,结果表示为敏感(S)、中介(I)和耐药(R)。
1.4 数据统计分析
数据采用SPSS 10.0软件进行分析,通过单因素LSD法分析各组间差异,结果以平均值±标准差表示,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结 果
2.1 细菌分离纯化及鉴定
对21份马流产胎儿内脏样品进行培养鉴定,最终分离出2株疑似马流产沙门菌,分别命名为XD1-2和G1-1,2株菌在SS琼脂培养基上的菌落呈圆形凸起,中央黑、边缘透明的圆形菌落(图1A)。镜检为革兰阴性、散在排列的无荚膜芽胞的杆菌(图1B)。
2.2 生化鉴定结果
生化试验结果显示,2株分离菌(G1-1、XD1-2)对H2S、葡磷胨水、半固体、氨基酸脱羧酸空白对照、赖氨酸、鸟氨酸、山梨醇的反应均为阳性;G1-1菌株的枸橼酸盐鉴定管为阳性,而XD1-2为阴性;2株分离菌的其他6种生化反应均为阴性(表1),符合马流产沙门菌的特征。

表1 分离菌株生化鉴定结果
2.3 FliC基因扩增及遗传进化分析
对2株分离菌株的FliC基因进行PCR扩增,均获得了约1 000 bp的目的条带(图2),与预期大小相符。相似性比对结果表明,2株分离菌FliC氨基酸序列之间的相似性为99.0%,2株分离菌与Ireland-HE801373、Ireland-HE801378株相似性均最高,且均为99.3%(图3),分离菌XD1-2与美国人源肠炎沙门菌分离株USA-EBQ1214032.1的相似性为98.1%。氨基酸进化关系结果显示,分离株G1-1与爱尔兰马源马流产沙门菌分离株Ireland-HE801373和Ireland-HE801378及国内马源马流产沙门菌分离株China-KJ486797.1和China-KJ486769.1亲缘关系较近,而分离株XD1-2则与美国人源肠炎沙门菌分离株USA-EBQ1214032.1亲缘关系较近(图4),与相似性分析结果一致。
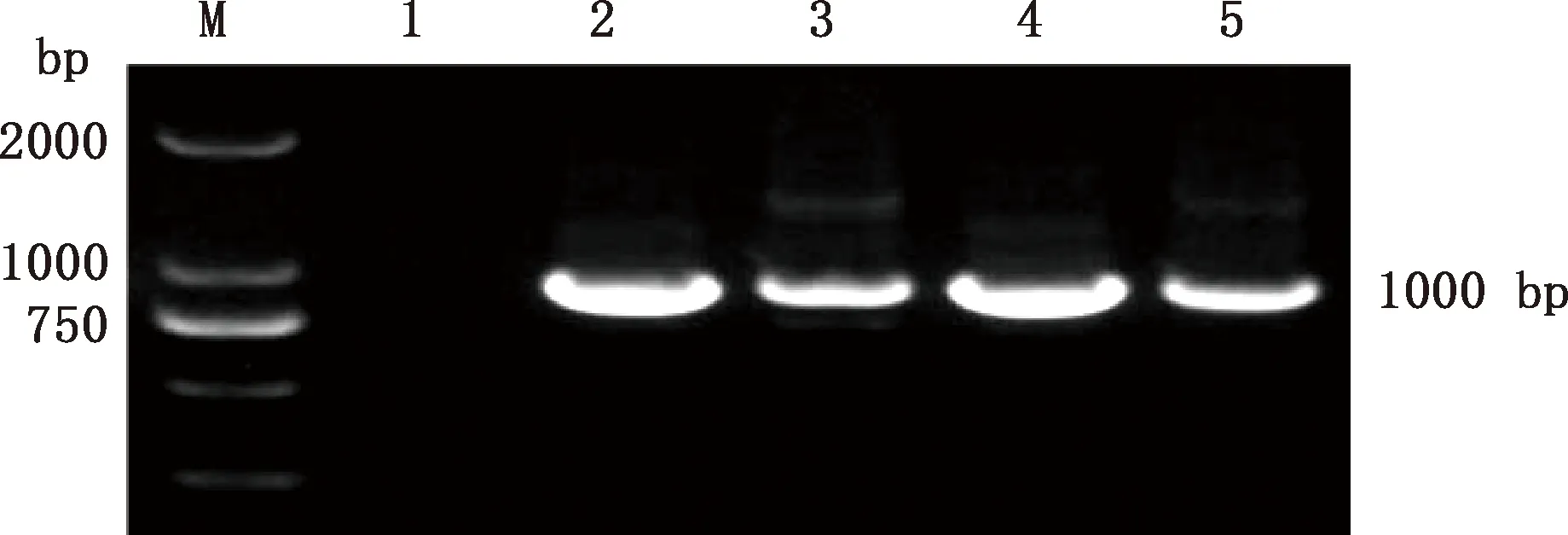
M,DL2000 DNA Marker;1,阴性对照;2、3,菌株XD1-2;4、5,菌株G1-1M,DL2000 DNA Marker;1,Negative control;2 and 3,Strain XD1-2;4 and 5,Strain G1-1图2 分离株FliC基因PCR扩增结果Fig.2 PCR amplification results of FliC genes of isolated strains
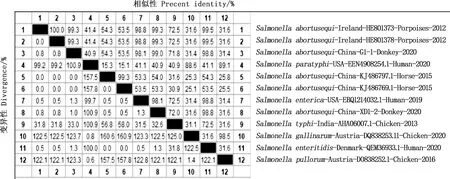
图3 分离菌株与参考菌株FliC氨基酸相似性比对Fig.3 Similarity comparison of FliC amino acid between isolated strains and reference strains

2.4 分离菌株致病性试验
试验组小鼠分别注射2株分离菌后,不同剂量组小鼠均出现不同程度的精神沉郁、被毛松乱、采食量下降、腹泻等症状,以上症状与马流产沙门菌感染的临床症状一致,再次确认是该菌感染。除G1-1Ⅰ组死亡率为83%外,其余试验组死亡率均为100%,其中G1-1 Ⅳ组小鼠全部死亡的时间为注射菌液后12 h,而XD1-2 Ⅳ组为9 h,对照组小鼠无发病死亡(表2)。无菌条件下采取G1-1 Ⅳ及XD1-2 Ⅳ组死亡小鼠肾脏及脾脏进行荷菌量检测,结果表明XD1-2菌攻击后脾脏荷菌量显著高于G1-1菌(P<0.01),但肾脏荷菌量在2株分离菌间无显著差异(P>0.05)(图5)。G1-1 Ⅳ组及XD1-2 Ⅳ组小鼠肾脏及脾脏经HE染色观察,可见XD1-2菌攻击后小鼠肾脏和脾脏出血均较G1-1菌明显(图6)。

表2 小鼠致病性试验结果
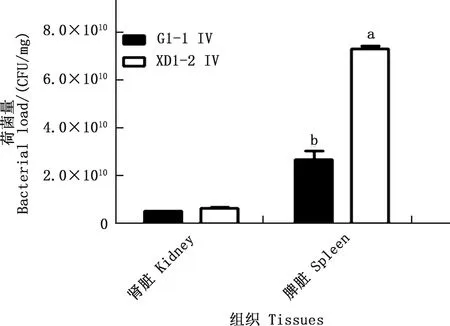
数据肩标不同字母表示差异显著(P<0.05);肩标相同字母或无字母标注表示差异不显著(P>0.05)Values with different letter superscripts mean significant difference (P<0.05);While with the same or no letter superscripts mean no significant difference (P>0.05)图5 小鼠内脏荷菌量检测结果Fig.5 Detection results of visceral bacterial load in mice

图6 死亡小鼠病理组织变化(HE,400×)Fig.6 Histopathological changes in dead mice (HE,400×)
2.5 药敏试验结果
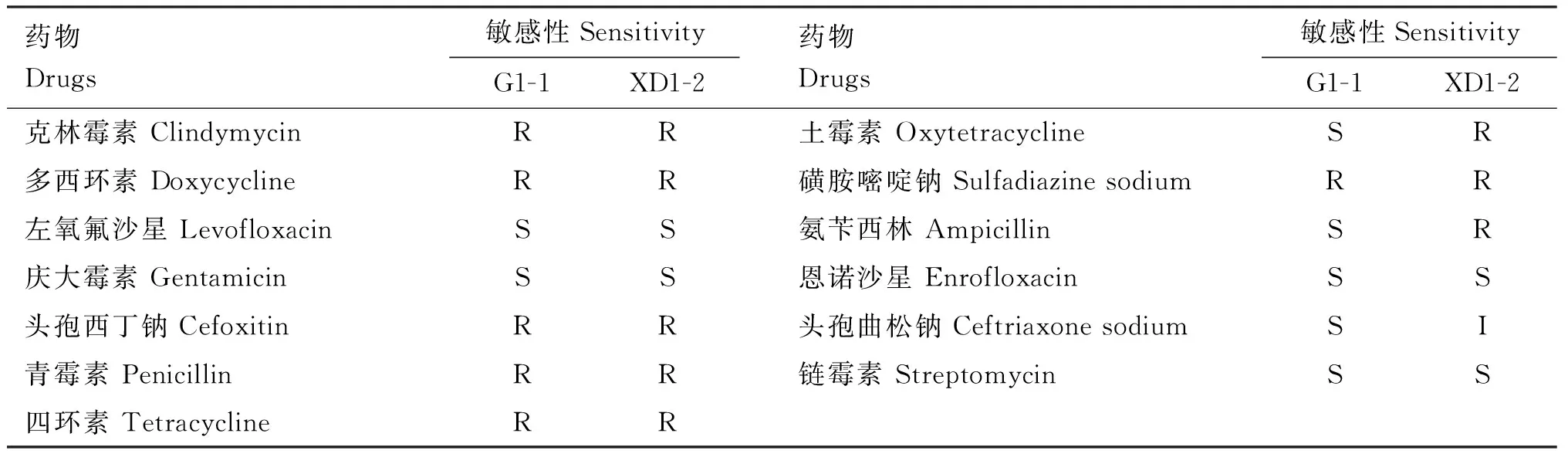
药敏试验结果显示,分离菌XD1-2对环丙沙星、左氧氟沙星、庆大霉素敏感,对头孢呋辛、利福平、头孢噻呋、诺氟沙星、头孢曲松钠中介,对其余11种抗菌药物耐药。分离菌G1-1对阿莫西林、头孢呋辛、环丙沙星、左氧氟沙星、庆大霉素、诺氟沙星、土霉素、氨苄西林、恩诺沙星、头孢曲松钠、链霉素敏感,对头孢噻呋中介,对其余9种抗菌药物耐药(表3)。

表3 分离菌株药物敏感性试验结果
续表
3 讨 论
近年来新疆驴养殖数量不断上升,由马流产沙门菌引起的流产在新疆持续散发,偶有地方暴发,且造成很多马匹呈隐性感染,很难净化,已给驴产业造成巨大经济损失。杨康等[15]在2013-2014年对新疆地区的马流产沙门菌病的流行情况进行调查,结果显示马血清中该菌抗体阳性率为28.28%。袁贝等[16]对新疆伊犁地区马匹开展马流产沙门菌血清学调查发现,该菌抗体阳性率为25.31%。刘英玉等[17]对新疆地区市售驴肉常见致病菌检测与调查时发现,沙门菌检出率为20%。
马流产沙门菌的致病性依赖于多种毒力因子,鞭毛蛋白FliC就是其中的一种重要毒力因子[18],可在该菌黏附和侵袭肠上皮细胞的过程中发挥重要的作用[19-20]。孙慧莹等[21]对9株驴源马流产沙门菌的10种毒力因子检测分析后得出,毒力基因表现为多样性的组合现象且呈高携带率。李阳等[3]对新疆地区马源马流产沙门菌的FliC基因进行序列分析,结果表明,新疆地区2株马源马流产沙门菌和爱尔兰马流产沙门菌分离株Ireland-HE801373、Ireland-HE801374和Ireland-HE801378,还与肠炎沙门菌HE801385亲缘关系较近。程相朝等[22]对肠炎沙门菌FliC基因进行同源性比较分析后得出该基因在同一物种属内同源性较高且保守性较好。本试验中对驴源马流产沙门菌的FliC基因进行了PCR扩增与遗传进化分析,结果表明,这2株分离菌在进化上有一定的差异,分离株G1-1与爱尔兰马源马流产沙门菌分离株Ireland-HE801373和Ireland-HE801378及国内马源马流产沙门菌分离株China-KJ486797.1和China-KJ486769.1亲缘关系较近,而分离株XD1-2则与美国人源肠炎沙门菌分离株USA-EBQ1214032.1亲缘关系较近。表明该地区马流产沙门菌来源不同,可能是跨区域引种或贸易造成。
目前已知的沙门氏菌血清型有2 500多种。本次试验与孙阳阳等[7]鉴定的7株驴源沙门菌种类不同,其鉴定了山东地区的5株分离菌为鼠伤寒沙门氏菌,1株为爱丁堡或汤姆逊沙门菌,另1株则为阿邦尼或爱丁堡沙门菌,本试验中驴源分离株XD1-2与G1-1均为马流产沙门菌。其次,孙阳阳等[7]对山东驴源沙门菌的致病性分析结果表明,这7株驴源菌株致病性较低,攻击小鼠后仅表现轻度腹泻,2周后好转。王芷晴等[23]研究结果表明,其分离鉴定的鹅源沙门菌对小鼠致死率为90%,同时发现小鼠脾脏、肝脏、肺脏等器官均有出血。刘勃兴等[24]从水貂分离的9株沙门菌中有6株对小鼠的致死率为100%。本试验中的分离菌株接种小鼠后具有明显的致病性,且分离株XD1-2的致病性强于G1-1,该结果与山东地区分离的驴源沙门菌对小鼠的致病性不同。冯兰等[25]研究牦牛德尔卑沙门菌时发现该菌以1×109CFU的剂量接种小鼠后,其脾脏淋巴细胞数量明显减少,红髓面积比例相对增加。本试验中2株分离菌攻击小鼠后均出现了肾脏水肿、出血,脾脏出血等病变,推测本次分离的驴源马流产沙门菌毒性更强。
孙阳阳等[7]对山东地区7株驴源沙门菌的耐药表型检测结果显示,7株菌对所检测24种抗菌药物均比较敏感。孙莹慧等[21]对9株驴源马流产沙门菌进行了11种临床常用抗菌药物的敏感性测试,证明9株菌的耐药谱较窄,对阿莫西林和链霉素耐药。李帆等[26]分析发现猪源沙门菌对四环素具有普遍耐药性。本试验中分离菌XD1-2对11种抗菌药物耐药,对5种抗菌药物敏感,对4种抗菌药物已开始表现出中介的特性;分离菌G1-1对9种抗菌药物耐药,对11种抗菌药物敏感。2株分离株(XD1-2与G1-1)对临床上广泛使用的青霉素、四环素、磺胺等抗菌药物均产生了较高的耐药性,此外还发现,2株分离菌分别对土霉素和氨苄西林表现出不同的敏感性,该结果与以上国内报道的药物敏感性结果差异较大,2株驴源马流产沙门氏菌出现了多重耐药的现象,提示在临床治疗中对耐药性的监测和用药需要引起重视。Chung等[27]报道链霉素为马属动物革兰氏阴性菌治疗首选抗菌药,本试验药敏结果与其一致,2株分离菌均对链霉素敏感。因此,养殖场内应严格遵循药物使用原则,规范药物治疗和利用高品质的疫苗防控沙门菌病,将对控制该菌耐药性的进一步发展具有重要的价值。
4 结 论
本试验从驴流产胎儿肝脏及脾脏中分离得到2株菌,分别命名为XD1-2与G1-1,经氨基酸序列比对、相似性分析、构建进化树以及致病性分析确定此2株菌均为马流产沙门氏菌。这2株菌对小鼠的致病性较强且致病性存在差异,XD1-2对小鼠的致病性强于G1-1。2株分离菌具有多重耐药特点,且对21种抗菌药物的耐药性存在差异。
