2种头孢氨苄片在比格犬体内的药代动力学及生物等效性试验
2022-02-15杨宇欣赵富华邱基程曹玉颖白如念王建中曹兴元
杨宇欣,赵富华,刘 羽,邱基程,曹玉颖,张 璐,白如念,王建中,曹兴元
(1.中国农业大学动物医学院,北京 100193;2.国家兽药残留基准实验室,北京 100193;3.中国兽医药品监察所,北京 100081;4.北京市动物疫病预防控制中心,北京 100013;5.山西农业大学动物医学学院,太谷 030801)
头孢氨苄(cephalexin,CFX)是一种β-内酰胺类抗生素,属于第一代头孢菌素,用于治疗多种感染[1],具有成本低、抗菌谱广和不良反应少等优点[2],其抗菌作用强于第二、三代头孢菌素[3]。头孢菌素的抗菌作用机理主要是其能抑制肽聚糖合成进而干扰细菌细胞膜合成[4]。从细菌生长期方面进行研究,头孢菌素属于繁殖期杀菌剂,能特异性地杀灭有细胞壁的细菌,且对人体和畜禽的影响较小[5]。头孢氨苄对大多数革兰氏阳性菌和厌氧菌具有较高抗菌活性,如对溶血性链球菌、金黄色葡萄球菌、奇异变形杆菌、肺炎链球菌、肺炎克雷伯菌、流感嗜血杆菌等都有抗菌作用[6]。人用头孢氨苄主要用于呼吸道、尿路及皮肤软组织感染的治疗[7-8],兽用制剂有相似的药效。研究表明,头孢氨苄可有效治疗犬的细菌性感染,如皮肤感染(脓皮症)[9],此外,对由细菌引起的尿路、呼吸道、软组织感染具有同样的抗菌效果[10-11]。Bataineh等[12]研究2批头孢氨苄胶囊在健康志愿者体内的药代动力学和生物等效性发现,2批胶囊在药代动力学上有显著差异,不可相互替代;Yin等[13]对头孢氨苄胃漂浮片进行体内外评价,结果表明胃漂浮片可延长药物在主要吸收部位的停留时间,从而提高生物利用度;Prados等[14]研究头孢氨苄悬浮液在犬体内的药代动力学发现,该悬浮液在早上和晚上10:00饲喂所得的药代动力学差异较小,并建议给药间隔为12 h。目前,对头孢氨苄胶囊、悬浮液等剂型的报道相对较多,而对头孢氨苄片的药代动力学报道较少,但头孢氨苄片具有易饲喂、吸收迅速且生物利用度高等优点[15],关于头孢氨苄的药代动力学研究主要采用高效液相色谱(HPLC)和液相色谱串联质谱(LC-MS/MS)方法[16-20],HPLC流动相一般较复杂,其色谱柱长度比超高效液相色谱串联质谱(UPLC-MS/MS)的长,导致同一样品消耗时间更长,UPLC-MS/MS具有检测时间短、精度高、分离度好等优点。本试验旨在建立头孢氨苄的UPLC-MS/MS方法,获得药代动力学参数,以研究中国生产的受试制剂头孢氨苄片(Trolevis®300)和法国生产的参比制剂(Rilexine®300)对比格犬口服给药后的生物等效性,探讨2种制剂是否具有相似的作用,在临床上是否可相互替代。
1 材料与方法
1.1 材料
1.1.1 药品与试剂 受试制剂:Trolevis®300头孢氨苄片购自上海汉维生物医药科技有限公司,300 mg/片;参比制剂:Rilexine®300头孢氨苄片购自维克公司,300 mg/片;标准品:头孢氨苄标准品购自中国兽医药品监察所,纯度≥94.4%;乙腈、甲醇、甲酸均为质谱纯,均购自赛默飞世尔科技有限公司;超纯水由Milli-Q超纯水仪制备,符合GB/T6682一级用水规定。
1.1.2 主要仪器 超高效液相色谱-串联质谱仪(配电喷雾离子源)、色谱柱(BEH C18(2.1 mm×100 mm,1.7 μm))均购自Waters公司;分析天平(ES225SM-DR,感量0.00001 g)购自Precisa公司;天平(BS2202S,感量0.01 g)购自Sartorius公司;高速冷冻离心机(Hettich,MIKRO22R);涡旋混合器(HQ-60-Ⅱ)购自北京北方同正生物技术发展有限公司。
1.1.3 试验动物 22只健康成年比格犬(1~2岁),雌雄各半,体重为9.0~11.0 kg,购自北京远大星火医药科技有限公司。研究开始前,所有程序都经过中国农业大学机构动物护理和使用委员会的审查和批准(63303-19-E-001)。
1.2 给药方案及血样采集
试验开始前,将犬在试验犬笼中适应性饲养10 d。给药前对每只犬称重,且在给药前16 h和给药后8 h禁食。 22只犬随机分为2组,A组和B组,每组各11只,该试验采用单剂量、双周期、双序列交叉设计给药,第1周期A组犬以30 mg/kg BW口服Rilexine®300(参比制剂),B组犬以30 mg/kg BW口服Trolevis®300(受试制剂);第2周期A组犬以30 mg/kg BW口服Trolevis®300(受试制剂),B组犬以30 mg/kg BW口服Rilexine®300(参比制剂)。两阶段给药间隔期为7 d。
于给药前(0 h)及给药后0.5、1、1.5、2、2.5、3、4、6、8、12、17和24 h采血。每次从臂头静脉采集2 mL血样至含有肝素锂的采血管中,6 000 r/min离心5 min,取血浆层,平均分为2份,置于标记好的试管中,-20 ℃保存待用,在21 d内进行分析。
1.3 色谱条件
流动相:0.1%甲酸水溶液;0.1%甲酸-乙腈溶液。
超高效液相色谱仪:Waters Acquity UPLC;色谱柱:BEH C18(2.1 mm×100 mm,1.7 μm);流速:0.225 mL/min;柱温:25 ℃;进样量:5 μL(表1)。
1.4 质谱条件
质谱仪:Waters Quattro Premier;离子源:电喷雾离子源;扫描方式:正离子扫描;检测方式:多反应监测;离子源温度:130 ℃;脱溶剂温度:350 ℃;毛细管电压:3.0 kV;脱溶剂气流速:850 L/h;Q1、Q3均为单位分辨率(表2)。
1.5 样品处理
取200 μL血浆,加20 μL甲醇,涡动10 s。加入300 μL乙腈-甲醇(1∶1),涡动2 min。4 ℃、12 000 r/min离心20 min,取上清200 μL,加入200 μL含有0.1%甲酸的乙腈-水溶液(1∶9),涡动10 s,12 000 r/min离心10 min,取上清进行UPLC-MS/MS分析。
1.6 方法学验证
1.6.1 特异性 分析空白犬血浆(n=20),观察在药峰出现的区域是否有干扰信号。
1.6.2 标准曲线 分别设置6个不同浓度的基质添加标准工作液,依次为100、200、500、1 000、2 000和5 000 ng/mL,依据设定浓度加入标准溶液,以所得峰面积为纵坐标,以相应的浓度为横坐标绘制基质标准曲线。
1.6.3 检测限与定量限 本试验中采用信噪比法分别以3倍信噪比和10倍信噪比作为检测限和定量限。
1.6.4 准确度与精密度 通过添加回收试验验证方法的准确度与精密度,分别用回收率和变异系数表示准确度和精密度。选择以最低定量限及低、中、高(200、1 000和4 000 ng/mL) 4个浓度进行添加回收。每个浓度6个平行,持续3 d,分别计算回收率、日内变异系数和日间变异系数。
1.6.5 稳定性试验 分别添加200、1 000和4 000 ng/mL头孢氨苄标准品于血浆中混匀,每个浓度设置3个平行,分别按照下面的操作进行稳定性试验。
1.6.5.1 冻融稳定性 将混匀的样品置于-20 ℃冰箱中反复冻融3次,与新鲜添加的血浆样品同时进行检测,检测待测物在冻融过程中的稳定性。
1.6.5.2 室温稳定性 将混匀的样品置于室温12 h后与新鲜添加的血浆样品同时进行检测,分析样品在室温的稳定性。
1.6.5.3 前处理后稳定性 将混匀的样品进行前处理,方法同1.5,分别在前处理结束后0和8 h检测样品,分析前处理后待测药物的稳定性。
1.6.5.4 在血浆中的稳定性 将混匀的样品分别在第0和40天进行前处理检测,方法同1.5,分析待测药物在血浆中的稳定性。
1.6.6 基质效应考察 取适量空白血浆样品,以1∶6体积比加入乙腈-甲醇(1∶1)沉淀蛋白,涡旋1 min后,4 ℃、12 000 r/min离心20 min,取上清液200 μL,加入待测化合物系列质控样品工作液20 μL,制备低、中、高3个浓度(200、1 000和4 000 ng/mL)的上清液样品,待前处理后,取上清液进行UPLC-MS/MS分析。每一浓度进行6个重复样本分析。
取200 μL纯净水代替空白血浆样品,加入待测化合物系列质控样品工作液20 μL,制备低、中、高 3个浓度(200、1 000和4 000 ng/mL)的参照溶液样品,待前处理后,取上清液进行UPLC-MS/MS分析。每一浓度进行6个重复样本分析。以上清液样品的峰面积与参照溶液的峰面积均值的比值计算基质效应。
1.7 数据分析
数据分析和方法验证均符合《生物分析方法验证指南》[21]。使用WinNonlinTM8.1 软件中的非房室模型进行分析,计算血浆药代动力学参数消除半衰期(T1/2)、达峰时间(Tmax)、达峰浓度(Cmax)、血药浓度-时间曲线下面积(AUC0-t)等,并计算受试制剂与参比制剂Cmax、AUC0-t、AUC0-∞几何均数的比值以判断受试制剂与参比制剂是否等效。根据药代动力学结果计算相对生物利用度(F)。
F=(AUCT·DR)/(AUCR·DT)×100%
式中,AUCT,受试制剂的曲线下面积;DR,参比制剂的给药剂量;AUCR,参比制剂的曲线下面积;DT,受试制剂的给药剂量。
2 结 果
2.1 方法学试验结果
2.1.1 特异性 由图1可知,在分析物的保留时间3.07 min附近未检出影响头孢氨苄的干扰峰,不存在明显的内源性物质的干扰,说明该方法的特异性良好。
2.1.2 标准曲线 由图2可知,头孢氨苄的血浆药物浓度在100~5 000 ng/mL浓度范围内方法的线性关系良好,相关系数(R2)≥0.99。以峰面积为纵坐标,药物浓度为横坐标,标准曲线方程为:y=10.6828x-176.481。
2.1.3 检测限和定量限 本试验分别以3倍信噪比和10倍信噪比作为检测限和定量限。 6个平行样品测出检测限为50 ng/mL,定量限为100 ng/mL。
2.1.4 准确度和精密度 血浆中头孢氨苄UPLC-MS/MS测定结果显示,空白血浆中头孢氨苄添加浓度为100、200、1 000和4 000 ng/mL时平均回收率为92.44%~111.29%,回收率稳定;空白血浆添加样品在100~5 000 ng/mL范围内,日内变异系数均≤10.35%,日间变异系数均≤10.05%,精密度良好(表3)。
2.1.5 稳定性试验结果 分别添加200、1 000和4 000 ng/mL 3个不同浓度头孢氨苄标准品的血浆样品在前处理后、室温12 h后、血浆中40 d后及-20 ℃反复冻融3次的过程中待测药物的响应值的变异系数均<20%。
2.1.6 基质效应 基质效应考察结果显示,头孢氨苄在200、1 000和4 000 ng/mL 3个血浆浓度样品中检测的基质效应变异系数均≤3.63%,满足≤15%的要求,故此分析方法的基质效应可忽略不计。
2.2 血药浓度及药代动力学特征
犬以30 mg/kg BW单次口服头孢氨苄片参比制剂和受试制剂后,不同时间测得的受试制剂与参比制剂对应的平均血药浓度-时间曲线见图3。由图3可知,受试制剂与参比制剂的峰浓度分别为26.82和28.09 μg/mL,而两者达峰时间分别为2.70和1.77 h,均较接近,且两条曲线也较吻合。采用WinNonlinTM8.1软件对药代动力学参数进行分析,结果显示,受试制剂与参比制剂的AUC0-t分别为(116.34±36.30) μg·h/mL和(121.81±25.80) μg·h/mL,其他药代动力学参数同AUC0-t,受试制剂与参比制剂的差异较小(表4)。根据公式计算可得头孢氨苄片受试制剂的相对生物利用度为99.78%。

表4 头孢氨苄2种制剂的药代动力学参数(以实际给药剂量计算)
2.3 生物等效性评价
WinNonlinTM8.1软件分析显示,受试犬单次口服30 mg/kg BW头孢氨苄片,受试制剂与参比制剂Cmax、AUC0-t和AUC0-∞几何均数的比值分别为99.51%、99.27%和99.30%,其90% CI均在80.00%~125.00%之间(表5),表明头孢氨苄片受试制剂和参比制剂具有生物等效性。
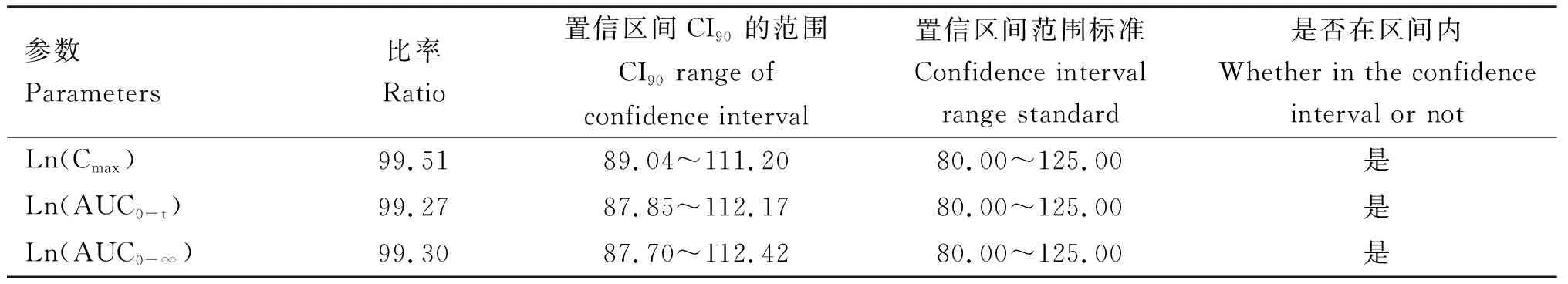
表5 头孢氨苄2种制剂生物等效性分析参数(以实际给药剂量计算)
3 讨 论
头孢氨苄的药代动力学研究主要采用HPLC和LC-MS/MS方法,Papich等[16]采用HPLC方法研究犬口服头孢泊肟酯和头孢氨苄的药代动力学、蛋白质结合和组织分布,其色谱柱规格为4.6 mm×150 mm,保留时间为7.2~7.4 min;do Nascimento等[19]采用LC-UV-MS/MS方法研究氨苄青霉素和头孢氨苄在水溶液和人血浆中的短期稳定性,色谱柱规格为4.6 mm×250 mm,运行时间为18 min,保留时间为15.4 min;Qi等[22]采用HPLC方法研究犬血浆中头孢氨苄和甲氧苄啶的药代动力学,色谱柱规格为4.6 mm×250 mm,运行时间为16 min,保留时间为5.3 min。 本试验建立了犬血浆中头孢氨苄的UPLC-MS/MS方法,该方法灵敏度和准确度较高,色谱柱规格为2.1 mm×100 mm,运行时间为5 min,保留时间为3.07 min。上述文献中使用的色谱柱均比本试验所使用的色谱柱更长,较长的色谱柱导致流动相消耗增加,单个样品仪器运行时间及头孢氨苄保留时间延长,仪器被污染的几率增加。此外,HPLC的流动相一般较复杂,加入的试剂杂多,Hussein等[20]用HPLC快速方法分析测定人血浆中头孢氨苄水平和稳定性,其流动相由等体积的0.01 mol/L十六烷基三甲基溴化铵和0.01 mol/L磷酸氢二钾-乙腈-三乙胺(60∶40∶0.001)组成;Qi等[22]相关研究中流动相由2 mol/L的甲酸钠缓冲液(pH 3.5)-甲醇-乙腈(22∶7∶7)组成。在本试验中,流动相为0.1%甲酸水溶液和0.1%甲酸-乙腈溶液,流动相所含溶液较常见且配制简单,上述文献中的流动相配制更复杂,且加入的试剂较多,对环境的不利影响更大。 除此之外,在Hussein等[20]相关研究中头孢氨苄定量限为500 ng/mL,Qi等[22]相关研究中头孢氨苄定量限为1 000 ng/mL,在Albarellos等[17]研究中头孢氨苄定量限为390 ng/mL,而本试验建立的犬血浆中头孢氨苄检测方法定量限为100 ng/mL,比上述文献定量限更低,能更全面满足头孢氨苄在犬体内的药代动力学研究。
Prados等[14]对犬口服5%头孢氨苄悬浮液(25 mg/kg)的时间药代动力学研究结果显示,早上10:00和晚上10:00喂药Cmax分别为(18.77±2.80)和(14.52±2.70) μg/mL,Prados等[23]关于甲氧氯普胺改善犬口服头孢氨苄的药代动力学研究结果显示,犬单次口服5%的头孢氨苄悬浮液(25 mg/kg)和静脉注射盐酸甲氧氯普胺(0.5 mg/kg)20 min后再口服5%的头孢氨苄悬浮液(25 mg/kg),早上10:00和晚上10:00喂药其Cmax分别为(18.77±2.83)和(21.88±0.85) μg/mL,可知与甲氧氯普胺联合使用改变了头孢氨苄在体内的药代动力过程,增加了头孢氨苄的 Cmax。Yin等[13]对头孢氨苄胃浮片的研究中,犬单次口服500 mg头孢氨苄胃漂浮片,Cmax为(22.87±4.11) μg/mL。不同头孢氨苄制剂在体内的吸收速度和程度都会有一定的差异。在本试验中,受试制剂在(2.70±4.68) h达到Cmax(26.82±7.94) μg/mL,此制剂吸收较迅速。与胃漂浮片相比,虽然给药剂量更小,但本试验中头孢氨苄片受试制剂(Trolevis®300)的Cmax较高,说明其吸收程度较高,在血液中的浓度较高,药效相对较强。Prados等[14]研究结果显示,头孢氨苄悬浮液的T1/2分别为(1.79±0.20)和(2.69±0.90) h。在本试验中,受试制剂的T1/2为(3.12±1.05) h,比上述研究中的T1/2更长,表明本试验中头孢氨苄片受试制剂(Trolevis®300)在体内的消除率更低,治疗效果持续时间更长,这意味着可延长连续给药的间隔。与上述文献中的头孢氨苄制剂相比,头孢氨苄片(Trolevis®300)具有吸收更快、消除率更低等优点,优于上述文献中的头孢氨苄制剂。在本试验中,参比制剂在(1.77±0.55) h达到Cmax(28.09±5.09) μg/mL,T1/2为(3.39±1.43) h。犬口服头孢氨苄受试制剂和参比制剂后,Ln(Cmax)、Ln(AUC0-t)和Ln(AUC0-∞)比率分别为99.51%、99.27%和99.30%,根据生物等效性研究技术指导原则[24],此受试制剂与参比制剂具有生物等效性,且具有临床应用价值。
4 结 论
本试验成功建立了头孢氨苄在犬血浆中的UPLC-MS/MS检测方法,该方法线性、准确度、精密度和灵敏度均符合相关要求,且特异性高、稳定性良好。药代动力学过程分析结果显示,头孢氨苄片受试制剂在犬体内具有吸收快、消除缓慢等特点,且头孢氨苄片受试制剂和参比制剂具有生物等效性,据此,可认为2种制剂具有相似的临床疗效和临床安全性,均可用于临床上犬相关疾病的治疗。
