中枢神经系统瘤样脱髓鞘病的发病机制与临床研究进展
2022-02-14李欣囡武霞刘建国
李欣囡 武霞 刘建国
中枢神经系统(CNS)特发性炎性脱髓鞘疾病包括多发性硬化(multiple sclerosis,MS)、视神经脊髓炎谱系疾病(NMOSD)、急性播散性脑脊髓炎(ADEM)及其他脱髓鞘疾病。CNS瘤样脱髓鞘病变(tumefactive demyelinating lesions,TDLs)为一种特殊类型的炎性脱髓鞘病变,其发病机制复杂,影像学以占位效应、水肿及开环强化为特征,加之临床表现缺乏特异性,故常与CNS肿瘤相混淆,故此得名[1]。随着近年来影像学技术的不断发展,国内外针对TDLs的病例报道也逐年增多,主要聚焦于对该病影像学及发病机制的探索。现就TDLs的发病机制、临床表现及影像学特征等研究进展进行综述。
1 流行病学特征
TDLs可发生在MS、NMOSD等复发性炎性脱髓鞘病患者中,也可作为临床孤立综合征首次发生,还可与ADEM等[2]其他炎性脱髓鞘病重叠。TDLs的发病率和患病率目前尚缺乏流行病学数据。Algahtani等[3]认为TDLs是一种特殊类型的MS,其发生率约为MS的(1~3)/1000,男女比例约为1∶3,以20~30岁多见。国内研究显示其平均发病年龄约为35岁[4]。TDLs多以急性及亚急性起病,少数患者发病前有疫苗接种史或感冒史[4]。
2 发病机制
2.1 TDLs与体液免疫有关TDLs的发病机制尚不确切,有学者认为其是一种特殊类型的MS,称之为肿瘤样MS[5](图1)。研究发现,部分MS可以TDLs形式复发,而TDLs也可向MS转化[3,6],故TDLs发病机制曾被认为与MS相似,以细胞免疫为主,但随着MS患者脑脊液(CSF)中寡克隆区带(oligoclonal bands,OB)的发现及免疫球蛋白水平升高,提示体液免疫也参与其中。2004年Serafini等[7]采用免疫组化方法在进展性MS患者的脑膜中观察到富含B细胞的淋巴滤泡样结构,异位淋巴滤泡可分泌促炎介质,募集炎性细胞,参与体液免疫,促进MS病程进展,这也为MS患者的治疗提供了新依据。近年来,大量临床试验表明应用抗CD20抗体去除B细胞疗法可控制MS疾病活动,抑制疾病复发[8]。TDLs病理以血管周围套袖样淋巴细胞(CD3+T、CD4+T、CD8+T)浸润为特点[9],提示细胞免疫参与其发病;此外,与MS相似,部分TDLs患者CSF可见OB[10],对血浆置换反应良好[11],亦提示TDLs发病与B细胞介导机制密切相关[3]。综上,细胞免疫与体液免疫可能共同参与TDLs发病。
近年来发现,部分TDLs与抗髓鞘少突胶质细胞糖蛋白免疫球蛋白G抗体(anti-myelin oligodendrocyte glycoprotein-IgG,MOG-IgG)相关疾病(MOG-IgG associated disorders,MOGAD)重叠(图2),该病临床常表现为视神经炎、脑干脑炎、脑膜脑炎、脊髓炎,也可表现为TDLs[12-13]。Ataka等[14]报道1例35岁男性患者,以视野缺损为首发症状,疑似脑肿瘤,血清抗MOG-IgG阳性,免疫组化染色发现病灶中MOG蛋白丢失及包含MOG阳性降解产物的泡沫状巨噬细胞,最终诊断为MOGAD,证实其发病与体液免疫相关。2004年,Lennon教授团队[15]在NMOSD患者血清中发现了水通道蛋白4(aquaporin-4,AQP4)抗体,使NMOSD的发病机制更为明晰,同时,AQP4抗体也被公认为诊断NMOSD的特异性指标。研究发现[16],部分TDLs患者血清可检测到抗AQP4抗体,而抗AQP4抗体阴性的NMOSD确诊病例(包括抗MOG-IgG阳性)也可出现颅内TDLs[17],故TDLs还可与NMOSD重叠(图3),提示体液免疫参与其中。
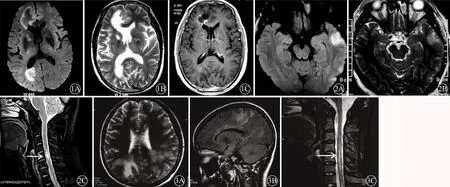
注:TDLs:瘤样脱髓鞘病变;CSF-OB:脑脊液寡克隆区带;A:轴位DWI检查示右侧半球多发高信号占位样病灶;B:轴位T2WI检查示右侧半球多发长T2异常信号;C:增强扫描可见强化,占位效应明显
2.2 TDLs与疾病修饰治疗药物随着疾病修饰治疗(disease modifying therapy,DMT)药物在临床的推广,近期有文献报道TDLs的发生与MS患者停用DMT药物相关。另外亦有少数复发-缓解型MS(relapsing-remitting MS,RRMS)患者反复使用DMT药物(如芬戈莫德)后出现TDLs[18-20]。推测其病理生理学机制主要有3种:(1)芬戈莫德可引起淋巴细胞亚群迁移,触发免疫病理机制。Pilz等[21]研究发现MS患者经芬戈莫德治疗后其免疫细胞组成发生变化,并认为芬戈莫德介导趋化性细胞因子受体(chemokine receptor,CCR)-7-T 细胞高分化,且经治疗后外周血效应子CD45R0-CCR7-的CD8+T细胞明显减少,而CSF中该表型免疫细胞约为外周血中的2倍,由此推测,芬戈莫德介导该淋巴细胞亚群由外周向中枢进行了迁移,并表达穿孔素和干扰素-G,发挥细胞毒性作用,导致中枢神经系统损伤。(2)芬戈莫德是鞘氨醇1-磷酸(S1P)的结构类似物,其活性代谢物芬戈莫德磷酸酯与S1P受体1、3、4、5具有高度亲和力。S1P1受体可增加内皮细胞间及其与周细胞之间的紧密度,促进血-脑屏障的完整性。芬戈莫德磷酸酯通过结合S1P1受体,发挥拮抗剂作用,从而增加血-视网膜屏障与血-脑屏障之间的通透性,进而导致黄斑水肿[22]与TDLs病灶水肿[23]。(3)由于DMT药物对T细胞的抑制,B淋巴细胞代偿性过度活化,激活巨噬细胞,从而导致血管源性水肿,进而致TDLs[18-19],进一步证实B细胞免疫参与了MS和TDLs的发病与复发机制[10-11]。那他珠单抗通过抑制T细胞免疫发挥抗炎作用,而关于该药在治疗MS中发生TDLs的报道并不少见[24]。此外,在注射那他珠单抗后,部分MS患者体内可检测到抗那他珠单抗抗体,故也不排除因抗体的产生导致药物抵抗,甚至药物无效,因炎症进展而发生 TDLs,但目前尚未在MS合并TDLs患者体内发现那他珠单抗抗体[25]。利妥昔单抗治疗MS发生TDLs亦有报道[26],但Dunn等[27]对于部分MS患者使用利妥昔单抗疗效不佳与抗利妥昔单抗抗体产生的相关性持审慎态度。
2.3 TDLs与高凝状态近年来,有学者提出免疫系统疾病与高凝状态密切相关的观点[28],认为凝血系统也是先天性免疫系统的一部分,TDLs可继发于妊娠或生产后的血栓前状态。Plantone等[28]报道了2例与妊娠相关的TDLs患者,并随访4年左右。其中1例发生在妊娠早期,由于蛋白S缺乏继发下肢深静脉血栓;另1例合并MS与类风湿关节炎,TDLs在生产后复发,激活凝血机制,同时也激活了先天性免疫系统,活化细胞免疫,介导发生TDLs。值得注意的是,妊娠后期,机体细胞免疫与体液免疫状态有所不同,为减少对胎儿的免疫攻击,促进了代表细胞免疫的Th1向反映体液免疫的Th2转化,抑制了细胞免疫,而体液免疫相对增强,在此阶段,MS及类风湿关节炎等细胞免疫相关疾病发作减少,但可能会加重系统性红斑狼疮等体液免疫相关疾病[28]。
3 临床表现
TDLs病灶大小及受累部位存在个体差异,其临床症候缺乏特异性。据报道[29-30],以头痛首发最为多见,可出现运动障碍、认知障碍、感觉障碍等,但鲜有痫性发作的报道,这有别于脑胶质瘤。一般来说,以影像学表现重临床表现轻为特点的颅内占位,更支持脑肿瘤,特别是脑胶质瘤,但也有少数TDLs症候轻微或隐匿起病,仅通过影像学检查才被发现。Ekmekci等[31]报道了1例18岁青年患者,确诊特发性震颤,头颅MRI检查意外发现左侧额叶TDL,伴病灶周围水肿及环型强化,右侧视觉诱发电位检查显示P100延长,未予治疗,1个月后,原病灶缩小,但对侧出现新发病灶,仍未治疗,1年后MRI示上述病灶均明显消退。该例患者无TDLs相关临床症候,且未经治疗,病灶缩小,被称之为静默性TDLs[31],同时也符合放射学孤立综合征(radiologically isolated syndrome,RIS)[32],值得注意的是,临床诊断RIS,要避免忽略轻度认知损害症候。
4 影像学表现
4.1 MRI头颅MRI敏感度较高,常用来评估病灶性质,TDLs病灶为长T1、长T2信号,FLAIR像呈高信号。弥散加权成像(DWI)多为高信号,提示病灶处于急性或亚急性期,但仍有28.6%处于慢性期的TDLs也可表现为DWI高信号,而表观弥散系数多为高信号,视为T2透过效应,其成像机制有别于急性期与亚急性期。侧脑室枕角附近病灶出现DWI“反C征”或“开环征”高信号,对诊断TDLs具有提示意义[4]。增强MRI对TDLs的诊断鉴别意义更为显著,95%~100%的TDLs在急性期与亚急性期病灶可见不同形态强化,并受病程进展及糖皮质激素治疗等因素影响,如急性期(发病2周内)结节样或片状强化多见,亚急性期(发病3~6周)环样强化多见,慢性期(发病7周后)点灶样或浅淡的环样强化多见[33],其中开环强化开口常指向灰质,高度提示TDLs,敏感性为71.4%,特异性为98%[34]。值得注意的是,若发现垂直于侧脑室的扩张静脉影或“梳齿征”更支持TDLs诊断[4]。
另外,病灶中央静脉征也对TDLs的鉴别诊断具有显著临床价值[29]。
4.2 正电子发射电子计算机断层扫描(PET-CT)PET-CT可通过评估病灶代谢程度来帮助定性。18F-FDG PET检查常为低代谢,值得注意的是,急性期TDLs可表现为高代谢,但其程度仅略高于正常皮层,低于高度恶性肿瘤病变[35]。另外,因皮层对18F-FDG摄取高,部分低度恶性脑肿瘤对该示踪剂的摄取有时等于甚至低于正常皮层,此时PET-CT不易鉴别TDLs与脑肿瘤。近年有报道,18F-氟代乙酯-L-酪氨酸(FET)可弥补此不足[36],因FET是酪氨酸的类似物,其摄取反映了氨基酸的转运过程,故无论肿瘤的恶性程度高低,对氨基酸的摄取均高于正常脑组织。另外,对于一些在18F-FDG表现为高代谢的炎性病灶,在18F-FET检查中可为低代谢,有助于TDLs与脑肿瘤的鉴别。一项回顾性研究显示,与高度恶性肿瘤相比,TDLs的18F-FET最大标准化摄取值、病变示踪剂摄取的本底比值均较低[36],有助于鉴别急性期TDLs与低度恶性肿瘤。
5 鉴别诊断
TDLs除应与中枢神经系统肿瘤、脑脓肿、CNS血管炎等疾病鉴别外,还应与部分少见的CNS免疫介导疾病相鉴别。2016年Fang等[37]首次报道自身免疫性胶质纤维酸性蛋白(GFAP)星形细胞病,也可表现为颅内占位病变,主要累及脑、脑膜、脊髓及视神经,临床以发热、头痛、脑病、脊髓炎、视力障碍等为主,血和CSF中可检出特异性GFAP抗体[37]。另外,脑淀粉样血管病相关炎症为脑淀粉样血管病的一种罕见类型,多发生在40岁以后,并以认知功能障碍、癫痫及头痛起病多见,病变以脑白质受累为主,其特点为SWI可见皮层或皮层下多发微出血灶。
近年来,有学者提出中枢和周围神经系统脱髓鞘疾病(combined central and peripheral demyelination,CCPD)的概念,即同时或先后出现中枢和周围神经脱髓鞘病变,以抗神经束蛋白155(NF155)抗体阳性报道居多,还包括NF186抗体阳性及其他相关疾病,约25%的CCPD患者出现颅内TDLs[38]。Ueno等[38]报道了1例因四肢无力和感觉障碍被诊断为慢性炎性脱髓鞘性多发性神经根神经病的患者,静脉注射免疫球蛋白3个月后,四肢无力改善,但出现左眼视力下降,左侧面部感觉障碍,头颅MRI显示左侧视神经异常强化,左侧桥臂TDLs,伴开环强化,诊断CCPD,经糖皮质激素冲击及血浆置换治疗后好转。此类病例国内报道较少,且临床易被忽略,对于确诊TDLs伴周围神经损害体征的患者,需及时完善肌电图检查。
6 预后
TDLs多为单时相病程,总体预后较好,复发较为少见,部分TDLs患者可转化为MS、ADEM等[4],而合并抗AQP4抗体或抗MOG-IgG阳性的TDLs患者,复发率相对较高。刘建国等[5]对60例TDLs患者进行电话临床随访,约25%的患者复发,其中仅包括1例AQP4阳性的NMOSD。2018年,Balloy等[39]通过对87例TDLs患者进行随访研究显示,TDLs发病8年后平均扩展残疾状况评分(EDSS)为2.4分,10年以上为3.75分,而MS患者8年平均EDSS为4分。
综上所述,TDLs作为特殊类型的炎性脱髓鞘病,影像学有其特点,从预后来看,复发率显著低于MS、NMOSD等传统脱髓鞘疾病,但病程中可与其他脱髓鞘疾病有重叠或交叉,发病机制与体液免疫及细胞免疫密切相关,故TDLs是否为独立的疾病实体,目前尚待研究。尽管病理是诊断TDLs的“金标准”,但限于对设备及技术的要求较高,进行详细的临床影像检查有助于TDLs的诊断;另外,对于病理或临床影像不典型而诊断困难的患者,可试用糖皮质激素治疗并观察疗效,长期的临床影像随访更为重要。
