LRRK2干扰对MPP+诱导PD细胞模型线粒体功能的影响
2022-02-14罗宁王春玲蒙冰周欣梅冯文勇李昌海文晓东
罗宁 王春玲 蒙冰 周欣梅 冯文勇 李昌海 文晓东
帕金森病(Parkinson disease,PD)是神经科常见的慢性进行性神经退行性疾病,主要表现为行动迟缓以及肢体僵直、震颤等典型症状,其发病主要由黑质致密部多巴胺能神经元变性引起[1-2]。多种机制共同作用参与PD的发病,其中富亮氨酸重复激酶2(leucine-rich repeat kinase 2,LRRK2)基因突变是引起PD最常见的原因之一[3]。LRRK2依赖性神经退行性病变与囊泡运输、自噬、线粒体稳态和钙稳态等密切相关[4]。研究证实,线粒体是钙-钙调蛋白依赖性蛋白激酶2(CaMKK-β)/腺苷酸激活蛋白激酶(AMPK)信号通路发挥神经保护作用的主要细胞器,线粒体功能障碍常会引起PD等神经退行性疾病,是PD发病的关键机制之一[5-6]。目前有关LRRK2与线粒体功能和CaMKK-β/AMPK通路之间的作用关系尚不清楚。本研究通过体外建立1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridine ion,MPP+)诱导的PD细胞模型,探讨LRRK2干扰对线粒体功能和CaMKK-β/AMPK通路的影响,为深入了解PD的发病机制及寻找新的治疗靶点提供参考。
1 材料和方法
1.1 细胞SH-SY5Y细胞来源于中国科学院上海细胞库,由武汉华联科生物技术有限公司实验室保种。
1.2 主要试剂DMEM/F12(SH30023.01)购自Hyclone公司;胎牛血清(10270-106)、Opti-MEM(31985-062)购自Gibco公司;IPA(强)组织细胞快速裂解液(R0010)、BCA蛋白浓度测定试剂盒(PC0020)购自Solarbio公司;ATP含量检测试剂盒(A095-1-1)、线粒体呼吸链复合物Ι(Complex Ι)活性测试试剂盒(A089-1-1)购自南京建成生物工程研究所;MPP+碘化物(D048)购自Sigma公司;Lipofectamine®RNAiMAX(13778030)购自Invitrogen公司;Trizol(15596026)购自Ambion;SYBR FAST qPCR Master Mix(KM4101)购自KAPA Biosystems;Oligo(dT)18 Primer(3806)、PrimeScript Ⅱ Rtase(2690A)、Recombinant Rnase Inhibitor(2313A)、10 mmol/L dNTP Mix(PC2200)购自Takara;DNase/RNase-Free Water(PC2200)购自Solarbio;线粒体膜电位检测试剂盒(PC2200)购自Beyotime;兔源LRRK2多克隆抗体(PAB44040)、兔源AMPK多克隆抗体(PAB30970)、兔源p-AMPK多克隆抗体(PA5-37821)、兔源GAPDH多克隆抗体(PAB36269)、二抗羊抗兔IgG(SAB43714)均购自Bioswamp;兔源CAMKK-β多克隆抗体(ab168818)为Abcam公司产品。
1.3 方法
1.3.1SH-SY5Y细胞复苏及传代培养:将冻存的SH-SY5Y细胞从液氮罐中取出后,移至37℃水浴锅中,使细胞迅速融化。待冻存液完全融化后,将细胞悬液吸至离心管中,加入4 mL完全培养基(100 mL完全培养液含43.5 mL MEM、43.5 mL F12、10 mL FBS、1 mL Gluta-max、1 mL Sodium pyruvate、1 mL NEAA),以4℃、400g离心3 min,弃上清,细胞重新悬浮于1 mL培养基中,转移至培养瓶中,加入4 mL完全培养基,置于37℃,5%(体积分数)CO2培养箱内培养。倒置显微镜观察细胞形态,按1∶2~1∶4进行传代培养。
1.3.2MPP+诱导PD细胞模型:收集细胞,调整细胞悬液水平至每孔3×103个细胞,每孔100 μL,置于37℃、5%(体积分数)CO2培养箱中培养过夜使细胞贴壁,分别用125、250、500、1000、2000 μmol/L MPP+处理SH-SY5Y细胞24、48、72 h,每组设3个复孔,并正常对照组。采用CCK-8法检测细胞活力,结果显示SH-SY5Y细胞经MPP+处理后存活率降低并呈剂量依赖性,最终确定采用2000 μmol/L MPP+处理48 h用于PD细胞模型的构建。
1.3.3siRNA-LRRK2的瞬时转染及转染效率鉴定:根据LRRK2基因序列设计3个siRNA序列和NC序列,交由广州市锐博生物科技有限公司合成。以未转染的PD细胞模型作为对照,严格按脂质体转染方法说明书操作,分别将siRNA-LRRK2-1(GCATCATGGTTGAATGCTT)、 siRNA-LRRK2-2(GTACTCTCCTGGTCATCAA)、siRNA-LRRK2-3 (GCAACTGACTGAATTTGTT) 转染至构建好的PD细胞模型,设置3个复孔,将转染后的细胞板置于37℃、5%(体积分数)CO2培养箱培养4 h后,更换新鲜培养基培养24 h。24 h后收集细胞添加Trizol试剂提取总RNA,反转录获得cDNA,将制备好的cDNA进行定量PCR扩增,LRRK2上游引物序列为:5′-CCAATCAAGCAAAGGAGGGA-3′,下游引物序列为:5′-AAAGGACCAAGCCAAGAAGG-3′;内参GAPDH上游引物序列为:5′-GGGAAACTGTGGCGTGAT-3′,下游引物序列为:5′-GAGTGGGTGTCGCTGTTGA-3′,各设置3个重复。反应条件:95℃预变性3 min,95℃变性5 s、56℃退火10 s、72℃延伸25 s,共40个循环,同时添加溶解曲线。LRRK2相对表达量采用2-△△CT法进行分析。
1.3.4线粒体膜电位检测:将细胞分成正常对照组、PD模型组、空载转染组(空载转染PD模型24 h)、siRNA转染组(siRNA-LRRK2转染PD模型24 h),每组设置3复孔,分别加入JC-1荧光探针,流式细胞仪检测线粒体膜电位,使用NovoCyte软件进行分析。
1.3.5ATP含量检测:收集“1.3.4”4组细胞,每组3个复孔,离心沉淀,并严格参照ATP含量测试试剂盒的说明书操作,加入裂解液裂解细胞,离心取上清用于测定,并根据下列公式计算细胞ATP含量:ATP含量=(样本吸光度值-对照吸光度值)÷(标准品吸光度值-空白吸光度值)×标准品浓度×样本稀释倍数÷样本蛋白浓度。
1.3.6Complex I活性检测:收集“1.3.4”4组细胞,每组3个复孔,严格参照Complex I活性测试试剂盒的说明书操作,将胞浆蛋白与线粒体蛋白分离,用酶标仪测定,获得样本总活性和样本非特异性活性,并按照下列公式计算细胞Complex I的活性。Complex I活性=样本总活性-样本非特异性活性。
1.3.7CaMKK-β/AMPK通路相关蛋白表达检测:收集“1.3.4”4组细胞,每组3个复孔,使用含有蛋白酶和磷酸酶抑制剂的裂解液充分裂解细胞并提取蛋白,用BCA试剂盒检测对蛋白进行定量分析,SDS-PAGE分离蛋白,转移至PVDF膜,分别加入兔源LRRK2抗体(1∶1000)、兔源AMPK抗体(1∶1000)、兔源p-AMPK抗体(1∶1000)、兔源GAPDH抗体(1∶1000)、兔源CAMKK-β抗体(1∶1000)孵育,再用羊抗兔IgG(1∶20000)孵育,ECL显影,检测细胞LRRK2、CaMKK-β、AMPK、p-AMPKα(Thr 172)的表达水平。
1.4 统计学处理采用SPSS 19.0统计软件进行分析,符合正态分布的计量资料以均数±标准差表示,多组间比较采用单因素方差分析(ANOVA),两两比较采用LSD法。以P<0.05为差异有统计学意义。
2 结果
2.1 转染siRNA-LRRK2对PD细胞模型LRRK2表达的影响
2.1.1qRT-PCR检测siRNA干扰效率:结果见图1。各组细胞LRRK2 mRNA表达水平比较有统计学差异(F=41.12,P<0.01)。与PD模型组比较,转染siRNA-LRRK2-1和siRNA-LRRK2-2后,MPP+诱导的PD细胞模型LRRK2 mRNA表达水平均下降(P<0.05),而转染siRNA-LRRK2-3和空载转染组LRRK2 mRNA表达水平均无统计学变化(P>0.05)。转染siRNA-LRRK2-1对LRRK2的干扰效果最好,用于后续实验。

注:PD:帕金森病,图2~6、表1同;LRRK2:富亮氨酸重复激酶2,图2~4同;aP<0.05

注:aP<0.05
2.1.2各组细胞LRRK2蛋白表达:结果见图2。
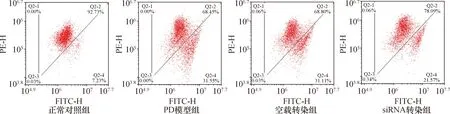
图 3 转染siRNA-LRRK2-1对PD模型细胞膜电位的影响(流式细胞术)
各组细胞LRRK2蛋白相对表达水平比较差异有统计学意义(F=888.08,P<0.01)。与正常对照组比较,PD模型组和空载转染组细胞LRRK2蛋白表达增加(P<0.05),与PD模型组比较,siRNA转染组LRRK2蛋白表达降低(P<0.05)。
2.2 LRRK2干扰对PD细胞模型线粒体功能的影响
2.2.1各组线粒体膜电位比较:各组细胞Q2-4区细胞比例的差异比较有统计学意义(F=794.77,P<0.01)。与正常对照组比较,PD模型组和空载转染组Q2-4区的细胞数均增加(P<0.05),表明线粒体膜电位下降;与PD模型组比较,siRNA转染组Q2-4区的细胞数减少(P<0.05),表明膜电位提升。结果见图3和图4。

注:aP<0.05
2.2.2各组细胞ATP含量和Complex I活性检测:结果见表1。与正常对照组比较,PD模型组和空载转染组ATP含量和Complex I活性均下降(P<0.05);与PD模型组比较,转染siRNA-LRRK2-1后ATP含量和Complex I活性均升高(P<0.05)。

表1 各组细胞ATP含量和Complex I
2.3 LRRK2干扰对PD细胞模型CaMKK-β/AMPK信号通路的影响各组细胞CaMKK-β (F=1027.07,P<0.01)、p-AMPKα(Thr 172) (F=828.95,P<0.01)、AMPK(F=953.30,P<0.01)蛋白表达比较差异有统计学意义。与正常对照组比较,PD模型组和空载转染组CaMKK-β、AMPK、p-AMPKα(Thr 172)蛋白表达水平增加(P<0.05);与PD模型组比较,siRNA转染组上述蛋白表达均降低(P<0.05)。结果见图5和图6。

注:CaMKK-β:钙-钙调蛋白依赖性蛋白激酶2;AMPK:腺苷酸激活蛋白激酶;p-AMPK:磷酸化的腺苷酸激活蛋白激酶;GAPDH:甘油醛-3-磷酸脱氢酶
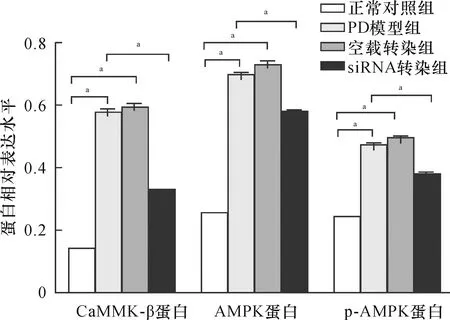
注:CaMKK-β:钙-钙调蛋白依赖性蛋白激酶2;AMPK:腺苷酸激活蛋白激酶;p-AMPK:磷酸化的腺苷酸激活蛋白激酶;GAPDH:甘油醛-3-磷酸脱氢酶;aP<0.05
3 讨论
线粒体稳态异常是PD发生发展的关键原因之一[5]。Complex I异常会抑制ATP的产生并导致线粒体功能受损[7],而线粒体功能障碍通常会引起PD等神经退行性疾病[6]。研究表明,在神经样分化细胞中,加入Complex I抑制剂鱼藤酮可诱导LRRK2在丝氨酸935p-(S935)位点磷酸化,并伴随细胞死亡[7]。MPP+与鱼藤酮均为Complex I抑制剂,多项研究证实MPP+可成功诱导PD细胞模型用于体外研究[8-9]。该结果显示,MPP+诱导的PD模型细胞中线粒体膜电位下降,Complex I活性显著下降,ATP含量减少,提示在PD发生过程中线粒体功能受到了影响。
线粒体是CaMKK-β/AMPK信号通路发挥神经保护作用的主要细胞器。AMPK是一种重要的能量代谢调节因子,因能量压力或者ATP减少而被激活[10],通过磷酸化多种蛋白质维持细胞内稳态[11]。CaMKK-β也是神经元功能和全身能量代谢的关键调节因子[12],在神经元中CaMKK-β是调控AMPK激活和磷酸化的关键激酶[13]。该研究结果显示,PD细胞模型中CaMKK-β/AMPK信号通路处于激活状态,CaMKK-β、AMPK、p-AMPKα(Thr 172)蛋白表达均显著增加,推测其原因可能与受损的线粒体产生的ATP减少有关,表明CaMKK-β/AMPK信号通路与线粒体稳态和PD的发生发展存在着密切的关系。
LRRK2基因参与调节PD发生过程中的线粒体稳态。已经有越来越多的证据表明LRRK2在线粒体功能中发挥作用,然而确切机制尚不清楚[4]。该研究通过转染siRNA干扰LRRK2的表达后发现,Complex I活性及ATP含量显著增加,受损的线粒体功能得到一定的恢复,表明LRRK2在调节线粒体功能障碍和维持线粒体功能方面具有重要作用。Tozzi等[12]研究发现抑制LRRK2的表达可导致多巴胺(DA)神经元损伤,降低脑内DA水平,其机制可能为通过下调CaMKK-β/AMPK信号通路中AMPK磷酸化水平,从而减弱其在脑内的神经元保护作用。该研究结果显示,PD模型细胞经干扰LRRK2后其CaMKK-β、AMPK、p-AMPKα(Thr 172)蛋白表达均降低,提示CaMKK-β/AMPK信号通路受到抑制。由此可见LRRK2对于PD发生过程中的线粒体功能发挥着重要的调节作用,且这种调节作用可能与CaMKK-β/AMPK通路相关。
综上所述,该研究结果显示MPP+诱导的PD细胞模型存在线粒体功能受损,而干扰LRRK2会使线粒体的功能得到恢复,CaMKK-β/AMPK信号通路与线粒体稳态和PD发生发展密切相关,而干扰LRRK2会抑制CaMKK-β/AMPK信号通路的激活,由此可见线粒体功能障碍是PD发生的重要原因之一,LRRK2在调节线粒体功能方面发挥着重要的作用,并可调节CaMKK-β/AMPK信号通路,这可能为PD发生机制研究及基于LRRK2的靶向药物开发提供了新的参考依据。
