TMEM230-A110T突变体对多巴胺能神经细胞自噬、增殖及凋亡的影响
2022-02-14杨百元李柯麓刘彬朱永云殷康福尹蔚芳任惠杨兴隆
杨百元 李柯麓 刘彬 朱永云 殷康福 尹蔚芳 任惠 杨兴隆
帕金森病(PD)是目前仅次于阿尔茨海默病的第二大最常见的神经变性综合征[1]。尽管目前对其病理生理学(包括遗传和生化原因)研究方面取得长足进步,但对其诊断仍缺乏准确性。因此,寻找敏感、可靠、特异性高的生物标志物,将对PD患者的临床管理和治疗具有重要意义。跨膜蛋白230(TMEM230)基因属于TMEM134/TMEM230蛋白质家族的多通道跨膜蛋白,其编码的蛋白定位于神经元中,可能参与突触囊泡的运输和再循环[2],且已被证实是一种具有路易病理和典型临床症状的常染色体显性PD的新型致病基因[3]。作者团队曾从中国西南地区的PD患者中筛查出TMEM230-A110T突变体,并推测其为可能为致病性突变体[4]。自噬是一种去除细胞内多余或有缺陷细胞成分的降解过程。研究发现:PD患者黑质中的多巴胺能神经元存在自噬变性[5];LRRK2 G2019S突变体的敲可入升高PD模型小鼠自噬相关蛋白LC3-Ⅱ水平[6];携带杂合性GBA L444P突变体的PD患者死后脑组织线粒体水平增加,线粒体氧化应激和自噬受损[7]。本研究通过探讨TMEM230-A110T突变体是否通过调控自噬参与PD的发生发展,旨在为PD的诊断和治疗提供参考。
1 材料和方法
1.1 细胞培养和分化人神经母细胞瘤SH-SY5Y细胞(武汉普诺赛生命科技有限公司)采用专用培养基置37℃,5% CO2(体积分数)培养箱中培养。采用0.25%(质量浓度)胰蛋白酶消化,调整SH-SY5Y细胞水平至6×104/mL接种至6孔板。培养24 h后,更换含10 μL全反式维甲酸(RA)和15% FBS(体积分数)的DMEM/F12培养基培养6 d。随后,更换含50 ng/mL脑源性神经营养因子(BDNF)的DMEM/F12培养基培养2 d。从分化开始的第0、3、6、9天利用倒置相差显微镜观察细胞的形态并拍照。分化成熟的DA神经细胞判断标准:神经突起至少有一条直径是胞体的两倍以上。
1.2 主要试剂RA和BDNF购买于美国Sigma,c-Jun氨基末端激酶(JNK)通路抑制剂SP600125和p38丝裂原活化蛋白激酶(p38 MAPK)通路抑制剂SB203580购买于美国MCE,pFLAG-CMV3-TMEM230-A110T突变表达载体由上海吉凯设计和构建,si-Beclin-1和pcDNAi-Beclin-1由上海吉满设计和构建,Trizol试剂、PrimeScript RT reagent Kit和PrimeScriptTMRT-PCR Kit购买于大连宝生物,Lipofectamine 2000、BCA试剂盒及RIPA裂解液购买于美国Thermo Scientifi,CCK-8试剂盒和Annexin Ⅴ-FITC/PI凋亡试剂盒购买于北京索莱宝,Western Blotting一抗及二抗购买于美国CST,GFP-LC3试剂盒购买于上海汉恒。
1.3 方法
1.3.1细胞分组和转染:将分化成熟的DA能神经细胞随机分为WT组、MUT组、SP600125组、SB203580组、si-Beclin-1组和SP600125+pcDNA-Beclin-1组(以下简称pcDNA-Beclin-1组)。WT组为未特殊处理的DA能神经细胞;MUT组细胞给予转染TMEM230-A110T突变体载体;SP600125组和SB203580组细胞在MUT组的基础上分别给予40 nmol/L SP600125和50 nmol/L SB203580处理;si-Beclin-1组为在MUT组的基础上转染si-Beclin-1;pcDNA-Beclin-1组为在SP600125组基础上转染pcDNA-Beclin-1。转染方法按Lipofectamine 2000试剂盒步骤操作,转染24 h后进行检测。实验重复3次。
1.3.2Western blotting检测:采用RIPA裂解缓冲液提取蛋白质,采用BCA蛋白质分析试剂盒量化蛋白质浓度。取10 μg提取物在10%(质量浓度)SDS-PAGE凝胶上分离并转移至PVDF膜上。室温下,在含5%(质量浓度)脱脂牛奶的TBST中封闭1 h后,加入一抗,孵育过夜。然后,加入相应二抗后,室温封闭1 h。ECL化学发光底物显示蛋白质条带。以β-actin作为内参,用ImageJ软件定量分析神经元特异性烯醇化酶(NSE)、酪氨酸羟化酶(TH)、TMEM230、半胱氨酸天冬氨酸蛋白酶3(caspase-3)、B淋巴细胞瘤-2基因(Bcl-2)、Bax凋亡调节因子(Bax)、自噬蛋白5(Atg5)、Atg12、自噬蛋白6同源物(Beclin-1)、自噬相关泛素样修饰因子LC3 B(LC3Ⅱ/Ⅰ)、自噬受体P62(P62)、JNK/p38 MAPK相关蛋白(JNK和p-p38)蛋白条带的灰度值。
1.3.3CCK-8检测DA能神经细胞活性:取各组对数生长期DA能神经细胞,接种于96孔板中,每孔约5×103个细胞,置37℃、5%(体积分数)CO2培养箱中分别培养0、24、48、72和96 h后,每孔加入10 μL CCK-8溶液,孵育2 h,使用酶标仪测定其450 nm处吸光度值。重复实验3次。
1.3.4细胞凋亡检测:取各组对数生长期细胞调整细胞水平为2.5×105/mL,取200 μL细胞悬液接种于6孔板,培养72 h。加入Binding buffer漂洗细胞,并加入250 μL Binding buffer重新悬浮细胞。随后分别加入5 μL Annexin V-FITC和10 μL PI(20 μg/mL),充分混匀后室温下避光孵育10 min;再加入Binding buffer使反应体积达到500 μL,采用流式细胞仪检测DA能神经细胞凋亡情况,重复实验3次。
1.3.5DA能神经细胞自噬水平检测:用pH=7.4的2.5%(体积分数)戊二醛冷冻固定细胞。0.1 mol/L磷酸盐缓冲液洗涤3次,以1%(质量浓度)四氧化锇固定细胞1 h。样品经一系列不同浓度乙醇脱水,并包埋在Spurr树脂中。超薄切片(片厚70 nm),行醋酸铀和柠檬酸铅双重染色。置JEM-1230透射电子显微镜下观察各组DA能神经细胞自噬小体并拍照。将GFP-LC3病毒载体转染至DA能神经细胞48 h后,采用4%(体积分数)甲醛固定10 min。使用BX60荧光显微镜观察细胞荧光状态并拍摄图片,采用Image J软件分析各组GFP-LC3斑点数目。重复实验3次。
1.4 统计学处理采用SPSS 20.0统计学软件进行统计分析,对数据进行正态性和方差齐性检验,符合正态分布的计量资料以均数±标准差表示,多组均数间比较采用单因素方差分析,两两比较采用LSD法;两组均数间比较采独立样本t检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1 DA能神经细胞模型构建未分化的SH-SY5Y细胞呈梭形、不规则及多边形等;随RA/BDNF处理时间延长,SH-SY5Y细胞体逐渐变小且伸出树突状突起,S型细胞的形态逐渐消失;第6天,SH-SY5Y细胞树突状突起至少是胞体的两倍以上(图1)。不同分化时间点SH-SY5Y细胞间NSE、TH蛋白表达水平比较均存在统计学差异(F=51.142,P<0.01;F=250.159,P<0.01),与第0天比较,第3、6、9天SH-SY5Y细胞NSE、TH蛋白表达升高(图2~3)。

注:RA:全反式维甲酸;BDNF:脑源性神经营养因子
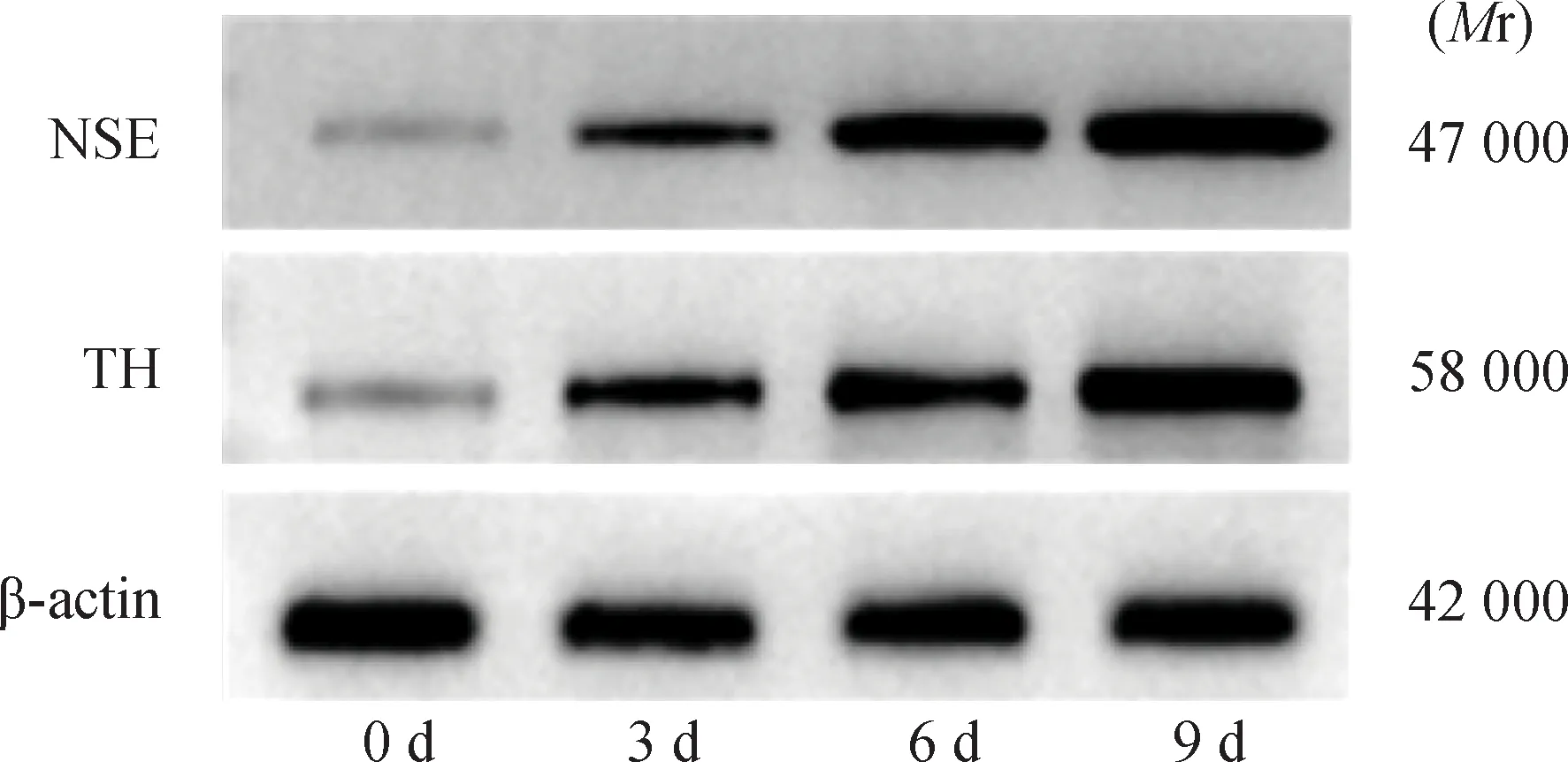
注:RA:全反式维甲酸;BDNF:脑源性神经营养因子;NSE:神经元特异性烯醇化酶;TH:酪氨酸羟化酶

注:RA:全反式维甲酸;BDNF:脑源性神经营养因子;NSE:神经元特异性烯醇化酶;TH:酪氨酸羟化酶;与0 d比较,aP<0.05,bP<0.01
2.2 各组DA能神经细胞增殖比较细胞培养48、72、96 h时,MUT组DA能神经元细胞增殖较WT组减少(P<0.05或P<0.01),SP600125组细胞增殖较MUT组增加(P<0.01),而pcDNA-Beclin-1组较SP600125组降低(P<0.01)。结果见表1。
2.3 TMEM230-A110T突变体对JNK/p38 MAPK/Beclin-1途径的影响各组DA能神经细胞TMEM230(F=10.978,P<0.01)、JNK(F=36.219,P<0.01)、p-p38(F=51.689,P<0.01)和Beclin-1(F=10.336,P<0.01)蛋白表达水平比较均存在统计学差异,两两比较结果显示,与WT组比较,MUT组JNK、p-p38和Beclin-1蛋白表达增加(P<0.05或P<0.01);与MUT组比较,SP600125组JNK、p-p38和Beclin-1蛋白表达减少,SB203580组p-p38和Beclin-1蛋白表达减少(P<0.05);与SP600125组比较,si-Beclin-1组JNK和p-p38蛋白表达增加(P<0.01);与WT组比较,MUT组、SP600125组、SB203580组和si-Beclin-1组TMEM230表达均降低(图4~5)。
2.4 各组DA能神经细胞凋亡比较各组DA能神经细胞凋亡比例及Caspase-3(F=34.586,P<0.01)、Bcl-2(F=48.371,P<0.01)、Bax(F=49.320,P<0.01)比较均存在统计学差异。与WT组比较,MUT组Bcl-2表达减少,Caspase-3和Bax表达及凋亡比例增加(P<0.05或P<0.01);与MUT组比较,SP600125组Bcl-2表达增加,Caspase-3和Bax表达及凋亡比例降低(P<0.05或P<0.01);与SP600125组比较,pcDNA-Beclin-1组Bcl-2表达降低,Caspase-3和Bax表达及凋亡比例增加(P<0.05或P<0.01)。结果见表1和图6~8。

注:DA:多巴胺;TMEM230:跨膜蛋白230;JNK :c-Jun氨基末端激酶;Beclin-1:自噬蛋白6同源物
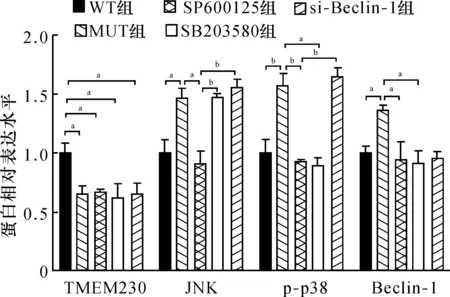
注:DA:多巴胺;TMEM230:跨膜蛋白230,JNK :c-Jun氨基末端激酶;Beclin-1:自噬蛋白6同源物;aP<0.05;bP<0.01

表1 各组DA能神经元增殖(CCK-8法)及细胞凋亡(流式细胞术)情况比较

注:DA:多巴胺;Caspase-3:半胱氨酸天冬氨酸蛋白酶;Bcl-2:B淋巴细胞瘤-2;Bax:凋亡调控因子
2.5 各组DA能神经细胞模型自噬比较与WT组比较,MUT组神经元自噬小体和LC-3斑点数量增加;与MUT组比较,SP600125组DA能神经元自噬小体和LC-3斑点数量减少;与SP600125组比较,pcDNA-Beclin-1组自噬小体和LC-3斑点数量增加(图9~10)。各组DA能神经细胞Atg5(F=18.225,P<0.01)、Atg12(F=31.814,P<0.01)、P62(F=19.442,P<0.01)蛋白表达以及LC3 Ⅱ/LC3 Ⅰ比例(F=21.946,P<0.01)均存在统计学差异。与WT组比较,MUT组细胞Atg5、Atg12蛋白表达及LC3 Ⅱ/LC3 Ⅰ比例增加,而P62蛋白表达减少(P<0.05);与MUT组比较,SP600125组细胞Atg5、Atg12蛋白表达及LC3 Ⅱ/LC3 Ⅰ比例表达减少,而P62表达增加(P<0.05);与SP600125组比较,pcDNA-Beclin-1组细胞Atg5、Atg12蛋白表达及LC3 Ⅱ/LC3 Ⅰ比例增加,P62蛋白表达减少(P<0.05)。结果见图11~12。

注:DA:多巴胺;Caspase-3:半胱氨酸天冬氨酸蛋白酶;Bcl-2:B淋巴细胞瘤-2;Bax:凋亡调控因子;aP<0.05;bP<0.01

注:DA:多巴胺
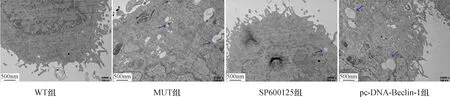
注:DA:多巴胺

注:DA:多巴胺

注:DA:多巴胺;Atg5/12:自噬蛋白5/12;LC3 B(LC3Ⅱ/Ⅰ):自噬相关泛素样修饰因子;P62:自噬受体P62

注:DA:多巴胺;Atg5/12:自噬蛋白5/12;LC3 B(LC3Ⅱ/Ⅰ):自噬相关泛素样修饰因子;P62:自噬受体P62;aP<0.05;bP<0.01
3 讨论
中脑DA能神经元是哺乳动物中枢神经系统DA的主要来源。DA能神经元的丧失与神经退行性疾病PD有关[8]。到目前为止,至少有23个致病位点和19个基因在PD单基因家系中被报道,其大多为PD的风险相关基因[9],但其在PD中的作用机制还有待于进一步研究。本研究结果显示,TMEM230-A110T突变体可通过调控DA能神经细胞自噬抑制其增殖并诱导凋亡,且JNK/p38 MAPK/Beclin-1途径参与TMEM230-A110T突变体对DA能神经细胞的调控。
近年来研究证实,TMEM230是一种参与囊泡运输的新基因,被证实与PD相关。TMEM230中的一个错义突变(c.422G>T;p.Arg141Leu)在北美的一个3代大家庭谱系中首次被发现。随后,两个新的突变体p.G16W和p.M64V以及6个已知的错义突变体仅在PD患者中被检测到[10],尽管多项研究未能在TMEM230基因中找到与PD相关的致病变异[11],但依然提示这些TMEM230突变体可能在PD的致病性或易感性中发挥作用。作者团队前期研究亦发现,携带TMEM230 A110T突变体的2例中国西南地区病例均有典型的多巴反应的PD症状[4]。然而,目前关于TMEM230 A110T突变体对PD的作用尚不清楚。本研究通过向DA能神经元中转染TMEM230 A110T突变体发现,DA能神经细胞自噬和凋亡增加,且增殖能力降低,提示TMEM230 A110T极有可能通过调控DA能神经细胞的生物表型参与PD的发展进程,是潜在的PD诊断和治疗靶标。
自噬途径是一种真核生物进化上保守的周转过程,在清除长寿蛋白、聚集蛋白或功能障碍的细胞器时发挥重要作用,并能够提供能量和大分子前体[12]。大量研究表明,PD相关的α-突触核蛋白和tau蛋白的聚集是自噬溶酶体降解受损的结果[13-14],p38 MAPK和JNK信号通路的异常激活能通过调控自噬参与PD进程。miR-326通过JNK信号促进DA能神经元自噬[15]。α-突触核蛋白A30P突变体通过抑制JNK信号激活来增强DA能神经元中ZKSCAN3的活性,从而损害自噬通量[16]。此外,p38 MAPK/mTOR信号通路的激活会促进自噬,进而触发斑马鱼的PD样症状[17]。Liu等研究亦表明,p38 MAPK/JNK信号通路参与调控PD细胞凋亡和自噬过程[18]。本研究结果显示,TMEM230 A110T突变体能够激活JNK/p38MAPK/Beclin-1通路,且通过调控该通路促进DA能神经细胞的自噬。此外,Yan等[19]研究表明,IRE1能够调控PD果蝇模型中的自噬并介导神经元的增殖和凋亡。本研究结果显示,采用SP600125处理转染TMEM230 A110T突变体的DA能神经元后,细胞的自噬能力降低,细胞增殖能力增加,凋亡下降;而过表达自噬相关蛋白Beclin-1后,转染TMEM230 A110T突变体的DA能神经元增殖减少,且凋亡增加,表明TMEM230 A110T突变体通过激活JNK/p38MAPK/Beclin-1通路增强DA能神经元自噬,从而介导神经元增殖和凋亡。
综上所述,本研究结果显示,TMEM230 A110T突变体可能通过激活JNK/p38MAPK/ Beclin-1途径促进DA能神经细胞自噬,进而抑制DA能神经细胞增殖并诱导其凋亡,这为进一步研究PD的发病机制以及治疗靶点提供了理论基础。
