细菌Ⅴ型分泌系统的研究进展
2022-02-12张洋武成综述于源华审校
张洋,武成综述,于源华审校
1.长春理工大学生命科学技术学院,吉林长春130022;2.长春理工大学生物检测工程实验室,吉林 长春130022;3.钓鱼台医药集团吉林天强制药股份有限公司,吉林柳河135300
根据革兰染色法,细菌分为只含1层内膜(inner membrane,IM)的革兰阳性菌(Gram-positive,G+)和含有IM、外膜(outer membrane,OM)两层膜的革兰阴性菌(G-)。G+与G-菌细胞膜结构的差别,导致它们的分泌系统存在较大差异。大多数G+菌通过一般分泌途径(general secretory pathway,GSP)或称Sec途径(secretion)、双精氨酸移位酶途径(twin-arginine translocation,Tat)、信号识别颗粒途径(signalrecognition particle,SRP)等即可完成蛋白的分泌与转运。由于G+菌含有较厚的肽聚糖细胞壁,部分G+菌还演化出了其他特殊的分泌途径:FEA(flagella export apparatus)、FPE(fimbrilin-protein exporter)、holin(hole forming)和Wss(WXG100 secretion system)途径。其中Wss途径(Esat-6分泌系统、ESX-1途径、G+菌Ⅶ分泌系统)可在结核杆菌、金黄色蜡状葡萄球菌、炭疽杆菌中转运毒性蛋白[1]。
G-菌分泌的蛋白需跨越IM、周质空间和OM,包括毒素、黏附素、酯酶、蛋白酶、核酸酶、DNA-蛋白复合物、溶血素等。目前,G-菌中至少存在9种分泌系统,依次命名为Ⅰ型分泌系统(typeⅠsecretion system,T1SS)~Ⅸ型分泌系统(typeⅨsecretion system,T9SS)[2]。根据蛋白的分泌是否需要同时跨越内外双层膜,可将G-菌分泌系统分为一步分泌和两步分泌系统[3-4]。一步分泌系统可将蛋白一步释放到细菌外或直接注入真核宿主体内,包括Ⅰ、Ⅲ、Ⅳ、Ⅵ型4类分泌系统。该系统分泌的蛋白不含N-端信号肽,被称为非经典分泌蛋白(non-classically secreted proteins,NCSPs)。而含有信号肽的经典分泌蛋白(classically secreted proteins,CSPs)在信号肽的引导下通过Sec途径跨越内膜,下一步通过不同的机制跨越外膜,该过程称为两步分泌。两步分泌系统包括Ⅱ、Ⅴ、Ⅶ、Ⅷ[5]和Ⅸ型[6]5类分泌系统。
T1SS以大肠埃希菌α-溶血素(Hly A)为代表,其转运装置由位于内膜上提供能量的ABC转位酶、跨过内膜与外膜连接的膜融合蛋白(membrane fusion protein,MFP)和外膜蛋白(outer membrane protein,OMP)3个必要蛋白组成,主要分泌毒素、溶血素等;T2SS以Klebsiella oxytoca支链淀粉酶为代表,由外膜复合体、内膜蛋白、提供能量的ATPase等多达15种蛋白组成复杂转运体,主要分泌各种酶类,如蛋白酶、酯酶、磷酸酶等[7];T3SS由多达20种蛋白质组成类似于注射器的超分子复合物,其中含有9个保守的核心蛋白,可通过针头结构将效应蛋白直接注入宿主细胞中,主要存在于耶尔森菌、志贺菌、肠炎沙门菌等[8];T4SS由VirB同源蛋白和Tra同源蛋白等至少10种蛋白组成,主要参与细菌与周围环境的DNA转移,也可参与毒力因子的分泌[9];T5SS也被称为自主转运分泌系统(autotransporter,AT),可具体划分为6种亚型;T6SS以溶血素调节蛋白(Hcp)和缬氨酸-甘氨酸重复蛋白G(valine-glycine repeat protein G,VgrG)为代表,由包含15~25个基因的保守基因簇编码而来,目前发现的Ⅵ型分泌蛋白数量较少,主要存在于铜绿假单胞菌、霍乱弧菌、沙雷菌等[10];T7SS通常被称为分子伴侣/分子引导分泌途径(chaperone-usher pathway,CUpathway),区别于G+菌Ⅶ分泌系统,主要参与大肠埃希菌和沙门菌等至少30种G-菌纤毛、菌毛等黏附结构的组装[11];T8SS通常被称为胞外核聚-沉淀途径(extracellular nucleation-precipitation pathway,ENP pathway),存在于沙门菌和大肠埃希菌中的Curli蛋白是已知唯一的由该系统分泌的黏附细胞器[12];T9SS也被称为Por分泌系统,以牙龈素(gingipains)为代表,可促使细菌发生滑行运动,也可作为毒力因子,主要存在于Bacteroidetes门的大多数分支中[6]。在G-菌9种分泌系统中,一部分分泌系统在所有细菌中相对保守,可分泌多种多样的蛋白;另外一些分泌系统仅出现在小部分细菌种群中;甚至部分分泌系统只可分泌1种或少数几种蛋白。
本文对T5SS的研究进展作一综述,旨在为研究细菌的致病机制提供参考,以及新型抗生素的研发和T5SS的生物学应用等提供新的思路。
1 T5SS的结构和分类
T5SS结构单一,通常只含有1条或两条肽链,包含跨内膜必须的信号肽、分泌到细菌表面发挥生理功能的乘客区域(passenger domain)和负责定位到外膜区的转运区域(translocation domain)。由于之前的研究认为Ⅴ型分泌蛋白跨外膜的过程不需要能量和辅助蛋白,自身即可依赖Sec途径跨内膜转运,并在外膜上形成β折叠桶(β-barrel)完成蛋白的外泌,因此也被称为自主转运分泌系统。近几年,随着Ⅴ型分泌蛋白研究的不断深入,使得“自主转运”这一命名受到挑战。另外,由于蛋白跨外膜后乘客区域与转运区域的分离,而晶体结构只能获取蛋白的最终状态,使得全长蛋白的结构解析十分困难,目前只有酯酶A(estrase A,EstA)的全长结构被解析出来[13]。Ⅴ型分泌蛋白结构的差异造成其分泌过程和最终构象的不同,因此将T5SS进一步分为6种亚型:Ⅴa、Ⅴb、Ⅴc、Ⅴd、Ⅴe、Ⅴ-like。T5SS不同亚型的结构见图1[14],不同亚型间的差异见表1。

表1 T5SS不同亚型的基本特征Tab.1 Basic characteristics of T5SS

A:Ⅴ型分泌蛋白结构示意图(红色表示12条β-折叠构成的折叠桶,绿色表示16条β-折叠构成的折叠桶,粉红色表示预测的8条β-折叠构成的折叠桶,蓝色表示由β-螺旋构成的乘客域,紫色表示Ⅴc乘客蛋白,褐色表示Ⅴd和Ⅴe乘客蛋白,深红色表示Ⅴ-like乘客蛋白);B:已解析Ⅴ型分泌蛋白的晶体结构(α-螺旋用红色标记,β-折叠用黄色标记)。PDB编码如下:乘客区域:Pertactin(1DAB)、HMW1(2ODL)、EibD(2XQH)、PlpD(5FYA)、Inv(1CWV)、SabA(4O5J),β-桶状结构域NalP(1UYO)、FhaC(4QKY)、Hia(2GR7)、Int(4E1S),Ⅴd和Ⅴ-like亚型的β-桶状域结构尚未解析。
1.1Ⅴa亚型 Ⅴa亚型分泌系统又被称为经典自主转运系统(classical autotransporter),最早用于描述淋病奈瑟菌IgA蛋白酶的分泌。该途径主要分泌丝氨酸蛋白酶、毒力因子、黏附素以及参与免疫逃避和生物膜形成的蛋白。Ⅴa亚型分泌系统只含有1条肽链,由N-端信号肽、乘客区域、C-端转运区域组成。N-端信号肽在完成跨内膜Sec转运后被切除。最早被解析的Ⅴa亚型乘客蛋白为百日咳杆菌粘附素(pertactin,PRN),呈长纤维状结构,由反向平行的β-片层(β-sheets)围绕中心轴螺旋成β螺线管(βsolenoids)超二级结构。相邻的β-片层由环状loops相连,而且β螺线管内部紧密疏水以维持结构的稳定性[15]。大多数Ⅴa亚型乘客蛋白,如血红蛋白酶Hbp、抗原Ag43等具有相似结构,但EstA乘客蛋白呈α-球状结构。最早被解析的Ⅴa亚型转运蛋白为NalP,由含有12条连续β-折叠构成的β-桶状结构和贯穿β-桶状结构内部的呈α-螺旋(α-helical)的连接区组成[16]。尽管α-螺旋连接区的长度和方向存在差异,但几乎所有Ⅴa亚型转运蛋白,如Hbp、AIDA-I、EstA、EspP等均含有该结构。另外,Ⅴa亚型分泌系统转运蛋白不含有周质空间残留区域。
1.2Ⅴb亚型 Ⅴb亚型分泌系统又被称为双组分分泌系统(two-partner secretion systems,TPS),主要分泌细胞毒素、黏附素、蛋白酶、血红素结合蛋白等,在细菌对宿主细胞的黏附、侵袭、传播中发挥作用。区别于所有的T5SS,Ⅴb亚型由同一操纵子下的两条独立多肽链组成,分别编码发挥生物学效应的乘客蛋白TpsA和负责插膜定位的转运蛋白TpsB。TpsA和TpsB具有各自独立的信号肽序列,通过Sec途径介导蛋白的跨内膜运输。目前,研究最清楚的TPS系统为流感嗜血杆菌黏附素(H.influenzaeadhesion,HMW)和百日咳丝状血凝素(B.pertussisadhesin filamentous haemagglutinin,FHA)。现已解析的TpsA蛋白结构包括FHA[17]、HMW1[18]和奇异变形杆菌溶血素A(Proteusmirabilishemolysin A,HpmA)[19],由β-片层和β-螺旋组成β螺线管,该结构与Ⅴa亚型转运结构域相似。目前唯一解析的TpsB蛋白为FHA的转运蛋白FhaC,由16条β-折叠构成的β-桶状结构和N-端存在于周质空间的两个POTRA域(polypeptide transport associated domains)组成。FhaC的β-桶状结构内存在1段由周质空间插入的α-螺旋(H1)和1个贯穿其中的胞外loop(L6),上述两个结构共同堵塞β-桶,在FHA分泌过程中起重要作用[20]。
1.3Ⅴc亚型 Ⅴc亚型分泌系统又被称为三聚体自身转运黏附素(trimeric autotransporter adhesins,TAAs),作为细菌表面黏附素介导细菌对宿主细胞或细胞外基质蛋白的黏附。Ⅴc亚型蛋白在细菌表面展示为三聚体寡聚“棒棒糖”结构,比其他T5SS结构复杂,由长度变化大且结构多样的乘客蛋白和类似于经典转运蛋白但更为短小的C-端β-桶状转运蛋白组成。Ⅴc亚型乘客蛋白结构多样,通常包含N-端信号肽、头结构域(head regions)、颈结构域(neck domain)、茎结构域(stalk)等。目前已解析的Ⅴc亚型乘客蛋白有大肠埃希菌IgG结合蛋白EibD[21]、鼠疫耶尔森菌黏附素A(YadA)[22]、流感嗜血杆菌Hia[23]等。其球状头结构复杂多样,典型代表为左手β-roll结构。颈结构域将球状头结构与细长型茎结构相连,主要为无规则卷曲,并可将3个亚基连接在一起,从而稳定三聚体结构。茎结构域由3个α-螺旋相互缠绕组成超级螺旋结构,由一个右手超级螺旋开始,继而转换为标准的左手超级螺旋,并通过连接区与转运区域相连。已解析的Hia[24]和YadA[25]转运区域结构类似,由乘客蛋白C-端形成的4条β-折叠三聚成含12条β-折叠的β-桶状结构,桶状结构内部的连接区为标准左手线圈螺旋结构。
1.4Ⅴd亚型Ⅴd亚型分泌系统目前仅用来描述铜绿假单胞菌马铃薯糖蛋白样蛋白PlpD。与经典转运途径类似,含有N-端乘客区域和C-端转运区域。其转运区域的氨基酸序列不同于经典转运蛋白,而与TpsB具有同源性。生物信息学结构预测显示,PlpD含有16个β-折叠构成的β-桶状结构和1个POTRA域,但PlpD转运区域的具体结构尚未被解析。目前,PlpD乘客区域结构已被解析,作为经典的脂肪酶α/β水解酶,包含,1个催化位点和1个位于疏水性通道内的脂质分子。PlpD具有磷脂酶A1活性,可广泛识别磷脂酰肌醇并破坏膜结构[26]。
1.5Ⅴe亚型 Ⅴe亚型分泌系统又被称为反向自转运途径(inverse autotransporters),主要代表为致病性大肠埃希菌内膜素(intimin)和耶尔森菌入侵素(invasin),也被称为intimin/invasin途径。与经典自转运途径不同,其C-端乘客区域为多个免疫球样蛋白(Ig-like)重复衔接组成,且顶部被c型凝集素样结构域覆盖[27]。N-端为12条β-折叠构成的β-桶状转运区域,β-桶状结构与经典自装运和三聚体自转运蛋白类似。但β-桶状结构内部连接区不是α-螺旋结构,而是一条伸展链。在β-桶状结构与连接区之间存在一段α-螺旋周质空间域,该区域一般小于50个氨基酸残基,预测仅含有两个α-螺旋[28]。
1.6Ⅴ-li k e亚型Ⅴ-like亚型分泌系统被用于描述幽门螺旋杆菌外膜蛋白家族Hops,如BabA、SabA等黏附素的分泌,该蛋白家族的C-端含有一段保守的类似于自转运蛋白的跨膜域。预测该蛋白含有1个不连续的跨膜域,由C-端7条β-折叠和N-端1条β-折叠组成含8条β-折叠的OmpA-likeβ-桶状结构。晶体结构和小角X-射线散射实验表明,SabA胞外结构为保守的α-卷曲螺旋,插在第1与第2个β-折叠之间[29]。该系统虽然被命名为Ⅴ-like亚型,但其蛋白结构十分特殊,且与其他自转运蛋白在系统发育上无明确关联。
2 T5SS的分泌过程
G-菌T5SS属于两步分泌,其分泌过程包括:跨内膜转运、周质空间转运、跨外膜转运、蛋白释放等[30]。
2.1跨内膜转运 Ⅴ型分泌蛋白含有依赖Sec系统的信号肽序列,蛋白在细胞内合成后,以未折叠的状态通过Sec系统跨过细菌内膜。90%以上的Ⅴ型分泌蛋白具有一段长度约为25个氨基酸且结构保守的信号肽,该信号肽由带电荷的N-端、中心疏水的H域和含信号肽酶1(SPase1)切割位点的C-端构成。某些蛋白的信号肽长度超过50个氨基酸残基,具有双重结构域,包括约25个氨基酸的N-端延伸部分和类似于经典Sec信号肽的C-端[31]。Sec转运过程中涉及到多种Sec蛋白,如SecA、SecB、SecYEG、信号识别颗粒(signal recognition particle,SRP)、YidC等。SecA为100 kD的分子驱动蛋白,SecYEG为内膜上运送外泌蛋白的通道,SecB为17 kD的四聚体伴侣蛋白,YidC插入酶可将蛋白插到内膜上。多数Ⅴ型分泌蛋白的跨内膜转运过程可概括为:SecB与前体蛋白结合,维持前体蛋白的未折叠稳态;SecB与SecA相互作用,前体蛋白与SecB解离;信号肽与SecA结合;前体蛋白被高效转移到SecYEG通道;信号肽被切割后释放到周质空间。另外,某些Ⅴ型分泌蛋白,如FHA、Hbp、EmaA等通过依赖于SRP的Sec途径实现跨内膜转运,信号识别依赖于SRP,依赖YidC插入内膜,并通过SecYEG跨越内膜[32]。长信号肽的N-端延伸区域在内膜靶向和转位中不必要,但可减缓分泌蛋白通过SecYEG的速度,延长跨内膜时间,从而保证蛋白的正确折叠[33]。
2.2周质空间转运 Ⅴ型分泌系统的蛋白跨内膜转运到周质空间后,可与周质空间中的分子伴侣,如SurA、Skp、DegP、PpiD、FkpA等结合,从而完成蛋白的跨周质空间转运。由于蛋白的折叠倾向和氨基酸序列(是否含Sur分子伴侣的特定结合域)存在差异,Ⅴ型分泌蛋白需要的分子伴侣不同。已有研究表明,Ⅴ型分泌蛋白可在跨内膜转运早期募集水母状三聚体Skp,从而防止蛋白的过早折叠和不当相互作用[34]。SurA可在Hbp蛋白分泌中发挥作用,研究表明,SurA的突变明显影响Hbp的表达,而Skp和DegP的突变对其表达无影响[35]。而在EspP的分泌过程中,DegP的突变比SurA和Skp的突变更影响EspP的表达。通常认为,DegP可降解定位不正常的自转运蛋白,从而使细菌免受中间体毒性的影响。体外实验表明,Ag43等蛋白在无分子伴侣的条件下,能够正常转运进入蛋白脂质体中[34-35]。因此,分子伴侣在Ⅴ型分泌蛋白的跨周质空间转运过程所起的作用,还有待进一步研究。
2.3跨外膜转运 之前的假说认为,T5SS可完全自主转运,但晶体结构研究表明,经典自主转运蛋白的β-桶状结构直径仅10?,只能容纳1个α-螺旋或1个发夹结构通过,使得该观点受到质疑。目前认为,Ⅴ型分泌蛋白的跨外膜转运需包括周质空间分子伴侣、BAM复合体(barrel assembly machinery complex)、Tam等多种蛋白分子的参与,从而构成复杂的转运网络。BAM复合体以BamA为中心蛋白,加之BamB、BamC、BamD、BamE共同构成,其中BamA含有的5个POTRA域(polypeptide transport-associated domains)在形成BAM复合体和转运外来蛋白的过程中发挥重要作用[36]。Ⅴ型分泌蛋白在周质空间中与分子伴侣相互作用形成部分折叠态,其转运区域形成的β-桶状结构插入外膜中,进一步引导乘客区域的跨外膜转运。
经典自转运Ⅴa系统研究较清楚,以EspP为例描述Ⅴa转运过程[14](图2)。首先,转运域β-桶状结构在周质空间中部分折叠,并将EspP的连接区保护在β-桶状结构中,从而防止蛋白酶切和化学修饰。定点交联技术表明,在该过程中,分子伴侣Skp结合在β-桶状结构上。然后,β-桶状结构与外膜上的BamA、BamD以及分子伴侣SurA相互作用,使β-桶状结构折叠为圆筒状结构插入外膜。之后,乘客区域以发夹结构通过BamA和β-桶状组成的混合型开放通道,并在胞外正确折叠。完成乘客蛋白的转运后,β-桶状结构闭合成稳定状态。乘客蛋白进一步加工剪切释放[37]。另有研究表明,在Ag43和EhaA的转运过程中,外膜蛋白TamA和TamB形成的复合体发挥了类似于BAM复合体的功能[38]。Ⅴc跨外膜转运过程与Ⅴa类似,以YadA为例,其转运需要BAM复合体的参与,蛋白的三聚化在周质空间中完成[39]。目前猜测,反向自转运系统跨外膜转运过程与Ⅴa类似,但尚未被验证。
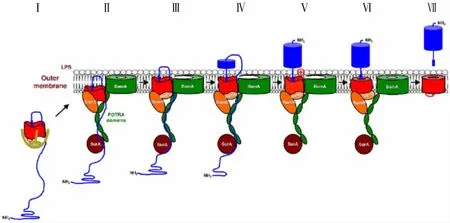
图2 Ⅴa亚型分泌系统跨外膜转运示意图Fig.2 Model for transmembrane transport of secretion system of subtypeⅤa
双组分分泌系统的TpsB含有16个β-折叠构成的桶状结构,可作为TpsA转运的通道。以FHA和FhaC为例,FhaC插膜后可在周质空间形成两个POTRA域,FHA的N-端TPS域可识别POTRA域,然后完成跨外膜转运。在该过程中,FhaC的L6结构通过调节桶状结构的闭合发挥作用[40]。Ⅴd的C-端结构域与TpsB类似,可将Ⅴd分泌蛋白看作TpsA与TpsB直接相连的融合蛋白,PlpD蛋白的转运过程类似于双组分分泌系统,不需要BAM复合体参与。
2.4蛋白释放 乘客蛋白跨外膜转运后,一部分蛋白不需要酶切释放,如EstA等共价键结合在β-桶状蛋白上发挥生物学效应。三聚体自身转运蛋白作为细菌表面黏附素,也不进行切割释放。而大多数乘客蛋白被自身或外在酶切割并释放到细菌外。其中一些切割分离后的蛋白,如AIDA-I和百日咳黏附素Pertactin等,可通过非共价键结合的方式重新定位在细菌表面发挥作用。根据切割所需酶的来源,将蛋白的切割释放分为以下4种方式:①自身桶内酶切:肠杆菌科分泌的丝氨酸蛋白酶自转运蛋白(SPATEs),如SigA、Pic等的催化位点位于β-桶状内部连接区相邻的两个天冬酰胺残基[41];②自身分子间酶切:分泌到细菌表面的流感嗜血杆菌Hap具有丝氨酸蛋白酶活性,可将相邻的Hap蛋白切除释放[42];③异源蛋白酶切:NalP不仅可催化自身酶切,还可催化App、IgA蛋白酶、AusⅠ的切除释放[43];④异源β-桶状蛋白酶切:IcsA的切除释放依赖于外膜蛋白酶SopA[44]。
3 基于T5SS的表面展示技术
G-菌如大肠埃希菌常被用来表达重组蛋白,而重组蛋白在胞内大量聚集,不仅不利于蛋白的正确折叠,还会对工程菌造成伤害。基于T5SS的细菌表面展示技术是利用Ⅴ型分泌蛋白的转运区域将外源蛋白运载到细菌膜表面,从而使重组蛋白有效展示。利用细菌表面展示技术表达的重组蛋白具有蛋白纯化简便、蛋白折叠完全、活性和可溶性增加、稳定性增强的优点。最常被用于表面展示的是Ⅴa亚型分泌系统,Ⅴe亚型(intimins)也有部分报道[45],但未见Ⅴb~d亚型的应用。将外源序列插入自转运蛋白序列的方式有两种,最常用的方式是将外源蛋白替换自转运蛋白的乘客区域直接融合到β-桶状蛋白上,另一种是将外源蛋白融合在乘客蛋白全长上或部分外露环状区域上。细菌宿主除了常用的大肠埃希菌外,还可利用沙门菌、鼠伤寒杆菌、发酵杆菌Z.mobilis和Z.palmae、假单胞杆菌等[46]。T5SS的细菌表面展示技术应用广泛,可被用于疫苗[47]、全细胞催化剂、生物吸附剂、生物传感器、重组文库筛选、生物燃料[48]等多种生物技术的研发中[49]。
4 T5SS常用的研究方法
T5SS常用研究方法与其他蛋白类似。通过氨基酸序列的缺失、移位、点突变等研究Ⅴ型分泌蛋白自身组分的性质和功能;利用定点光交联技术、体外蛋白脂质体等方法研究Ⅴ型分泌蛋白跨膜转运所涉及的辅助蛋白;利用生物信息学分析可预测细菌蛋白的分泌机制。其中定点光交联技术作为蛋白相互作用研究的常用技术,在T5SS中可被用来研究分泌蛋白转运过程中与周围蛋白的相互关系。IEVA等[50]利用定点光交联的方法发现在EspP乘客蛋白跨膜移位停止后,检测到EspP与BamA的蛋白短暂结合,证明BAM复合体在β-桶状蛋白插膜过程和乘客蛋白转运过程中均发挥作用。该研究还证明了转运过程中EspP的N-端残基与周质空间分子伴侣SurA和Skp的相互作用。另外,NORELL等[51]建立了一种体外实验方法,用于研究Ⅴ型分泌蛋白的插膜与转运。该方法联合使用了蛋白脂质体和原生质球,在体外实现了Ⅴb亚型FHA和Ⅴa亚型Ag43的有效转运及β-桶状外膜蛋白的功能性插膜。ABBY等[52]开发的MacSyFinder可实现细菌蛋白分泌系统在基因学上的分类预测。利用信号肽的保守性以及长信号肽的序列特异性,也可预测未知蛋白的分泌类型。
5 小结与展望
现有研究初步探讨了T5SS的分类、转运过程等,但T5SS十分复杂多样。虽然目前已揭示了Ⅴ型分泌过程需要BAM复合体和分子伴侣的参与,但BAM复合体具体的组装过程及在转运中发挥的具体作用,以及不同分泌蛋白所需分子伴侣的差异,还有待进一步研究。另外,现有研究表明,T5SS转运过程中无需外源提供的ATP和电化学梯度参与,其转运过程的能量供应还需探究。此外,部分Ⅴ型分泌蛋白的结构,尤其是Ⅴd转运区域的结构尚有待解析。本文主要对T5SS进行了论述,通过对T5SS的深入研究,不仅有助于探讨细菌的致病机制,还可为新型抗生素的研发和T5SS的生物学应用等提供新的思路。
