大鼠骨髓间充质干细胞来源微颗粒的提取及鉴定
2022-02-12马瑞君王苗苗封启龙
马瑞君,王苗苗,封启龙
1.山西医科大学生理学系细胞生理学教育部重点实验室,山西太原030001;
2.山西医科大学第二附属医院心内科,山西太原030001
近年来,干细胞(stem cells,SCs)治疗心血管疾病受到关注,SCs不仅具有自我更新能力,而且可分化成一种或多种类型的终末细胞。研究表明[1],间充质干细胞(mesenchymal stem cells,MSCs)进入体内后可通过分化为心肌细胞治疗心肌梗死,但近年来研究发现[2-3],MSCs体积较大,易堵塞血管,进入体内后在靶点的富集程度不高,分化为靶细胞的数量较少,而且有促进肿瘤生长与转移的风险。随着研究的深入,人们发现,MSCs的旁分泌功能在疾病的治疗过程中起重要作用[4-6],MSCs可通过分泌内皮细胞生长因子(vascular endothelial growth factor,VEGF)、肝细胞生长因子(hepatocyte growth factor,HGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)等发挥对心血管的保护作用。研究发现[7],细胞还可通过释放胞外囊泡发挥细胞间的信息传递功能。胞外囊泡分为外泌体(exo,exosome)和微颗粒(microparticles,MPs)[8],外泌体是通过细胞内吞作用形成多胞体后,向细胞外释放的直径为10~100 nm的膜性囊泡,其形成过程较复杂;而MPs则是直接从细胞膜上脱落下的直径为0.1~1μm的小囊泡,其中包含miRNA、mRNA以及蛋白质等生物活性分子,MPs的表面带有与其来源细胞类似的表面标记。MPs在最初被发现时,人们认为其为无功能的细胞“尘埃”[9],近年来的研究发现,MPs参与了细胞通讯过程,MPs由一层脂质双分子层包裹而成,其中携带的生物活性分子可通过膜融合的方式作用于靶细胞,使其包裹的miRNA等生物活性分子进入细胞内发挥作用。
本研究分离并纯化大鼠骨髓间充质干细胞(bone mesenchymal stem cell,BMSCs),并在此基础上成功分离骨髓间充质干细胞来源的微颗粒(bone marrow mesenchymal stem cell-derived microparticles,BMSCMPs),旨在为下一步对MPs的深入研究奠定基础。
1 材料与方法
1.1实验动物 SPF级SD大鼠,5周龄,体重(100±10)g,由山西医科大学实验动物中心提供,动物生产许可证号:SCXK(晋)2015-0001。本实验对SD大鼠的所有处理均以科研为目的进行养殖和使用,且按照山西医科大学动物伦理相关规定进行[SCXK(晋)2015-0001]。
1.2主要试剂及仪器 DME/F-12培养基购自美国HyClone公司;FBS购自赛澳美细胞技术(北京)有限公司;胰蛋白酶消化液和青链霉素混合液购自北京索莱宝科技有限公司;流式抗体FITCanti-rat CD29、FITC anti-rat CD90、PE anti-rat CD34、PE antirat CD45以及同型对照抗体FITC-IgG1和PE-IgG1均购自美国BioLegend公司;流式校准珠购自美国Spherotech公司;成骨成脂培养基购自赛业生物科技有限公司;其余试剂购自武汉博士德生物工程有限公司;细胞培养瓶等耗材购自无锡耐思生物科技有限公司。
1.3B M S C s的分离、培养和纯化 采用全骨髓贴壁法分离BMSCs。取1只SD大鼠,雌雄不限,脊椎脱臼法处死,迅速置于75%酒精中浸泡15 min,取出后将大鼠置于无菌手术布上,并迅速剪开双后肢皮肤,分离肌肉,尽量将胫骨和股骨附着的肌肉分离干净,然后将股骨和胫骨置于预冷的无菌PBS溶液中,移入无菌操作台,剪开骨骺端,用含10%FBS的DME/F-12培养基冲洗骨髓腔,收集冲洗液,179×g离心5 min,弃上清,向沉淀内加入含10%FBS的DME/F-12培养基重悬后,接种至1个T25细胞培养瓶内培养,48 h后首次换液,细胞融合率达90%左右时用胰酶消化传代。显微镜下观察BMSCs的形态。
1.4B M S C s生长曲线的绘制 取生长旺盛的第5代BMSCs,按8×103个/孔接种于24孔板中,培养24 h后第1次计数,以后每隔24 h计数1次,共计数8 d。每次随机选取3孔计数,取平均值,以时间为横坐标,细胞数量为纵坐标绘制BMSCs的生长曲线。
1.5B M S C s表面标记的鉴定 采用流式细胞术。取第5代融合率达90%左右的BMSCs,加入不含EDTA的0.25%胰蛋白酶消化2 min,再加入等体积培养基稀释胰酶,将细胞悬液179×g离心5 min,收集细胞,用预冷的PBS洗涤2次后,纱布过滤细胞悬液,试验组在室温下分别加入FITCanti-rat CD29、FITCanti-rat CD90、PEanti-ratCD34和PEanti-rat CD45,同型对照组分别加入同型对照流式抗体FITC-IgG1和PE-IgG1,各组避光孵育30 min后,用PBS洗去未结合抗体,使用流式细胞仪上机检测。
1.6B M S C s成脂和成骨诱导分化 取第5代BMSCs,按2×105个/孔接种于6孔板内,待细胞融合率达90%时开始诱导分化。在无菌条件下严格按照SD大鼠BMSCs成骨诱导分化培养基和成脂诱导分化培养基说明书要求混合各培养基,每隔48 h更换新鲜培养基;自分化对照组使用含10%FBS的DME/F-12培养基,培养基内不添加诱导分化因子。各组连续培养21 d后进行染色,染色前使用多聚甲醛固定细胞30 min,成骨诱导分化组及其自分化组使用茜素红染色,成脂诱导分化组及其自分化组使用油红O染色,染色30 min后用PBS洗去染色液,显微镜下观察。
1.7B M S C-M Ps的提取 取第5代BMSCs,待细胞生长至80%~90%时,弃去旧培养基,加入不含血清的DME/F-12培养基培养48 h,血清饥饿48 h后收集上清液,采用梯度离心法获取BMSC-MPs:300×g离心10 min,取上清液,弃沉淀,去除残余细胞;2 500×g离心20 min,取上清液,弃沉淀,去除凋亡小体和细胞碎片;18 000×g离心1 h,弃上清,加入经0.1μm无菌滤器过滤过的PBS,重悬沉淀,此时获得较纯的MSC-MPs,封口膜封口后置于超低温冰箱备用。
1.8B M S C-M Ps的流式计数 按照流式细胞仪校准珠说明书进行,使用1.35、0.88、0.45、0.22μm校准珠设定流式细胞仪检测的门。取新鲜提取的BMSC-MPs,在流式管内加入390μL Buffer液(NaCl 140.0mmol/L,HEPES10.0mmol/L,CaCl23.0mmol/L,用1.0 mmol/L NaOH调节pH至7.40),Buffer液先使用0.1μm无菌滤器过滤,再加入10μL BMSCMPs,充分混匀后用流式细胞仪低速上机检测1 min,得到落在门内MPs的数量。根据剩余液体体积等数据计算MPs数量,计算时需减去空白对照组中的颗粒数。BCA法检测BMSC-MPs蛋白浓度。
1.9B M S C-M Ps的表面抗原鉴定 与BMSCs的表面抗原鉴定类似,试验组取BMSC-MPs,室温下分别加入FITC anti-rat CD29、FITC anti-rat CD90、PE antirat CD34、PE anti-rat CD45,同型对照组分别加入同型对照流式抗体FITC-IgG1和PE-IgG1,各组避光孵育30 min后,用PBS洗去未结合抗体,使用流式细胞仪检测。
2 结果
2.1B M S C s的形态 从大鼠股骨和胫骨内提取的第0代BMSCs大小和形态各异;但第0代细胞经10 d左右换液后,较小的红细胞和其他杂细胞的数量逐渐减少,BMSCs呈现出典型的“纺锤样”和“鱼群状”排列;BMSCs在传代后生长速度显著增快,6~7 d融合率即可达90%左右,随着BMSCs的换液与传代,BMSCs的纯度逐渐升高。见图1。

图1 大鼠BMSCs的形态学特征Fig.1 Morphological characteristics of rat BMSCs
2.2B M S C s的生长曲线BMSCs在接种后的24 h内生长速度缓慢;第2~7天生长速度显著增快,表现为生长曲线呈“S”型,细胞呈指数速度生长;第7天细胞数量接近饱和,生长速度显著降低,达平台期。见图2。
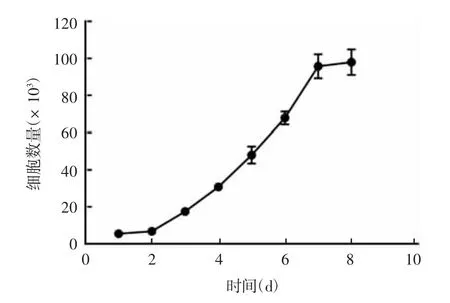
图2 第5代BMSCs的生长曲线Fig.2 Growth curve of BMSCs of passage 5
2.3B M S C s的表面标记 流式细胞术检测结果显示,第5代BMSCs表面标志物CD29和CD90阳性率分别为(99.90±0.66)%和(99.81±0.94)%,CD45和CD34阳性率分别为(0.89±0.31)%和(1.79±0.33)%,表明随着换液和传代,BMSCs内混有的杂细胞数量逐渐减少,第5代BMSCs纯度较高。见图3。
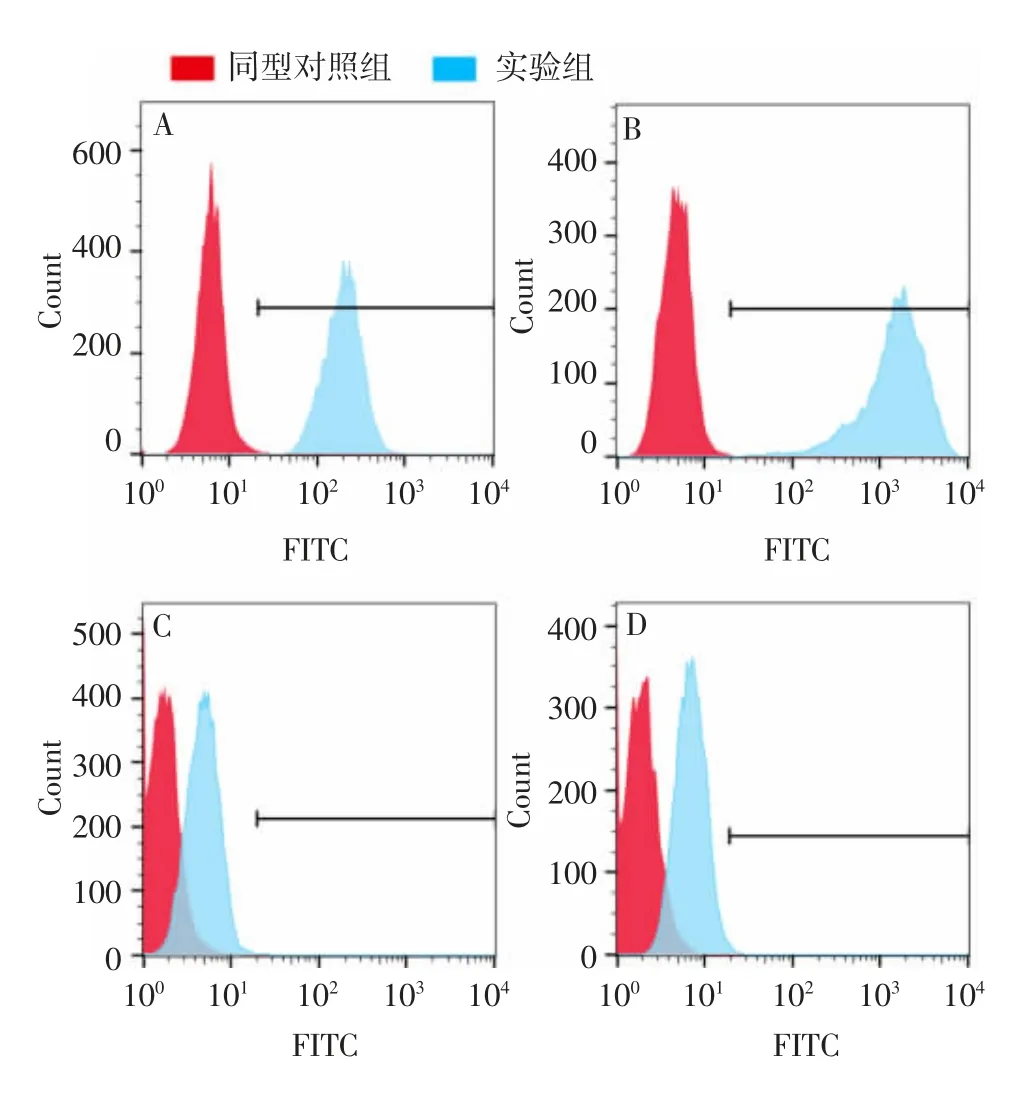
图3 流式细胞术检测第5代BMSCs的表面标记物表达情况Fig.3 Flow cytometry of surface markers of BMSCs of passage 5
2.4B M S C s的成骨成脂诱导分化 显微镜下观察可见,成骨诱导分化第21 d,细胞分泌生成的骨结节可被茜素红染成红色;成脂诱导分化第21天,细胞内的脂滴可被油红O染成红色。见图4。
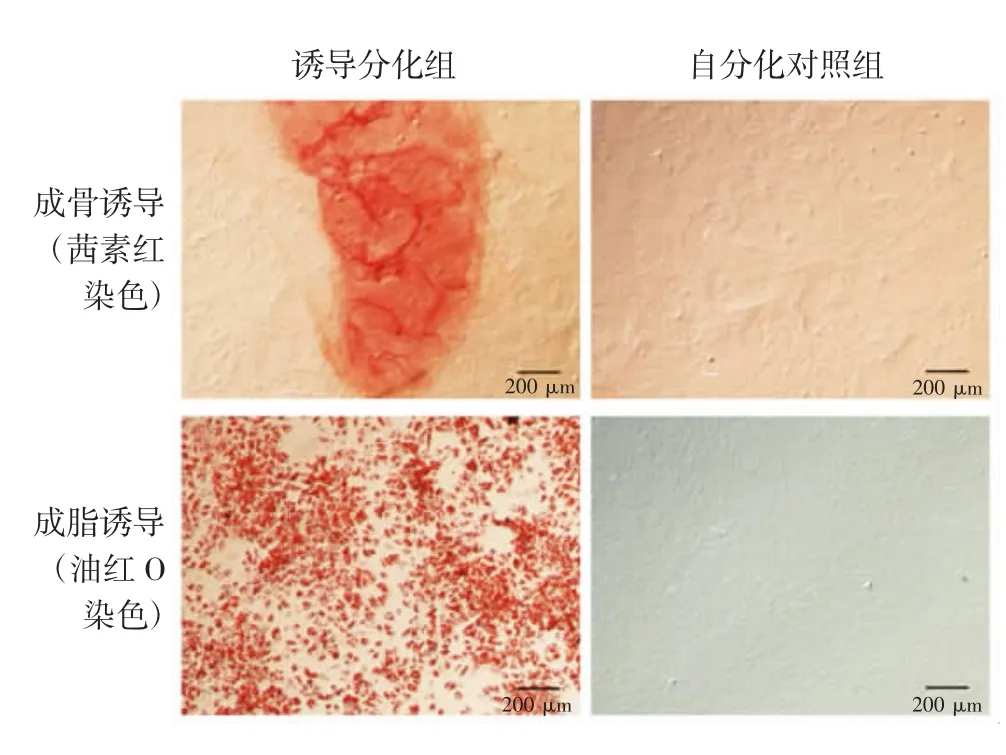
图4 BMSCs诱导分化后染色观察Fig.4 Staining of BMSCs after induced differentiation
2.5B M S C s的流式细胞术计数 流式细胞仪检测结果显示,BMSC-MPs的平均数目为(2.55±0.86)×107个/mL,见图5。BMSC-MPs的蛋白浓度为(289.36±12.58)μg/mL。2.6B M S C-M Ps的表面标记鉴定 流式细胞仪检测结果表明,BMSC-MPs表面标记CD90和CD29阳性率分别为(97.46±1.85)%和(94±2.03)%,CD45和CD34阳性率分别为(4.89±1.05)%和(1.81±0.33)%,呈现出与BMSCs相似的表面标记特征。见图6。

图5 BMSC-MPs的流式细胞仪计数Fig.5 Counting of BMSC-MPs by flow cytometer

图6 流式细胞术分析BMSC-MPs表面抗原的表达Fig.6 Flow cytometry of expression of surface markers of BMSC-MPs
3 讨论
BMSCs是一类具有自我更新能力的细胞,FRIDENSHTEÍN等[10]在1968年首次发现BMSCs,其来源于胚胎时期的中胚层,是一类增殖力较强的细胞。BMSCs具有易于获取,生物活性稳定等优点,并可分化为骨、脂肪、软骨和心肌等多种类型的细胞。本研究采用全骨髓贴壁法法获取BMSCs,通过流式细胞术检测表明,BMSCs高表达CD29和CD90,低表达CD45和CD34,且具有分化为成骨成脂细胞的能力,符合国际细胞治疗协会(International Society for Cellular Therapy,ISCT)对MSCs的鉴定标准[11]。
目前的研究发现,BMSCs除可通过释放一些细胞因子发挥作用外,还可释放胞外囊泡发挥细胞间的通讯作用[12]。BMSCs释放的胞外囊泡分为外泌体和MPs,外泌体的释放过程较为复杂,是细胞通过内吞作用在细胞内依次形成早期核内体、晚期核内体以及多泡体,再与细胞膜融合后释放[13];而MPs则是直接从细胞膜上“出芽”形成的小囊泡,有研究表明,细胞MPs的释放与细胞内Ca2+水平和细胞膜表面磷酯酰丝氨酸的外翻有关[14-15]。
MPs的提取目前尚无标准方案,常用的方法是梯度离心法,使用不同的离心力逐步将细胞碎片、凋亡小体去除,最后高速离心即可分离出MPs[16]。由于MPs是由细胞上出芽生成的膜性囊泡,因此,MPs囊泡膜上往往携带来源于细胞的表面标志。本研究采用流式细胞术结合荧光染色鉴定了BMSCs的表面标志蛋白分子,证实所获取的MPs绝大多数(94%以上)来自BMSCs的释放。通过采用流式细胞术检测MPs数量及BCA法检测MPs内蛋白含量间接对BMSC-MPs进行了定量。
本研究在成功分离纯化了BMSCs的基础上,通过梯度离心法获得了BMSC-MPs,并利用其表面标志进行了鉴定,为后续研究BMSC-MPs的功能奠定了基础。
