基于电融合方法的牛妊娠相关糖蛋白单克隆抗体制备及其应用
2022-02-08尹茉莉聂元旺周婉婷冀慧敏刘方圆王会岩
尹茉莉 , 聂元旺 , 周婉婷 , 张 爽 , 刘 磊 , 冀慧敏 , 刘方圆 , 王会岩
(1.吉林医药学院 吉林省抗体工程科技协同创新中心 , 吉林 吉林 132013 ; 2. 吉林省吉林市园林管理中心 ,吉林 吉林 132013 ; 3. 吉林特研生物技术有限责任公司 , 吉林 长春 130112)
随着生活水平的提高,人们对奶制品需求量增加,其中96%的奶制品以牛奶为原料。早期妊娠诊断可以降低奶牛的空怀率,缩短产犊周期,增加牧场养殖的经济效益[1]。牛妊娠相关糖蛋白(Bovine pregnancy-associated glycoproteins,bPAG) 基因家族已发现至少有22个不同转录体以及变异体,主要功能是维持妊娠和免疫调节[2-5]。bPAG可在妊娠母牛外周血液中被检测到,从妊娠开始,bPAG浓度缓慢上升,随着妊娠期的持续,其浓度出现波动,但其平均浓度不断上升,分娩时达到最大浓度。血浆中bPAG浓度是早期妊娠诊断和妊娠监测的可靠生物标志物[6]。
目前,早期妊娠诊断方法主要有观察法、孕酮测定法、超声波扫描法和酶联免疫法(Enzyme linked immunosorbent assay,ELISA)等[2]。由于ELISA具有快速、灵敏、简便等优点,并且能准确地检测奶牛血液中bPAG浓度及相对浓度的变化而被推广应用。目前,商品化的bPAG-ELISA检测试剂盒主要由美国爱德士和百奥特英公司生产,但因应用进口试剂盒检测的成本过高,许多养殖企业并未使用。国内该种类检测试剂盒尚处于研究阶段,无商品化的报道[7-9]。为此,建立本国自主品牌的bPAG-ELISA检测试剂盒是迫切需要解决的问题。
由于国内外市场上没有售卖可配对的bPAG单克隆抗体,本试验旨在通过电融合方法制备能识别天然bPAG的单克隆抗体,确定最佳配对抗体,以建立双抗夹心ELISA方法,为研发bPAG检测试剂盒提供科学依据。
1 材料与方法
1.1 主要试剂 奶牛胎盘子叶从吉林市春光乳业有限责任公司采集,经分离纯化获得bPAG天然抗原,纯度达95%,-80 ℃冰箱保存;HRP标记山羊抗小鼠 IgG、鼠类mAb抗体亚类鉴定试剂盒,均购自美国默克公司;蛋白A(Protein A)亲和层析柱,购自苏州纳微科技股份有限公司;牛早孕检测试剂盒,购自北京爱德士元亨生物科技有限公司。
1.2 主要仪器 超净工作台(型号为SW-CJ-2F),购自安泰空气技术有限公司;CO2培养箱(型号为MCO-18AIC),购自日本松下健康医疗器械株式会社;细胞计数仪(型号为IC1000),购自上海乐纯生物技术有限公司。
1.3 实验动物及细胞 雌性BALB/c小鼠(6~8周龄),购自上海斯拉克实验动物有限公司,实验动物使用许可证号:SYXK(吉)2017—0002;Sp2/0细胞由吉林医药学院吉林省抗体工程科技协同创新中心保存。
1.4 血样采集 采集64头人工授精后28~45 d的奶牛血液样品,分离血清后使用牛早孕检测试剂盒进行检测。在采血当天用 B 超仪对采样奶牛进行妊娠检查,在人工授精后第48天用B超进行复检。
1.5 试验方法
1.5.1 免疫动物 在首次免疫中,用等剂量完全弗氏佐剂乳化的50 μg bPAG腹腔注射免疫雌性BALB/c小鼠。之后每14天使用不完全弗氏佐剂乳化的bPAG免疫1次。第3次免疫后,取小鼠尾血测定血清抗体效价,当效价达到要求时,再加强免疫1次。
1.5.2 细胞电融合及杂交瘤细胞筛选 分离免疫小鼠脾脏细胞与SP2/0骨髓瘤细胞按3∶1的比例混合,经链霉蛋白酶E(Pronase E)激活后,在LF498-3铂电极融合室进行电融合。融合细胞密度由电融合缓冲液调整为2×107个/mL。电融合参数设置为0.8 MHz交流电压50 V 20 s,直流脉冲电压450 V 2次0.5 s,融合后50 V 0.8 MHz 7 s。将经过电融合的细胞悬液从融合室移至已预热含20%胎牛血清的RPMI 1640培养基中,在铺有分离的小鼠腹腔原代细胞作为滋养细胞的96孔板中培养。24 h后每孔需补充HAT选择培养基。融合7~9 d后用间接ELISA方法筛选阳性杂交瘤细胞。使用包被液稀释纯化的 bPAG天然抗原至浓度为2 μg/mL 后,加入聚苯乙烯板。杂交瘤细胞培养上清进行1∶10、1∶200、1∶800稀释作为一抗。HRP 标记的山羊抗小鼠 IgG(1∶5 000)作为二抗,TMB 底物显色,检测OD450 nm值≥1判定为阳性。记录阳性杂交瘤细胞的集落总数,按公式(1)计算杂交瘤细胞融合效率。
杂交瘤细胞融合效率/%=(杂交瘤集落总数÷脾脏细胞数)×100%
(1)
1.5.3 bPAG单克隆抗体的制备及鉴定 将1×106个/mL阳性杂交瘤细胞接种已提前注射石蜡油的BALB/c小鼠,7~15 d后抽取腹水。用Protein A亲和层析柱纯化腹水,SDS-PAGE分析抗体纯度。Western blot检测抗bPAG单克隆抗体的特异性。使用半干法(100 mA,30 min)将从牛胎盘组织中粗提的天然bPAG蛋白转移至 PVDF 膜上,加入纯化的抗bPAG 单克隆抗体(1∶2 000);二抗为HRP标记的山羊抗小鼠IgG(1∶5 000);ECL显色,观察结果。用鼠类mAb抗体亚类鉴定试剂盒分析抗体的免疫球蛋白亚类。间接ELISA方法测定单克隆抗体效价。参照参考文献[10]的ELISA方法检测单抗与bPAG的亲和力。
1.5.4 酶标bPAG单克隆抗体效价检测 制备的bPAG单抗用高碘酸钠法标记HRP后作为检测抗体[11]。bPAG抗原包被浓度为2 μg/mL,将酶标单抗从1∶200起进行2倍倍比稀释,共设12个稀释度,每个稀释度重复3次,同时设免疫小鼠血清作为阳性对照,封闭液作为空白对照。OD450 nm值≥1.0时,作为最佳抗体稀释度。
1.5.5 双抗夹心ELISA方法的初步建立 将获得的单克隆抗体作为捕获抗体包板,浓度为5 μg/mL,4 ℃过夜。将抗原bPAG稀释成浓度为10 μg/mL,同时设免疫小鼠血清作为阳性对照,封闭液作为空白对照。加入HRP标记的单克隆抗体进行两两配对,确定可用于建立夹心ELISA方法的配对抗体。当OD450 nm值≥1时,作为强阳性(P),OD450 nm值≤0.15时,作为阴性(N)。抗体的工作浓度采用棋盘滴定法[12]确定,根据OD450 nm值≥1,且P/N>2.1时,判定为最佳工作浓度。初步建立夹心ELISA检测方法。
符合率/%=(真妊娠数+真未妊娠数)÷检测总数×100%
(2)
2 结果
2.1 细胞电融合及杂交瘤细胞筛选 使用本实验室优化的电融合技术进行细胞融合,经计算杂交瘤细胞融合效率为0.34%。经间接ELISA筛选,获得43个识别bPAG 抗原IgGs的杂交瘤克隆(图1A)。将杂交瘤细胞培养上清进行1∶10、1∶200、1∶800稀释,间接ELISA筛选获得5株强阳性单克隆抗体,分别命名为2D7、3G1、5G1、4A10和10H2(图1B)。
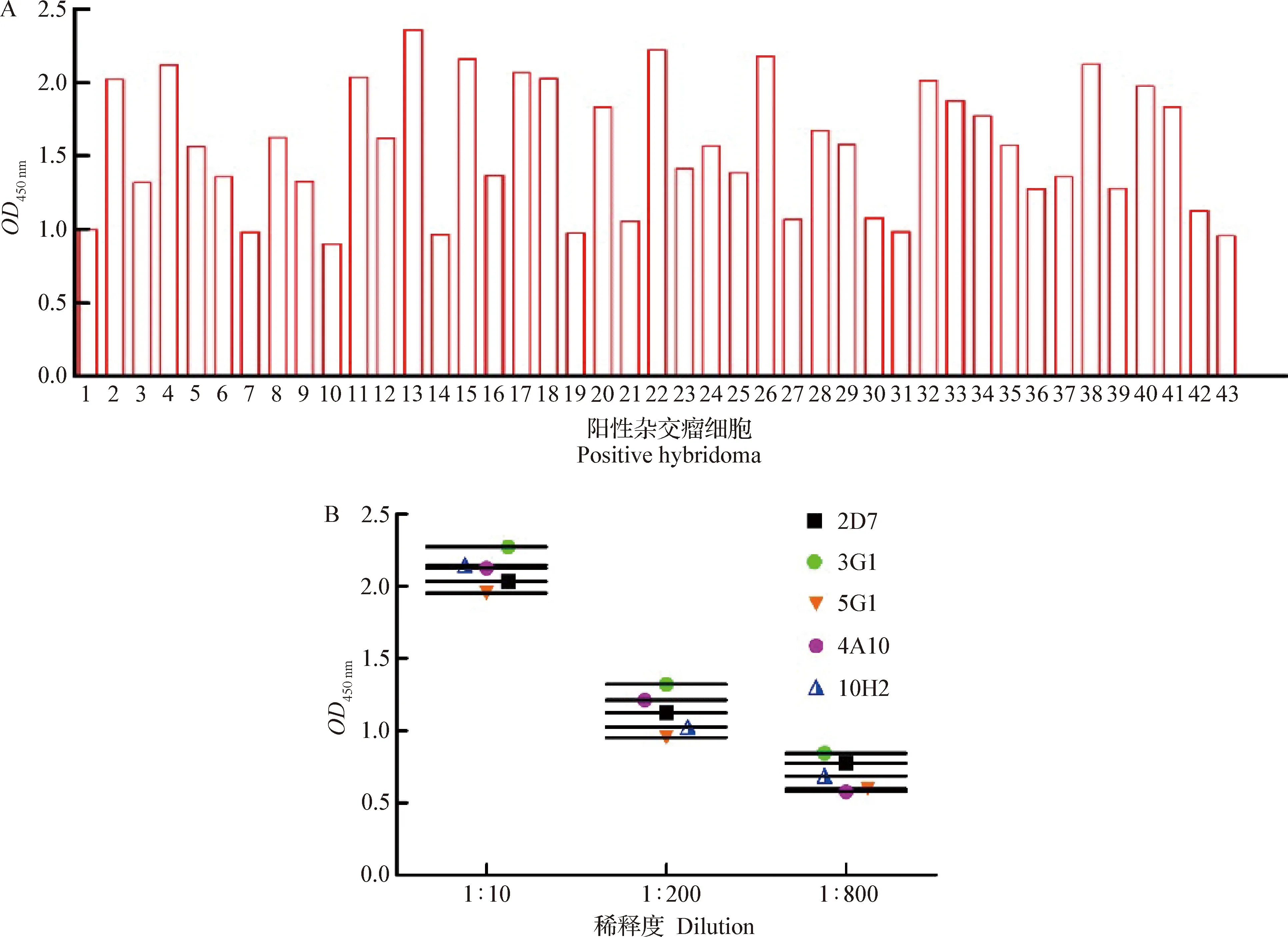
图1 阳性杂交瘤细胞株的筛查Fig.1 Screening of positive hybridoma cell linesA:阳性杂交瘤细胞株; B:5株强阳性杂交瘤细胞A:Positive hybridoma cell lines; B:Five strong positive hybridoma cell lines
2.2 bPAG单克隆抗体的制备及鉴定 腹水纯化后,经SDS-PAGE鉴定,在55 kDa和25 kDa附近有2条清晰的条带,分别为抗体的重链和轻链,污染蛋白很少(图2)。Western blot结果如图3所示,纯化所得的5株单克隆抗体均能特异性识别bPAG天然蛋白,在35 kDa处均出现目的条带,这与报道从妊娠奶牛、山羊、绵羊胎盘组织中分离纯化多种PAG亚型分子量为35~76 kDa相符[13]。由表1可知,2D7、5G1和10H2亚类均为IgG1,3G1亚类为IgG2b,4A10亚类为IgG2a。间接ELISA法检测5株单克隆抗体效价,3G1和5G1效价为1∶256 000,2D7、10H2和4A10效价为1∶128 000(表1)。2D7、3G1、5G1、4A10和10H2抗体亲和力分别为1.63×107L/mol、3.75×107L/mol、1.74×107L/mol、5.83×106L/mol和2.76×107L/mol(表1)。
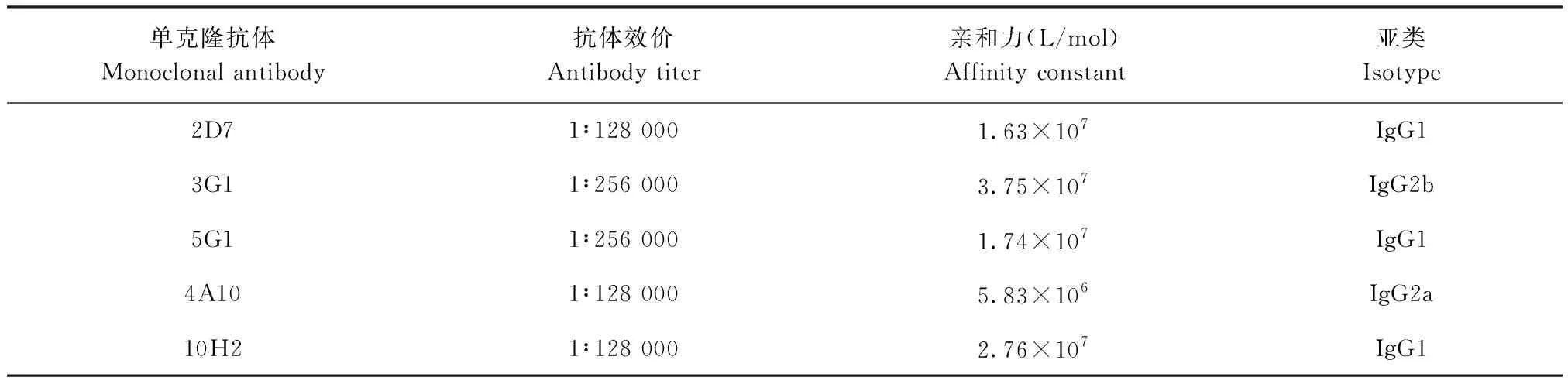
表1 5株bPAG单克隆抗体的鉴定Table 1 Assessment of five monoclonal antibodies against bPAG
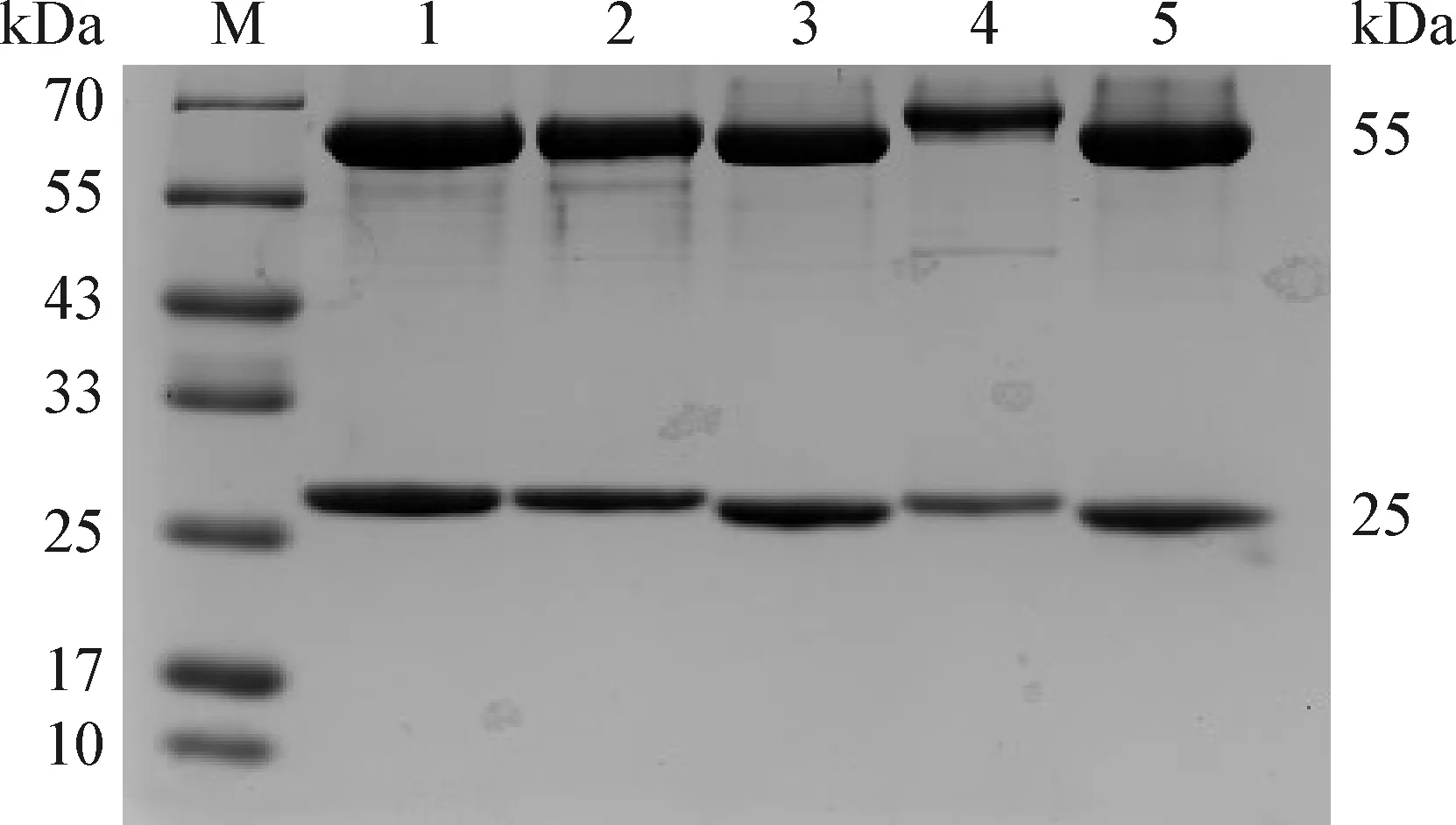
图2 SDS-PAGE分析5株纯化后的单克隆抗体Fig.2 SDS-PAGE analysis of five purified monoclonal antibodiesM:Protein Marker; 1:2D7; 2:3G1; 3:5G1; 4:4A10; 5:10H2
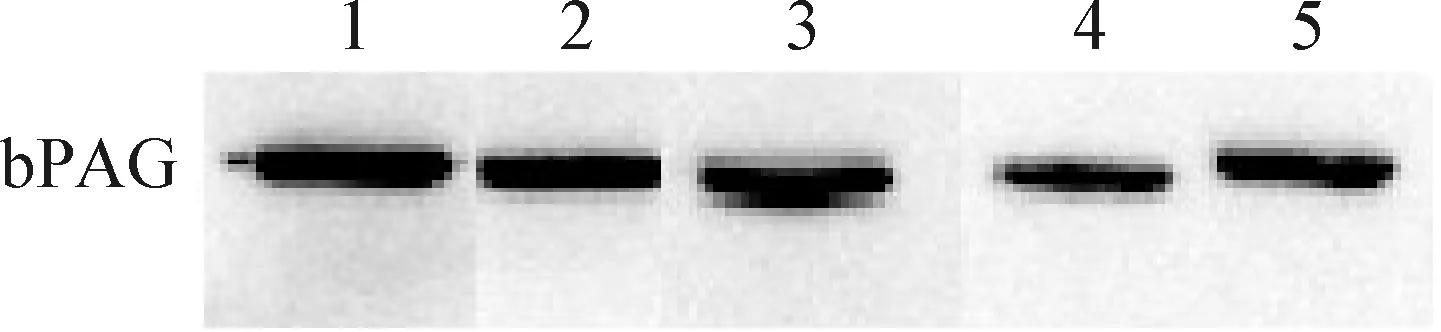
图3 Western blot 检测单克隆抗体特异性Fig.3 Western blot analysis of specificity of monoclonal antibodies 1:2D7; 2:3G1; 3:5G1; 4:4A10; 5:10H2
2.3 酶标bPAG单克隆抗体效价检测 如图4所示,酶标抗体HRP-2D7、HRP-3G1、HRP-5G1、HRP-4A10和HRP-10H2最佳稀释倍数分别为1∶6 400、1∶12 800、1∶6 400、1∶6 400和1∶12 800。
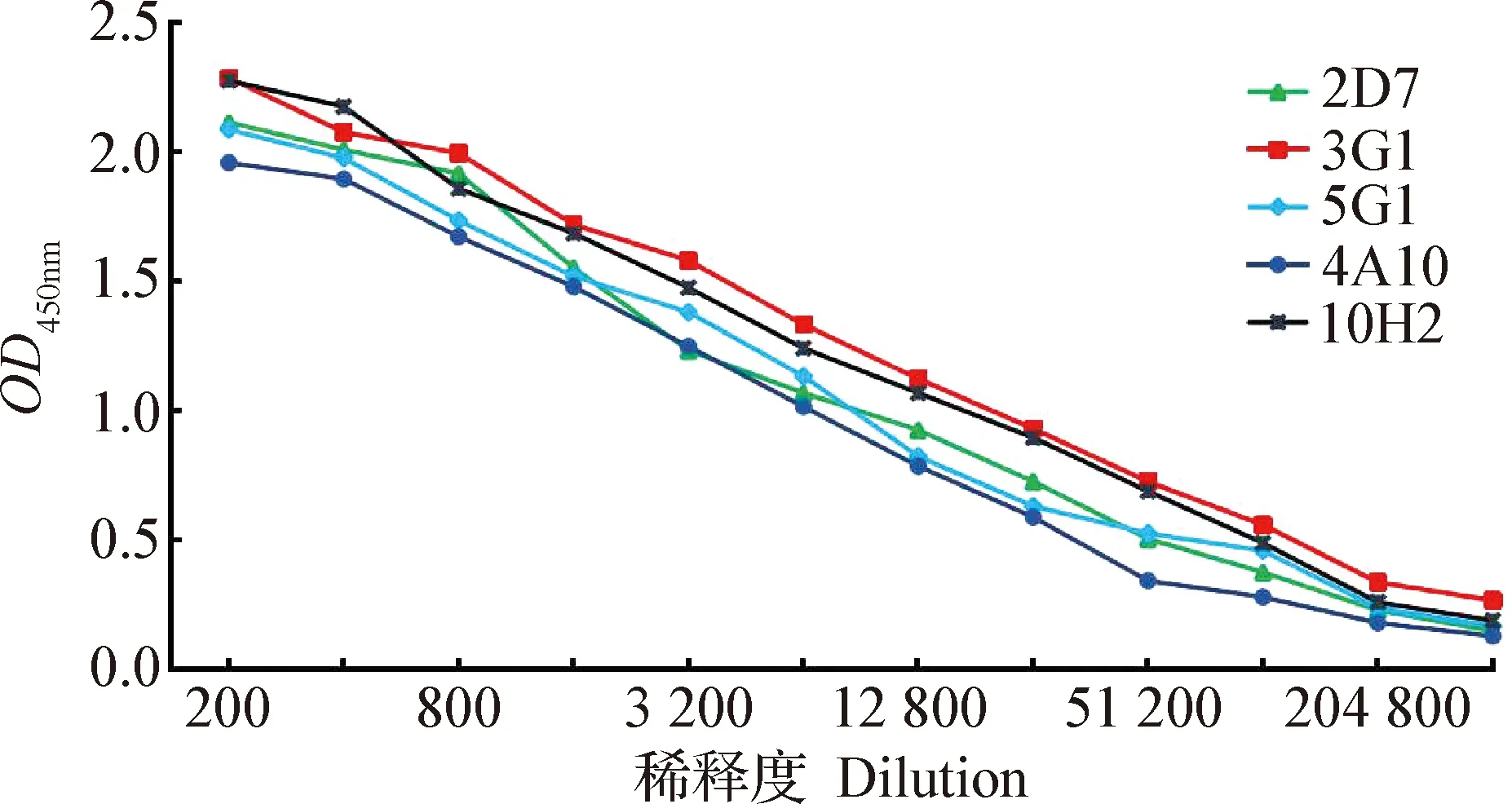
图4 酶标抗体效价检测Fig.4 Determination of enzyme-labeled antibody titers
2.4 双抗夹心ELISA检测方法的初步建立 如表2所示,以10H2作为捕获抗体与HRP标记的5G1配对成功,可用于建立双抗夹心ELISA方法。包被不同浓度的单克隆抗体10H2与不同稀释倍数的HRP-5G1单抗作棋盘滴定法确定抗体的工作浓度。结果如表3所示,单抗10H2包被浓度为2 μg/mL,HRP-5G1单抗最佳稀释倍数为1∶4 000。
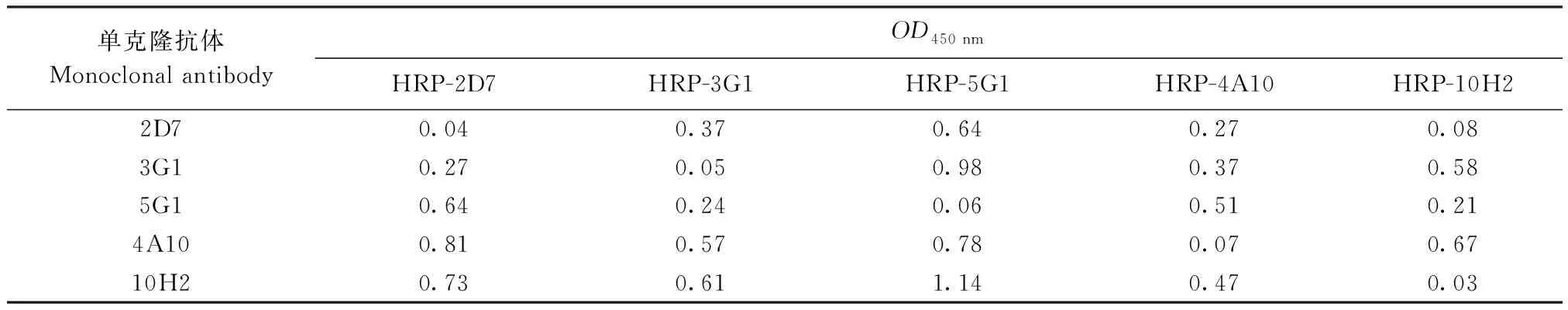
表2 单克隆抗体配对结果Table 2 Results of monoclonal antibody coupling
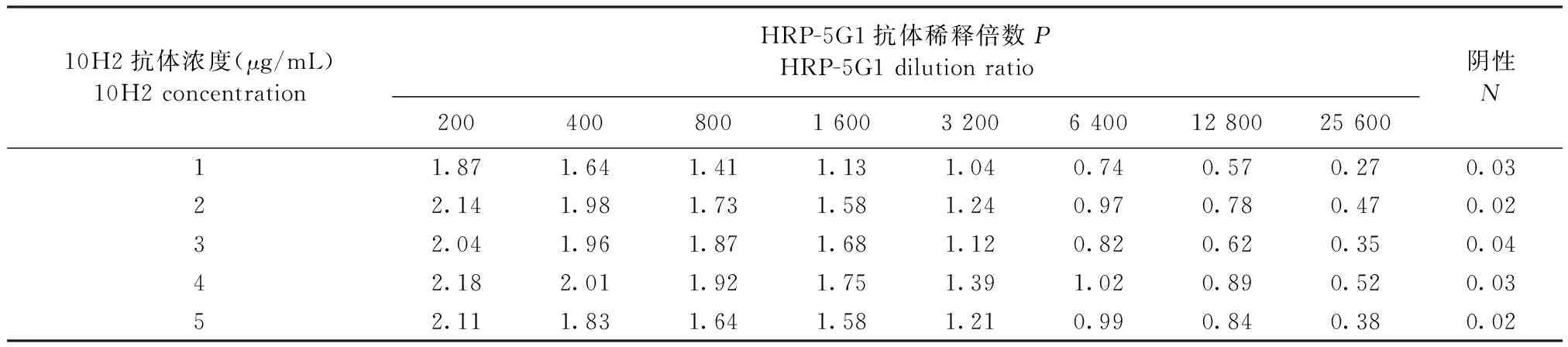
表3 单克隆抗体适宜浓度Table 3 Suitable concentration of monoclonal antibody
2.5 双抗夹心ELISA方法检测血清样品 根据爱德士牛早孕检测试剂盒判断结果制定双抗夹心ELISA方法的阴性、阳性检测结果的判断标准,检测OD450 nm值>0.7判为阳性,检测OD450 nm值<0.5判为阴性,结果见图5。以B超检测结果作为真实妊娠判定标准,发现爱德士牛早孕检测试剂盒与B超检测结果比较符合率为98.4%(63/64)。双抗夹心ELISA方法测定的妊娠结果中有2个假阳性结果,2个假阴性结果,与B超检测结果比较符合率为93.8%(60/64),与爱德士牛早孕检测试剂盒比较符合率为95.2%(60/63),结果见表4。
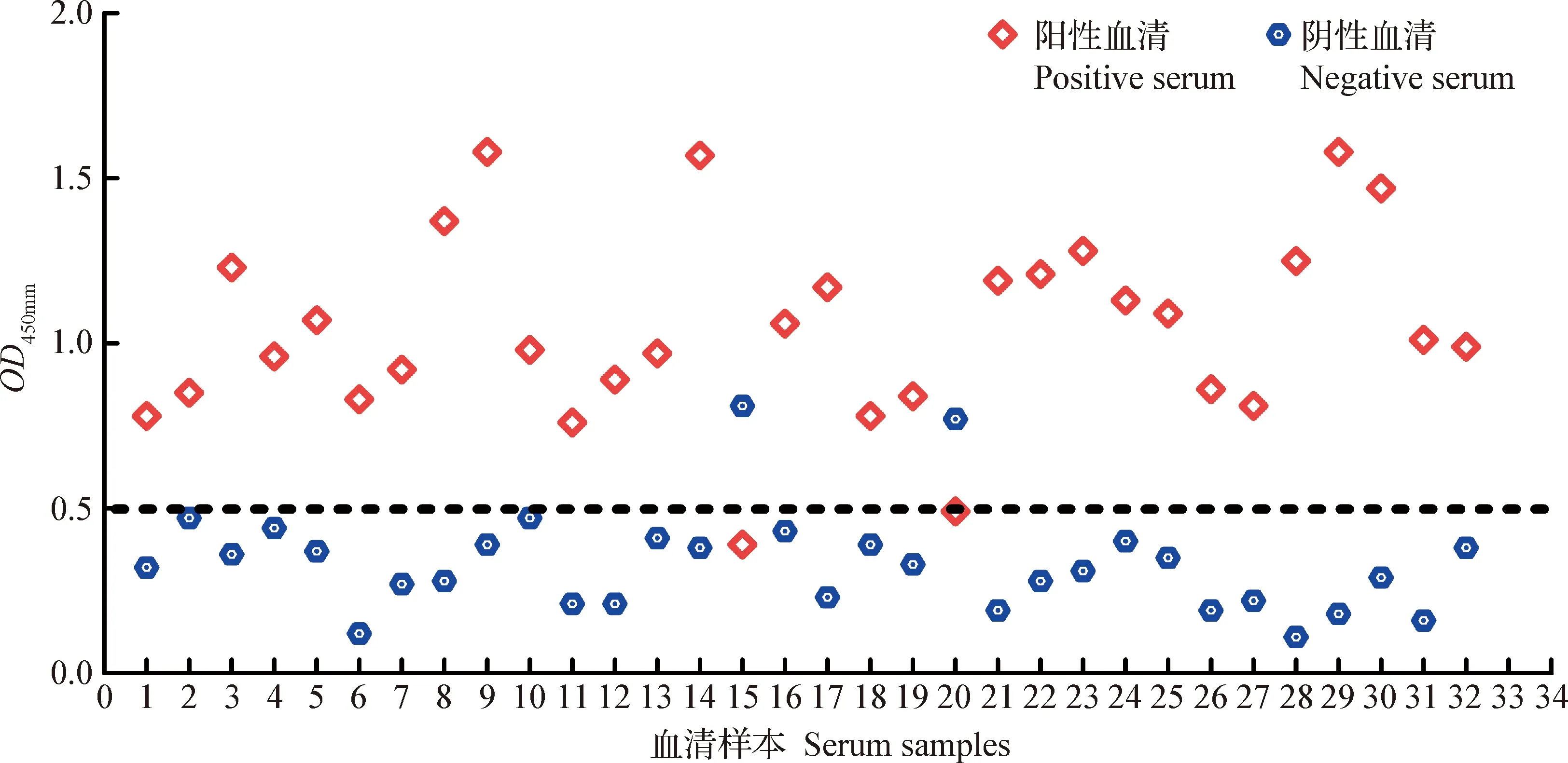
图5 双抗夹心ELISA检测牛血清结果Fig.5 Results of cow serum samples detected by double antibody-sandwich ELISA

表4 3种检测方法的比较Table 4 Comparison of three detection method
3 讨论
PAG属于无活性天冬氨酸蛋白酶家族,与胃蛋白酶有50%以上的相同氨基酸序列,其中bPAG种类繁多,其家族成员同源性较高,在牛妊娠期,每种bPAG的浓度及功能尚不明确[14-15]。从妊娠后的多种母畜胎盘胎儿子叶中可以分离提取PAG天然蛋白,PAG作为多种动物的妊娠诊断标志物,研发血清中PAG的检测方法一直备受关注[16]。本试验为了获得能够识别天然bPAG的单克隆抗体,从妊娠母牛胎盘子叶中分离提纯bPAG,免疫小鼠,取其脾细胞与SP2/0细胞通过电融合法进行细胞融合。
单克隆抗体制备的经典方法是PEG诱导的细胞融合技术,但其融合效率低,对细胞有毒害作用,很难获得令人满意的抗体[17]。电融合技术是一种高效、可复制、无毒的细胞融合技术,不仅提高了融合细胞的数量,而且提高了杂交瘤的生长速度,更容易获得具有高度亲和力的单克隆抗体[18]。交变电场强度、融合仪器型号、细胞类型及比例、脉冲强度等融合参数会直接影响细胞融合率。在进行电融合时,需要摸索各项条件,选择最适试验参数。本试验选择交流电场强度为50 V,直流脉冲强度为450 V,脾脏细胞和SP2/0骨髓瘤细胞以3∶1的比例进行电融合,细胞融合率达到0.34%,杂交瘤细胞状态饱满,呈对数生长。间接ELISA筛选到5株强阳性抗bPAG单克隆抗体。为验证单抗与天然形式bPAG结合的特性,本试验使用含磷酸酶和蛋白酶抑制剂的裂解液裂解牛子叶组织,获得的粗提蛋白进行单克隆抗体特异性鉴定。
针对bPAG开发的爱德士牛早孕ELISA检测试剂盒诊断准确率可达97.8%[19],从养殖场取回的阴性、阳性血清样本经过爱德士牛早孕检测试剂盒判断后,再由本实验室建立的双抗夹心ELISA检测方法验证,比较检测结果的符合率。在64个样本检测过程中有4个样本与B超检测真实妊娠结果不符合,爱德士牛早孕检测试剂盒与B超检测结果符合率为98.4%,双抗夹心ELISA方法与B超检测结果符合率为93.8%。为获得更高度一致性的检测结果,我们需要继续优化检测方法,包括抗体的包被浓度、酶标二抗的工作浓度、抗原抗体反应时间、显示时间等。目前,检查母羊妊娠第18天血清中PAG和孕酮浓度已有报道,还未见测定妊娠母牛PAG浓度的报道[20]。本课题组将在后续试验中进行大量样本验证,以优化技术参数,建立定性、定量的bPAG检测方法。
