湖南省长沙市野猪源蛔虫分子鉴定
2022-08-30龚腾芳贺峻琳陈叔玉
薛 爽,龚腾芳,贺峻琳,陈叔玉,刘 伟
(1. 长沙市动植物疫病预防控制中心,湖南 长沙 410000 ; 2. 湖南农业大学动物医学院,湖南 长沙 410128)
蛔虫隶属于线虫纲,蛔目,蛔科,是一种常见的肠道寄生线虫[1]。猪感染蛔虫后可引起消瘦、贫血、腹泻、精神沉郁、生长不良等症状,严重时可阻塞肠道引起仔猪死亡,给养猪业造成重大的经济损失[2-3]。
仅通过形态难以区分猪蛔虫和人蛔虫。研究表明,人蛔虫可感染猪,猪蛔虫也可感染人,并且有报道表明人蛔虫和猪蛔虫之间可以杂交,长期以来这2个物种是否为同一物种一直存在争议[4-6]。随着分子生物学的飞速发展,分子诊断技术可以弥补形态学鉴定的不足和缺点,更适合相似物种的精确鉴定。近年来,越来越多的学者使用全基因组或单个保守基因序列研究蛔虫的种系遗传结构。Betson等利用线粒体cox1基因和一组微卫星标记对来自欧洲、非洲、亚洲和拉丁美洲的410条蛔虫样品进行了基因分型,发现不同国家、村庄和宿主的寄生虫种群之间存在显著的遗传分化[7]。Zhou等选用核糖体内部转录间隔区(ITS)和多个微卫星标记首次表明了人型蛔虫和猪型蛔虫杂交体可以感染猪和人类[8]。
野猪作为我国的保护动物,是生态链中重要的一环。蛔虫寄生会影响野猪生长发育甚至造成野猪死亡,同时随着野猪的活动可将蛔虫卵排入环境中,导致其他动物甚至人的感染,造成严重危害[9-10]。为了探究野猪体内蛔虫与其他蛔虫的种群遗传关系,本试验对湖南省长沙市浏阳野猪肠道内蛔虫的线粒体部分cox1基因(pcox1)、部分nad5基因(pnad5)和ITS基因进行PCR扩增和测序,对序列进行分析以确定野猪源蛔虫与其他蛔虫的物种关系,为野猪源蛔虫防控研究提供了科学依据。
1 材料与方法
1.1 虫体样本 本试验的样品分别采自湖南省长沙市浏阳市某养殖场病死的2头野猪,其中4条雄蛔虫和5条雌蛔虫,分别编号为CS1~CS4(雄蛔虫)和CS5~CS9(雌蛔虫),参照资料对其进行形态学鉴定后,置于-20 ℃冰箱保存。
1.2 主要试剂 DNA提取试剂盒,购自天根生化科技有限公司;TaqDNA聚合酶和PCR试剂,均购自宝生物工程(大连)有限公司;蛋白酶K,购自Merck公司;3对引物由北京擎科生物有限公司合成。
1.3 PCR扩增 参照参考文献[11-13]设计合成3对引物,见表1。3个基因的扩增体系均为25 μL:TaqPCR Master Mix 12.5 μL、上、下游引物各0.5 μL,模板DNA 1 μL,ddH2O 10.5 μL。扩增条件:94 ℃预变性5 min;94 ℃变性30 s(pcox1、pnad5)或40 s(ITS);50 ℃(pcox1、ITS)或55 ℃(pnad5)退火30 s;72 ℃延伸30 s(pcox1)、1 min(pnad5)、5 min(ITS),共38个循环;最后72 ℃延伸5 min(pcox1、pnad5)或10 min(ITS)。
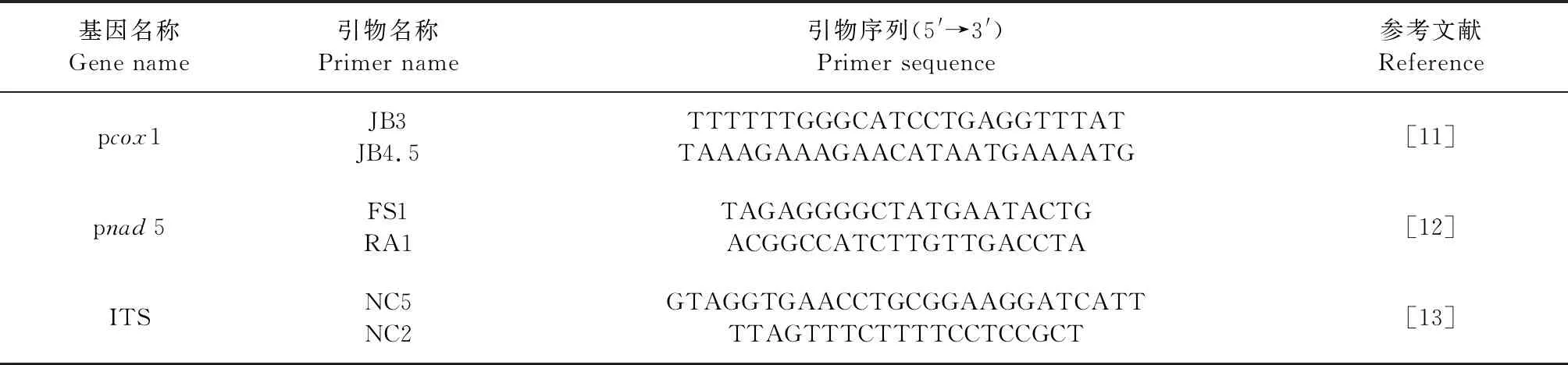
表1 3段基因扩增的引物
1.4 基因测序及分析 PCR阳性产物由北京擎科有限公司双向测序。用DNAMAN 7.0对获得的pcox1、pnad5和ITS基因序列进行对比,剔除和对齐,并与GenBank收录的人蛔虫(Ascarislumbricoides)和猪蛔虫(Ascarissuum)的pcox1、pnad5和ITS基因进行对比。用DNASTAR 5.0软件进行基因同源性分析;利用DnaSP 5.0软件计算基因多样性;以狮弓蛔虫(Toxascarisleonina)为外群,选用Kimura-2-parameter模型,用MEGA 7.0构建种系发育进化树(Bootstrap test=1 000)。
2 结果
2.1 PCR扩增 野猪源蛔虫分离株扩增的pcox1、pnad5和ITS基因片段如图1~3所示,大小分别约为400 、480 bp和900 bp,未见非特异性条带,空白对照为阴性。
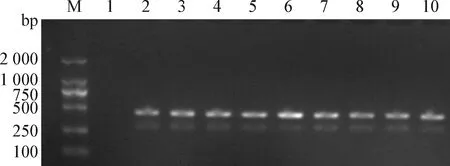
图1 野猪源蛔虫线粒体pcox1 PCR扩增产物的凝胶电泳图
2.2 基因的多样性分析 经过对比校正后,9株野猪源蛔虫分离株pcox1、pnad5和ITS基因片段大小分别为391、491 bp和867 bp;pcox1基因的A+T碱基含量为66.70%~67.00%,C+G碱基含量为33.00%~33.20%;pnad5基因的A+T碱基含量为70.50%~71.10%,C+G碱基含量为28.90%~29.30%;ITS基因的A+T碱基含量为58.90%~60.00%,C+G碱基含量为40.00%~40.10%。

图2 野猪源蛔虫线粒体pnad 5 PCR扩增产物的凝胶电泳图

图3 野猪源蛔虫核糖体ITS PCR扩增产物的凝胶电泳图
9株野猪样品分离株的pcox1碱基差异率为0.00%~0.30%、pnad5为0.00%~0.60%、ITS为0.00%~0.04%。9株野猪样品分离株线粒体pcox1基因仅有1个碱基变异位点(位于343 bp处,共391 bp),为嘧啶之间的碱基替换,只有2种单倍型;9株野猪样品分离株线粒体pnad5基因有5个碱基变异位点,主要为嘌呤之间的碱基替换,共有6种单倍型;9株野猪样品分离株核糖体ITS基因仅有1个碱基变异位点(位于117 bp处,共867 bp),为嘧啶之间的碱基替换,只有2种单倍型,见表2。9株野猪样品分离株扩增序列与GenBank数据库收录的人蛔虫线粒体pcox1、pnad5和核糖体ITS基因序列碱基差异率分别为0.00%~0.30%、1.00%~1.60%和0.00%~0.07%,与猪蛔虫分离株相应序列碱基差异率分别为0.30%~1.80%(pcox1)、1.00%~7.20%(pnad5)和0.70%~1.30% (ITS)。

表2 pcox1、pnad 5和ITS基因序列核苷酸多态性
2.3 种系发育分析 基于pcox1、pnad5和ITS基因分别构建野猪源蛔虫系统发育树,如图4~6所示,野猪源蛔虫和人蛔虫分离株均聚合在同一分支上,与猪蛔虫分离株相隔较近,与狮弓蛔虫相隔较远。

图4 野猪源蛔虫pcox1基因系统发育树
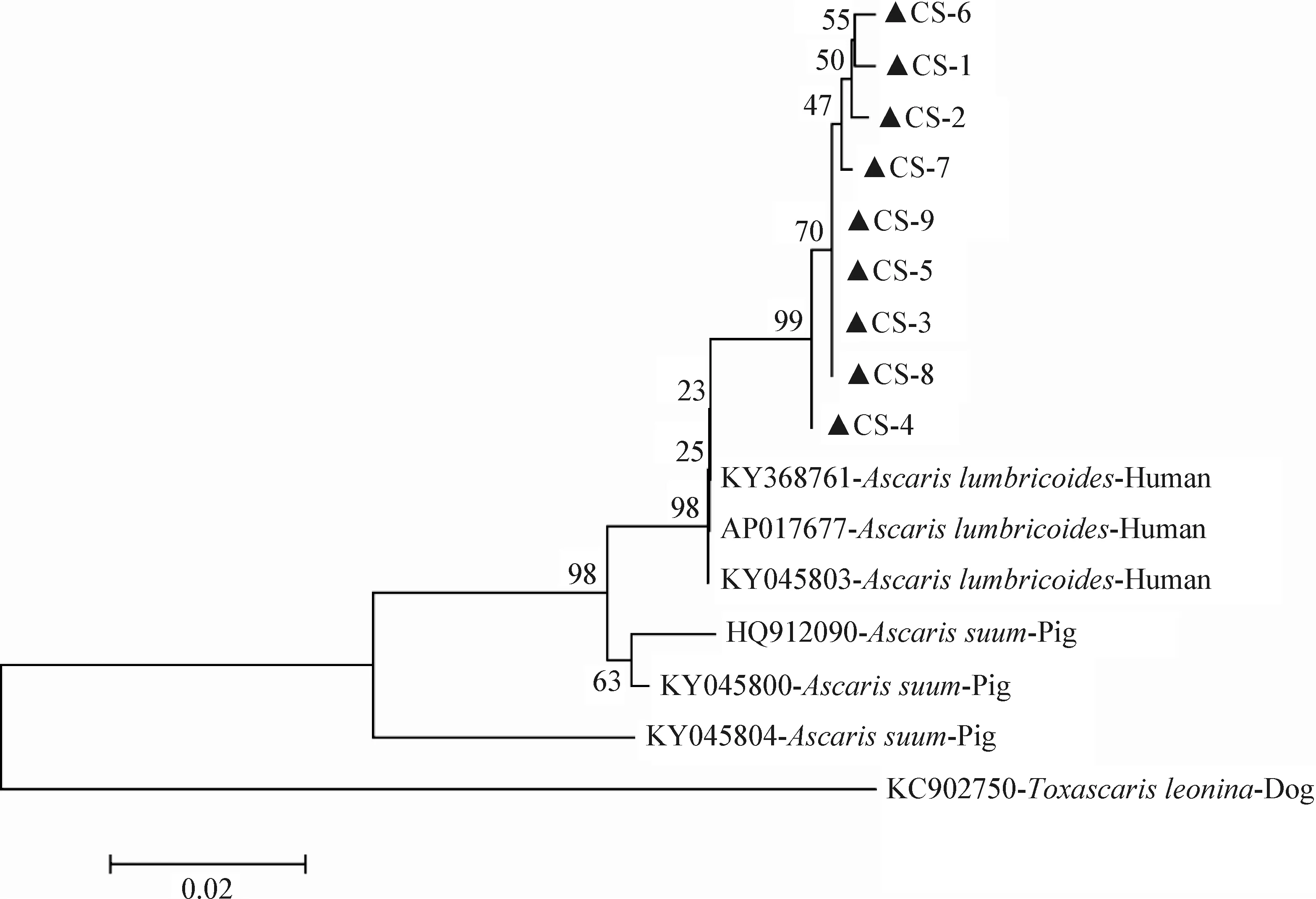
图5 野猪源蛔虫pnad 5基因系统发育树

图6 野猪源蛔虫ITS基因系统发育树
3 讨论
野猪源蛔虫的有效鉴定是对野猪蛔虫病进行预防的前提,但传统的形态学方法难以对形态相似的虫株进行准确的鉴定。线粒体基因由于相对保守、母系遗传等优点现已成为寄生虫分类与鉴定的有力工具[14-15]。本试验扩增的9株野猪源蛔虫线粒体pcox1和ITS基因片段碱基差异率分别为0.00%~0.30%和0.00%~0.04%,其差异主要为碱基互换,表明野猪源蛔虫pcox1和ITS基因种内高度保守, pnad5基因片段碱基差异率为0.00%~0.60%,种内相对保守;与人蛔虫分离株pcox1、pnad5和ITS基因序列碱基差异率分别为0.00%~0.30%、1.00%~1.60%和0.00%~0.07%,和猪蛔虫对应的基因序列碱基变异率分别为0.30%~1.80% (pcox1)、1.00%~7.20%(pnad5)和 0.70%~1.30%(ITS)。可见野猪源蛔虫pcox1、pnad5和ITS基因种内变异较小,与人蛔虫和猪蛔虫碱基差异率均较小,但与人蛔虫碱基差异率更小。此外,本试验中9株野猪源蛔虫分离株pcox1、pnad5和ITS基因序列核苷酸多样性均低于0.01,结果表明野猪源蛔虫pcox1、pnad5和ITS基因遗传变异程度低。
基于野猪源蛔虫pcox1、pnad5和ITS基因构建的系统进化树显示,本试验分离的9株野猪源蛔虫样品均与人蛔虫聚合为同一分支,然后与猪蛔虫聚合为一大支,与狮弓蛔虫相隔较远。目前国内仅存在通过形态学鉴定的野猪感染蛔虫的案例报道,且均鉴定为猪蛔虫[2-3]。本试验首次通过线粒体pcox1、pnad5和核糖体ITS基因对野猪源蛔虫进行鉴定和遗传变异分析。基于线粒体pcox1、pnad5和核糖体ITS基因分析结果表明野猪源蛔虫和人蛔虫、猪蛔虫同源性均很高。
人蛔虫和猪蛔虫的分类地位一直存在争议,研究者试图从多方面来进行比较,但结果不尽相同[16-17]。邹勇[13]分别对猪蛔虫和人蛔虫的线粒体pcox1和ITS基因序列进行比较,发现人蛔虫和猪蛔虫pcox1和ITS基因差异较小。吴昌义等[12]发现,猪蛔虫和人蛔虫线粒体pnad5基因差异较小。Easton等[4]报道,猪蛔虫和人蛔虫存在杂交复合体感染人类,使猪蛔虫和人蛔虫分类变得更加复杂。此外,线粒体基因存在渐渗杂交和基因渗透,也阻碍人蛔虫与猪蛔虫的准确鉴定和分类[15]。值得注意的是,Leles等[18]通过古生物学和遗传学证据并结合最新的研究数据认为,人蛔虫和猪蛔虫应为同一物种,仅有轻微的表型和基因型适应性变化。本试验采集样品来源和数目有限,且仅鉴定了3段基因。因此,需要采集更多的野猪源蛔虫样品,以及利用不同的鉴定方法(线粒体全基因组、核基因和微卫星标记等)分析野猪源蛔虫与人蛔虫和猪蛔虫的分类关系。
综上所述,本试验利用线粒体pcox1、pnad5和核糖体ITS基因序列对湖南省长沙市浏阳市野猪源蛔虫分离株进行种群鉴定和种群遗传结构研究,结果显示野猪源蛔虫遗传变异程度低,判断野猪源蛔虫为人蛔虫,需要更多的野猪源蛔虫样品和多种鉴定方法进一步鉴别。
