基于液质联用法测定乌头碱类生物碱在大鼠体内药代动力学研究
2022-02-08陈腾飞高云航侯红平张广平叶祖光
黄 鹤 陈腾飞 李 晗 李 林 高云航 宋 玲 侯红平 张广平 杨 红 叶祖光
(1 辽宁师范大学,大连,116000; 2 中国中医科学院,北京,100700)
草乌为毛茛科植物北乌头(AconitumkusnezoffiiReichb.)的干燥块根。草乌具有祛风除湿、温经止痛的功效,可用于风寒湿痹、关节疼痛、心腹冷痛、寒疝作痛及麻醉止痛,有大毒[1]。草乌中乌头碱是其主要毒性成分。制草乌为草乌的炮制加工品,由于其毒性没有生品大,常在临床中与其他药物配伍使用[2]。有研究表明,其具有镇痛、抗炎、强心、抗心律失常、抗肿瘤、降血糖、免疫调节等多种药理作用[3-7],临床应用广泛。由于乌头类生物碱治疗剂量和中毒剂量接近,用量过多可能很容易引起中毒[8-12]。
中医药和蒙医药理论认为草乌经炮制为制草乌后可使其毒性主要成分减少,用于临床治疗[13-14]。这就需要建立更灵敏的方法测出其主要毒性成分的浓度变化。基于上述原因,本实验建立了一个灵敏度较高的液相色谱-串联质谱(Liquid Chromatography-mass Spectrometry/Mass Spectrometry,LC-MS/MS)方法,同时测定草乌炮制后制草乌中的乌头碱、次乌头碱、苯甲酰乌头原碱3种主要毒性成分的浓度,此方法简单方便,灵敏度高,能够用于血浆中极低浓度的乌头碱、次乌头碱、苯甲酰乌头原碱的检测。
1 材料
1.1 动物 选取无特定病原体(Specific Pathogen Free,SPF)级雄性SD大鼠,体质量180~200 g,购自北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2016-0006。大鼠于动物房常规饲养,动物房通风良好,定期消毒。本实验所进行的所有相关操作均在中国中医科学院中药研究所动物伦理委员会的批准下进行(伦理审批号:20172001)。大鼠饲养条件为12 h明暗交替,温度为(23±1)℃,湿度为(50±15)%,自主饮水及进食。
1.2 仪器 液相色谱质谱联用仪,带有自动进样器和柱温箱(SCIEX公司,美国,型号:ExionLC-Qtrap 5500);离心机(Eppendorf公司,德国,型号:Centrifuge 5254R);电子天平(Mettler-Toledo公司,德国,型号:MS105DU);漩涡仪(SCIENTIFIC INDUSTRIES公司,美国,型号:Vortex-genie2 G560E);真空浓缩仪(Christ公司,德国,型号:RVC 2-18 CDplus)。
1.3 试药 乌头碱对照品(Sigma-Aldrich Co.公司,美国,含量:95.0%,批号:073M4401V);次乌头碱(成都普菲德生物技术有限公司,含量:98.0%,批号:19070507);苯甲酰乌头原碱(成都普菲德生物技术有限公司,含量:98.7%,批号:19101603);内标小檗碱(上海麦克林生化科技有限公司,含量:99.0%,批号:C11079944);甲醇(Merck,德国,色谱纯,批号:I0944807813);乙腈(Merck,德国,色谱纯,批号:JA066030);甲酸(ROE SCIENTIFIC,美国,色谱纯,批号:17M8207);异丙醇(Honeywell,德国,色谱纯,批号:SAJG1H);纯净水(中国杭州娃哈哈集团有限公司,批号:202006121119GQ);制草乌购于内蒙古蒙药股份公司,由辽宁中医药大学康延国教授鉴定。
2 方法
2.1 色谱与质谱条件 色谱条件:色谱柱为岛津Shim-pack Velox SP-C18 LC Column(100 mm×2.1 mm,2.7 μm);柱温40 ℃;自动进样器温度为6 ℃;进样体积10 μL;洗针液为甲醇∶乙腈∶异丙醇=1∶1∶1;流动相A∶水(0.05%甲酸);流动相B∶甲醇∶乙腈=1∶1(0.05%甲酸);流速0.3 mL/min;分析时间6 min。洗脱梯度见表1。

表1 梯度洗脱
质谱条件:离子源为ESI,正离子模式,气帘气40 psi,碰撞气6 psi,喷雾电压5 500 V,辅助气加热温度500 ℃,辅助气1为50 psi,辅助气2为50 psi(Pounds Per Square Inch,145 psi=1 MPa),扫描方式为选择反应监测(MRM)方式。用于定量分析的离子对分别为m/z 646.3/586.2(乌头碱),m/z 616.3/556.3(次乌头碱),m/z 604.3/554.1(苯甲酰乌头原碱)和m/z 337.2/321.0(小檗碱,内标)。
2.2 溶液配制
2.2.1 标准曲线工作溶液与质控工作溶液 分别精密称取乌头碱、次乌头碱、苯甲酰乌头原碱标准品约10 mg,各置10 mL量瓶中,加甲醇超声溶解后定容至刻度,得浓度为1 mg/mL的乌头碱、次乌头碱、苯甲酰乌头原碱储备液。依次取储备液100、100、200 μL,加甲醇混合后,再用甲醇稀释,得乌头碱、次乌头碱、苯甲酰乌头原碱浓度分别为1、1、2 μg/mL混合工作溶液MIX0。用甲醇将其逐级稀释成乌头碱、次乌头碱浓度分别为500、200、50、20、5、1、0.5 ng/mL,苯甲酰乌头原碱浓度为1 000、400、100、40、10、2、1 ng/mL的系列标准曲线工作溶液,以及乌头碱、次乌头碱浓度分别为375、50、1 ng/mL,苯甲酰乌头原碱浓度为750、100、2 ng/mL的质量控制(Quality Control,QC)工作溶液,-80 ℃冰箱保存。
2.2.2 含内标复溶液 精密称取小檗碱标准品约10 mg,置10 mL量瓶中,加甲醇超声溶解后定容至刻度,配制成浓度为1 mg/mL的小檗碱储备液。然后将储备液用50%甲醇(水)稀释成小檗碱浓度为0.5 ng/mL的含内标复溶液。
2.3 给药方法与血浆样品采集 取SD雄性大鼠6只,给药前禁食12 h,自由饮水。以1.016 9 g/kg的剂量经口给与制草乌混悬液,给药体积1 mL每100 g体质量,给药前采集空白血,给药后于5、15、30、45 min、1、2、4、6、8、24 h眼眶采血约0.25 mL,收集于肝素化处理的离心管中,采集的血液于4 ℃、9 391×g,离心10 min,分离血浆,-80 ℃冰箱保存。
2.4 血浆样品处理 精密吸取50 μL大鼠血浆样品,加入200 μL甲醇-乙腈混合溶液(1∶1,v/v),涡旋5 min,超声1 min,4 ℃、13 523×g,离心5 min,取上清200 μL,48 ℃、271×g减压浓缩至干燥,加入100 μL含内标复溶液,涡旋5 min,超声1 min,4 ℃、13 523×g,离心5 min,取上清进样。
2.5 方法学评价
2.5.1 专属性 取大鼠空白血浆,复溶液为50%甲醇(水),其他按“2.4 血浆样品处理”方法处理,得空白色谱;取低浓度QC样品,按“2.4 血浆样品处理”方法处理,得含药血浆色谱图;取给药后大鼠血浆样品,同上操作,得色谱图。
2.5.2 线性范围和定量下限 取系列浓度标曲工作溶液5 μL,分别加入45 μL空白血浆稀释10倍,得乌头碱、次乌头碱血浆浓度分别为50、20、5、2、0.5、0.1、0.05 ng/mL,苯甲酰乌头原碱血浆浓度为100、40、10、4、1、0.2、0.1 ng/mL的标曲样品溶液,按“2.4 血浆样品处理”方法处理,以待测化合物峰面积与内标峰面积之比为纵坐标(Y),以待测化合物浓度为横坐标(X),用加权最小二乘法计算回归方程,回归方程及线性范围。
2.5.3 残留 运行完标曲样品溶液中最高的浓度样品后,进样1个空白样品,至少考察3次。比较空白样品在分析物和内标相同保留时间处有无干扰峰存在,或者干扰峰峰面积不大于分LLOQ峰面积的20%和内标峰面积的5%。运行完标曲样品溶液中最高的浓度样品后,进样1个空白样品,至少考察3次。比较空白样品在分析物和内标结果。
2.5.4 精密度与准确度 取低、中、高QC工作溶液各5 μL,分别加入45 μL空白血浆稀释10倍,得乌头碱、次乌头碱浓度分别为0.1、5、37.5 ng/mL,苯甲酰乌头原碱浓度为0.2、10、75 ng/mL的QC样品溶液,按“2.4 血浆样品处理”方法处理,在日内和日间(3 d)对低、中、高浓度的QC样品进行分析,每个浓度平行6个样品,考察日内、日间精密度和准确度。
2.5.6 稀释可靠性 在基质中加入高于定量上限浓度分析物,并用空白基质稀释样品,按“2.4 血浆样品处理”方法处理,并进行测定。
2.5.7 样品稳定性 取低、高QC工作溶液各5 L,分别加入45 μL空白血浆稀释10倍,分别于室温放置2 h、反复冻融3次、-80 ℃放置30 d后,按“2.4 血浆样品处理”方法处理,考察稳定性情况,同时考察自动进样器放置24 h的稳定性。低、高浓度每个考察条件均各平行6个样品,结果。
2.6 药代动力学 取血浆样品,按“2.4 血浆样品处理”方法处理,应用上面建立的LC-MS/MS法测定大鼠血浆中乌头碱、次乌头碱、苯甲酰乌头原碱的含量,采用DAS 3.2.8软件,进行药代动力学参数的计算。
3 结果
3.1 方法学评价
3.1.1 专属性 乌头碱、次乌头碱、苯甲酰乌头原碱、小檗碱(内标)保留时间分别为3.04、3.04、2.75、2.75 min。结果显示,血浆总内源性物质不干扰测定,专属性良好。见图1。
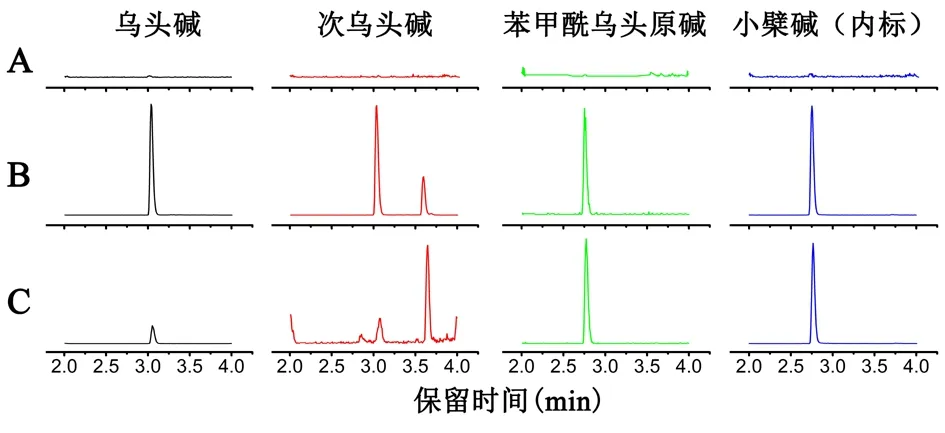
图1 典型LC-MS/MS色谱图
3.1.2 线性范围和定量下限 结果显示,乌头碱、次乌头碱和苯甲酰乌头原碱在各自线性范围内均呈现良好的线性相关性,定量下限(LowerLlimit of Quantitation,LLOQ)分别为0.05、0.05、0.1 ng/mL,日内精密度相对标准偏差(Relative Standard Deviation,RSD)分别为3.86%、3.60%、9.04%,准确度相对误差(Relative Error,RE)分别为97.00%、95.67%、98.00%。见表2。

表2 大鼠血浆样品中乌头碱、次乌头碱及苯甲酰乌头原碱回归曲线方程及线性范围
3.1.3 残留 结果表明该方法的残留效应符合要求。
3.1.4 精密度与准确度 此方法的精密度和准确度均符合要求。见表3。

表3 大鼠血浆样品中乌头碱、次乌头碱、苯甲酰乌头原碱的精确度与准确度(n=6)
3.1.5 基质效应 结果表明,基质效应对样品测定的影响较小。见表4。

表4 大鼠血浆样品中乌头碱、次乌头碱、苯甲酰乌头原碱的相对基质效应(n=6)
3.1.6 稀释可靠性 稀释10倍后,准确度和准确度良好,测定结果均可靠。见表5。

表5 大鼠血浆高浓度样品中乌头碱、次乌头碱、苯甲酰乌头原碱的稀释可靠性(n=6)
3.1.7 样品稳定性 结果显示,各浓度质控样品的准确度在87.95%~112.33%范围内,稳定性良好。见表6。
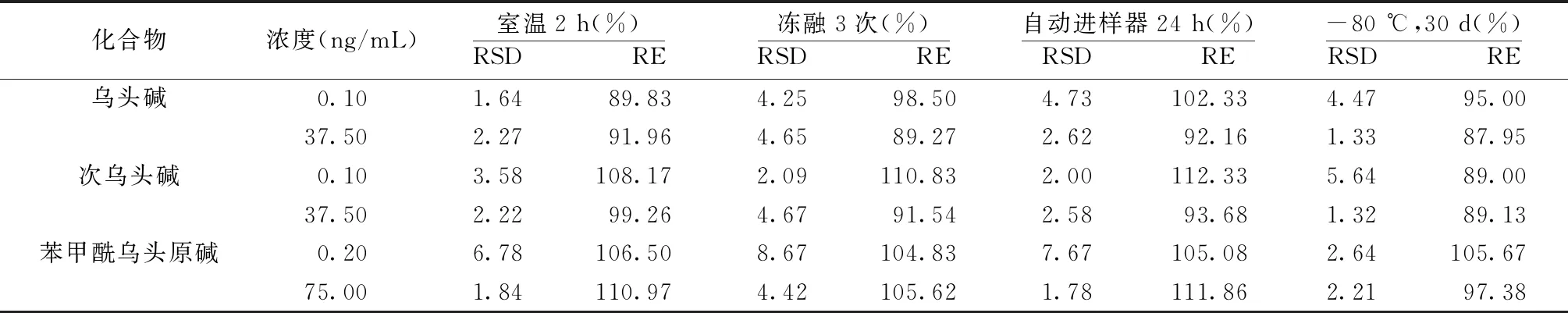
表6 大鼠血浆样品中乌头碱、次乌头碱、苯甲酰乌头原碱稳定性考察(n=6)
3.2 药代动力学 见表7、见图2。
表7 给药制草乌后大鼠血浆中乌头碱、次乌头碱、苯甲酰乌头原碱的药代动力学参数
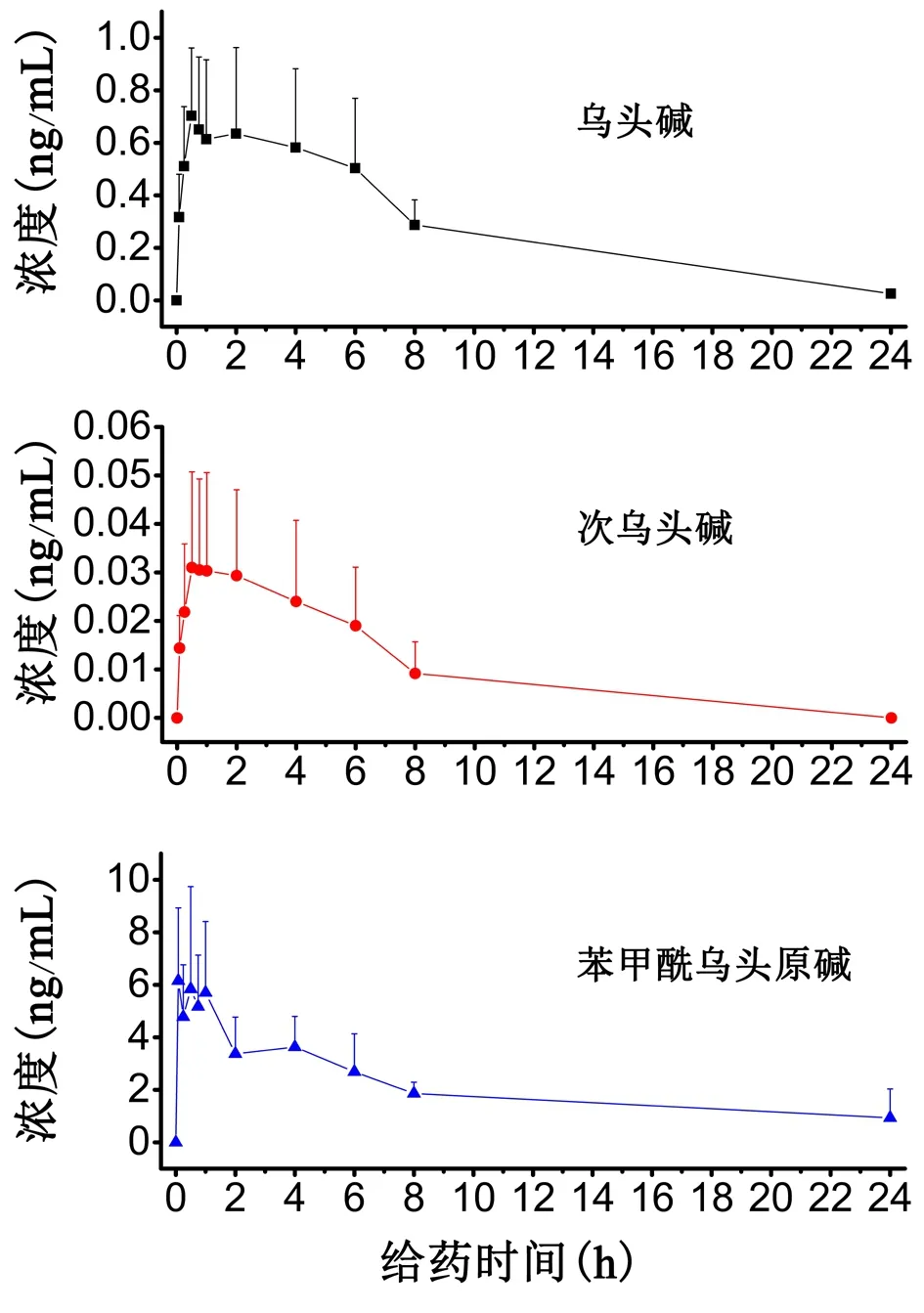
图2 给药制草乌后大鼠血浆中乌头碱、次乌头碱、苯甲酰乌头原碱的药时曲线
4 讨论
乌头类中药主要成分为乌头碱、次乌头碱等双酯型生物碱,以及苯甲酰乌头原碱等单酯型生物碱[15]。这些成分既是抗炎的有效成分,又是主要毒性成分[12]。在蒙医药上研究发现,生草乌经过炮制后会减少其毒性作用,从而发挥其药效作用。经过炮制后,双酯型乌头碱类成分的含量降低,检测难度增加,需要更加灵敏的方法才能进行血浆样品的检测,因此,本实验建立了高灵敏度的LC-MS/MS分析方法,乌头碱、次乌头碱的定量下限为0.05 ng/mL,苯甲酰乌头原碱的定量下限为0.1 ng/mL,能够满足血浆中3种成分的测定要求。在此基础上采用建立的方法,对制草乌给药后大鼠血浆中微量的乌头碱、次乌头碱及苯甲酰乌头原碱进行了测定。
