板芪发酵液对断奶羔羊肠道菌群及生长性能的影响
2022-02-08姚春晓樊俊洋李倩楠郝潇雅杨明凡宁长申张红英
姚春晓,樊俊洋,李倩楠 ,郝潇雅,杨明凡,2,3,常 娟,2,宁长申,2,张红英,2,3
(1. 河南农业大学动物医学院,郑州 450002;2. 河南省动物性食品安全重点实验室,郑州 450002;3. 河南省郑州市中兽药创制与评价重点实验室,郑州 450002)
【研究意义】湖羊是我国珍贵的绵羊品种,也是稀有的白色羔皮羊品种,主要产于浙江嘉兴和太湖地区,具有耐热、耐湿及肉质好等优点。在湖羊断奶时期,由于饲养条件的改变,极易导致羔羊生长迟缓、腹泻等,严重影响羔羊的生长发育[1-2]。【前人研究进展】中药具有毒性小、药效强、无耐药性、低残留等优点,被广泛应用于抗菌[3]、抗病毒[4]、免疫调节[5]等方面。相较于传统的煎煮中药,益生菌发酵中药不仅可以获得更多的药物成分[6],使药物大分子分解为更易被吸收的小分子,益生菌的存在还可以与有害菌竞争氧、营养成分、定植位点等,抑制有害菌的繁殖,提高动物成活率[7-8]。研究表明,中药发酵产物通过抑制有害菌增殖,调节肠道菌群平衡,提高机体的生长性能与非特异性免疫力[9-10]。板蓝根、黄芪是临床应用较多的中药药材,研究表明,板蓝根与黄芪联用可以提高育肥羊生产性能、屠宰率,改善机体的免疫功能和抗氧化性能,增强机体免疫力,且经固态发酵后可以显著增加板蓝根、黄芪总多糖及黄芪皂苷的含量[11-12]。【本研究切入点】本试验将板芪发酵液制成日粮添加剂,饲喂羔羊观察增重情况并借助高通量测序技术分析发酵药液对十二指肠、空肠、回肠肠道菌群的影响。【拟解决的关键问题】研究为中药提取液用于预防断奶羔羊菌群失调、促进羔羊生长提供理论支持。
1 材料与方法
1.1 试验动物及基础日粮
采用单因子试验设计, 挑选体重为13~16 kg、40日龄的羔羊(湖羊)42只,基础日粮(TMR)由三木绿源畜牧有限公司提供,具体组成与营养水平如表1所示。
1.2 试验菌种、发酵药液
本试验所用菌种包括枯草芽孢杆菌、地衣芽孢杆菌、球形芽孢杆菌、DY芽孢杆菌,均由河南省动物性食品安全重点实验室进行分离保存。
板芪发酵液的制备:将黄芪、板蓝根饮片(二者比例2∶1)加入蒸馏水浸泡、煎煮,将药液浓缩至1 g/mL,制成板芪水提液。分别用枯草芽孢杆菌、地衣芽孢杆菌、球形芽孢杆菌、DY芽孢杆菌、混合菌株[v(枯草芽孢杆菌)∶v(地衣芽孢杆菌)=1∶1]发酵板芪水提液,37 ℃培养28 h,测得各菌液中有效活菌数分别为1.21×1010、1.41×1010、1.63×1010、2.18×1010、3.34×1010CFU/mL,即制得板芪发酵液。
1.3 试验设计
将试验动物适应性饲喂7 d后随机分为7组,具体试验分组情况如表2所示。对照组饲喂基础日粮,未发酵组在基础日粮的基础上每只每天添加6 g板芪提取液,发酵组则每只每天添加6 g板芪发酵液,定期清理粪便,保持圈舍卫生,试验期28 d。
1.4 生长性能测定
试验期间每天计算平均日采食量。试验开始与结束空腹测体重,计算平均日增重及料重比。
平均日增重(g/d)=[末重(g)-始重(g)]/试验时间(d)
平均日采食量(g/d) = 总采食量(g) /试验时间(d)
料重比= 平均日采食量(g/d)/平均日增重(g/d)
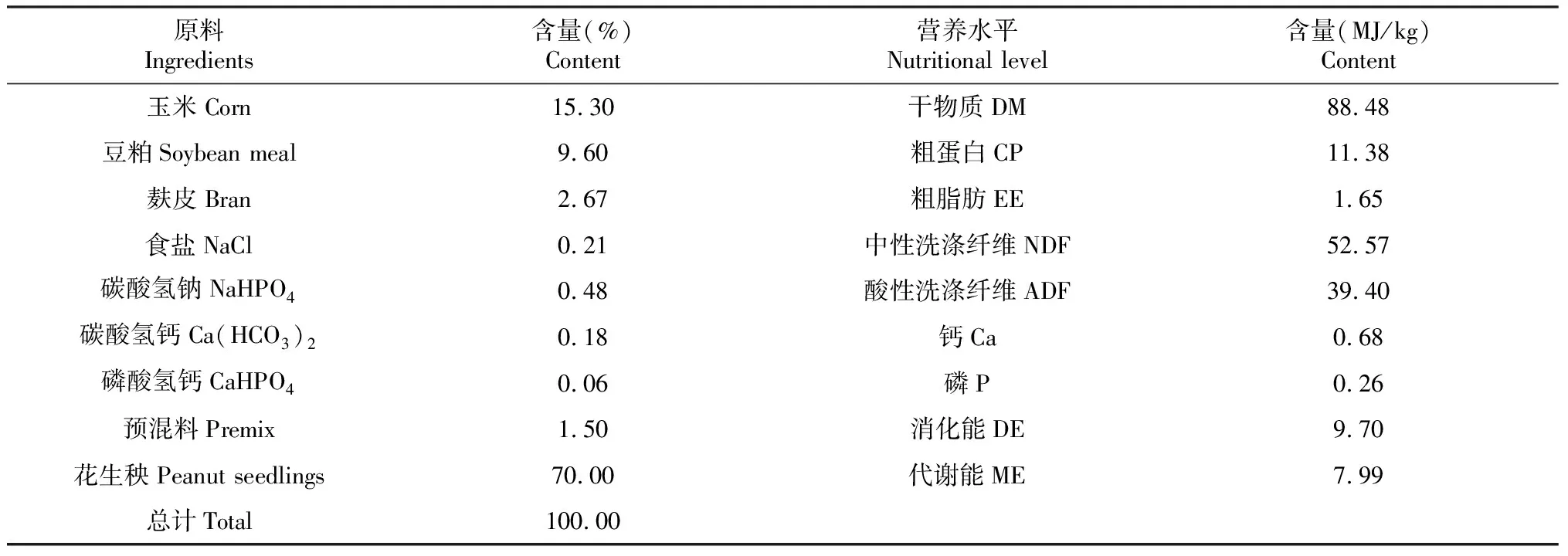
表1 TMR组成及营养水平(干物质基础)

表2 试验动物分组及处理
1.5 小肠绒毛形态观察
试验结束后宰杀羔羊,收集十二指肠、空肠、回肠,使用2.5%的多聚甲醛-戊二醛固定液固定肠道组织,制备组织切片,观察板芪发酵液对羔羊小肠绒毛形态的影响。
1.6 DNA提取、扩增及测序
为探究板芪发酵液是否通过影响肠道菌群提高羔羊的生长性能,本试验使用DNA提取试剂盒提取发酵Ⅰ组、未发酵组、对照组各3只羔羊的肠段内容物的总基因组DNA,通过细菌共同基因16S rDNA设计引物,对提取的基因进行扩增,1%琼脂糖凝胶电泳对扩增的产物进行纯化回收,采用Illumina高通量测序技术对各肠段内容物扩增基因进行测定(由派森诺生物科技有限公司代测),分析肠道微生物群落的多样性和丰度,通过LEFSe分析寻找差异菌株,初步探讨板芪发酵液与肠道菌群的关系。
1.7 统计学分析
采用 IBM SPSS 24.0软件对试验数据进行统计分析,对于多个样本的肠道分析数据处理采用Kruskal-Wallis秩和检验并使用事后检验(Dunn)对差异显著数据进行多重矫正,使用GraphPad Prism 8 软件处理分析后的数据,置信区间为95%,其中P<0.05表示差异显著,P<0.01表示差异极显著。数据用均值±标准差(mean±SD)表示。
2 结果与分析
2.1 板芪发酵液对羔羊生长性能的影响
如表 3 所示,发酵Ⅰ组平均日增重为208.57 g/d,极显著高于对照组(P<0.01),显著高于未发酵组(P<0.05),其它各组之间差异不显著(P>0.05)。
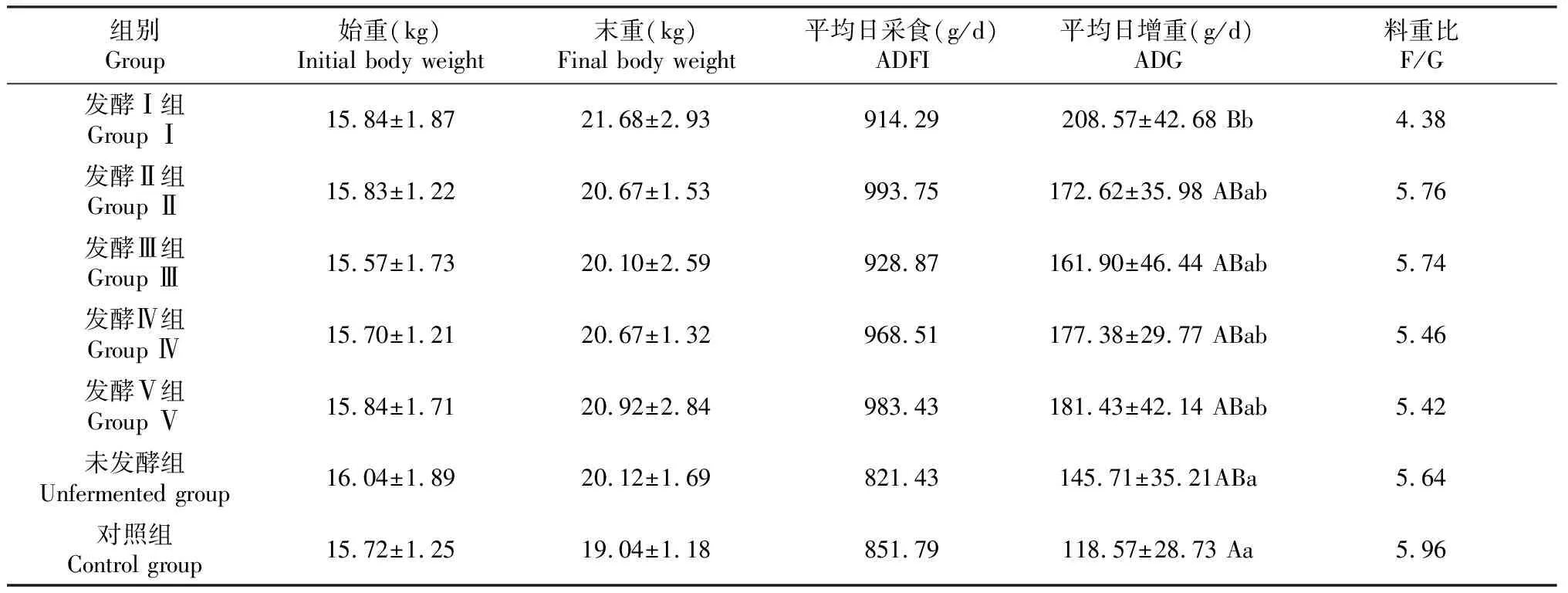
表3 板芪发酵液对羔羊生长性能的影响
2.2 板芪发酵液对羔羊小肠绒毛形态的影响
各处理组的小肠绒毛宽度、隐窝深度均无显著差异(图1)。与对照组相比,发酵Ⅰ组(枯草芽孢杆菌发酵板芪提取液)大幅提升羔羊十二指肠的绒毛长度。回肠的绒毛长度极显著高于未发酵组(P<0.01),显著高于发酵Ⅱ组、发酵Ⅳ组、发酵Ⅴ组以及对照组(P<0.05),对于空肠则没有改变(表4)。说明,枯草芽孢杆菌发酵板芪提取液提升羔羊的生长性能可能与提高小肠绒毛长度有直接关系。

图1 羔羊小肠绒毛形态(×100)Fig.1 Small intestine villi morphology of lambs(×100)
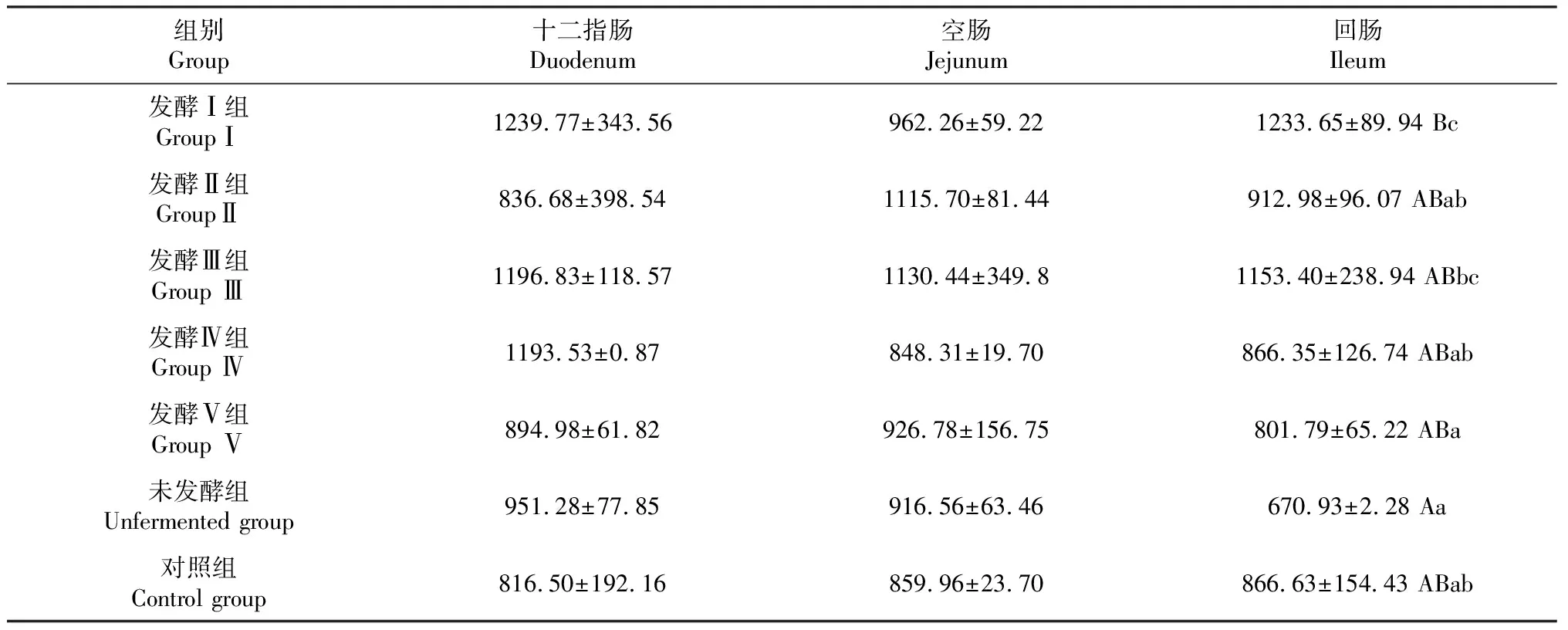
表4 板芪发酵液对羔羊小肠绒毛长度的影响
2.3 板芪发酵液对羔羊肠道菌群的影响
2.3.1 板芪发酵液对羔羊肠道菌群OTU分析 为进一步探究板芪发酵液对羔羊肠道菌群的影响,本研究采用通过高通量测序技术对发酵发酵Ⅰ组、未发酵组和对照组绵羊的肠道菌群进行测定,按照97%的序列相似度进行OUT划分并绘制韦恩图。如图2所示,3个处理组共有的OTU数量为701,其中发酵Ⅰ组OTU数量最大。说明,发酵中药可以增加羔羊肠道菌群丰度。
2.3.2 板芪发酵液对羔羊十二指肠、空肠和回肠菌群Alpha多样性的影响 Alpha多样性可在一定程度上反映样本内的物种丰富度、多样性、均匀度,通常以Chao1指数表示物种丰富度,以Simpson 指数表示物种的多样性,以Goods coverage指数、Faith’spd指数和Pielou evenness指数分别表示物种覆盖度、物种进化多样性和均匀度。
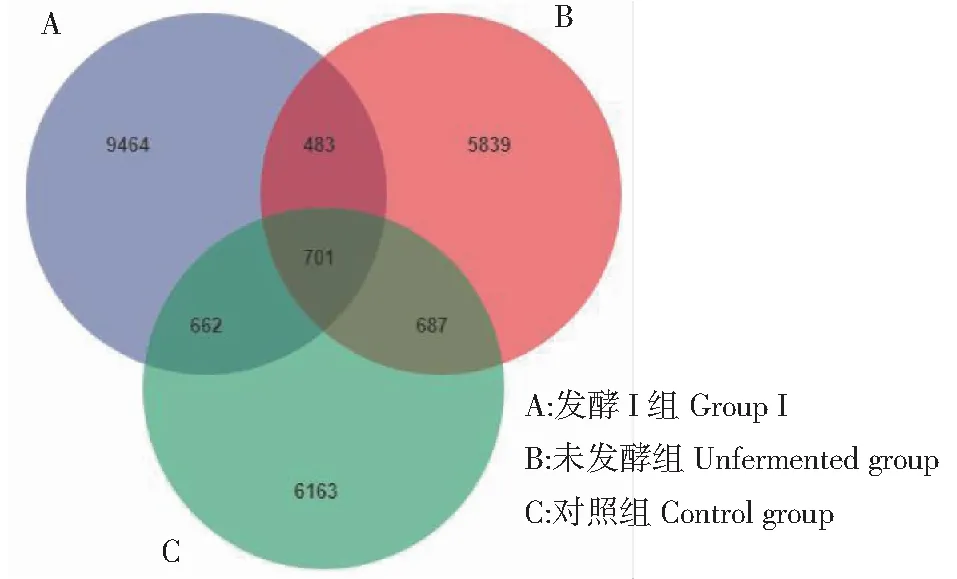
图2 羔羊肠道菌群OUT聚类分析Fig.2 OTU cluster analysis of lamb intestinal flora
从图3可以看出,发酵Ⅰ组十二指肠菌群的Chao1指数和Simpson指数显著高于对照组(P<0.05),空肠和回肠的Simpson指数显著高于未发酵组(P<0.05)。说明,发酵Ⅰ组可以显著提升羔羊十二指肠的菌群丰度及各肠段的菌群多样性。

图3 羔羊十二指肠(A)、空肠(B)、回肠(C)肠道菌群Alpha多样性分析Fig.3 Alpha diversity analysis of intestinal flora in duodenal (A), jejunum (B) and ileum(C) of lambs
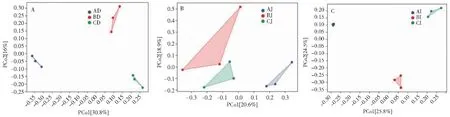
图4 十二指肠(A)、空肠(B)、回肠(C)肠道菌群Beta多样性分析Fig.4 Beta diversity analysis of intestinal flora in duodenum (A), jejunum (B) and ileum (C)
2.3.3 板芪物发酵液对羔羊十二指肠、空肠、回肠菌群Beta多样性的影响 Beta多样性可以比较不同样本间物种组成的差异性,由于各肠段菌群数据复杂,通常使用主坐标分析法对数据进行降维处理。将发酵Ⅰ组、未发酵组和对照组的十二指肠、空肠、回肠测序结果进行基于Unweighted unifrac距离的PCoA分析(主坐标分析)。从图4可知,各处理组中十二指肠、回肠样本比较集中,表明组内各样本的差异较小。说明,发酵或未发酵中药对羔羊肠道菌群的改变较为稳定,空肠样本较分散,但未出现交叉。
2.3.4 板芪发酵液对羔羊十二指肠、空肠、回肠菌群构成门水平的影响 从表5可知,对照组羔羊十二指肠变形菌门(Proteobacteria)的丰度最高(62%),饲喂板芪发酵液后羔羊的十二指肠变形菌门显著降低,同时,放线菌门(Actinobacteria)与厚壁菌门(Fimicutes)的菌群丰度升高,发酵中药对空肠、回肠菌群构成没有显著影响。
2.3.5 板芪发酵液对羔羊十二指肠、空肠、回肠菌群构成属水平的影响 从表6可知,对照组十二指肠菌群内贪铜菌属(Cupriavidus)的丰度最高(53%),饲喂发酵或未发酵板芪液后贪铜菌属丰度降低,但丁酸弧菌属(Butyrivibrio)丰度升高;板芪发酵液组提高了羔羊回肠苏黎世杆菌属Turicibacter菌丰度,单用中药组志贺菌属(Shigella)的丰度增加。说明,板芪发酵液可以提升羔羊肠道有益菌的丰度,降低致病菌的丰度。
2.3.6 板芪发酵液对羔羊十二指肠菌群差异组成差异分析 板芪发酵液可以提升肠道菌群丰度与多样性,其中对十二指肠菌群的影响最为显著。为进一步评估板芪发酵液对肠道菌群的影响,本试验对发酵Ⅰ组、未发酵组、对照组的十二指肠进行Lefse分析(设定LDA>3,表7)。
Lefse分析共获得16个生物标记物,其中发酵Ⅰ组显著提高放线菌门(Actinobacteria)、蓝藻菌门(Tenericutes)、小杆菌属(Mogibacterium)、L7A-E11菌属的相对丰度(P<0.05);未发酵组显著提高迷踪菌门(Elusimicrobia)相对丰度(P<0.05);不动杆菌属(Acinetobacter)则在对照组中显著富集(P<0.05)。说明板芪发酵液可能通过提升上述功能菌的丰度提升羔羊的生长性能。
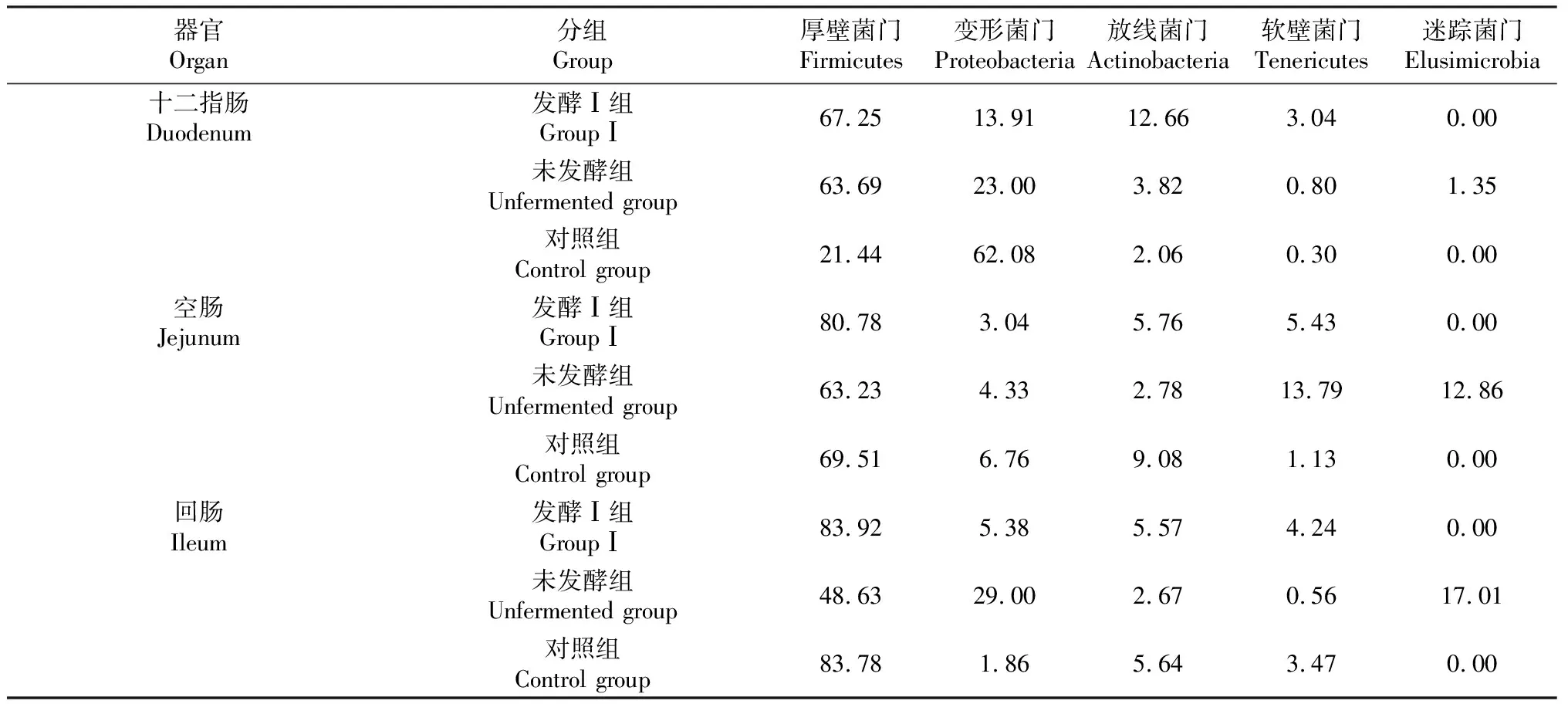
表5 门水平下的菌群分布
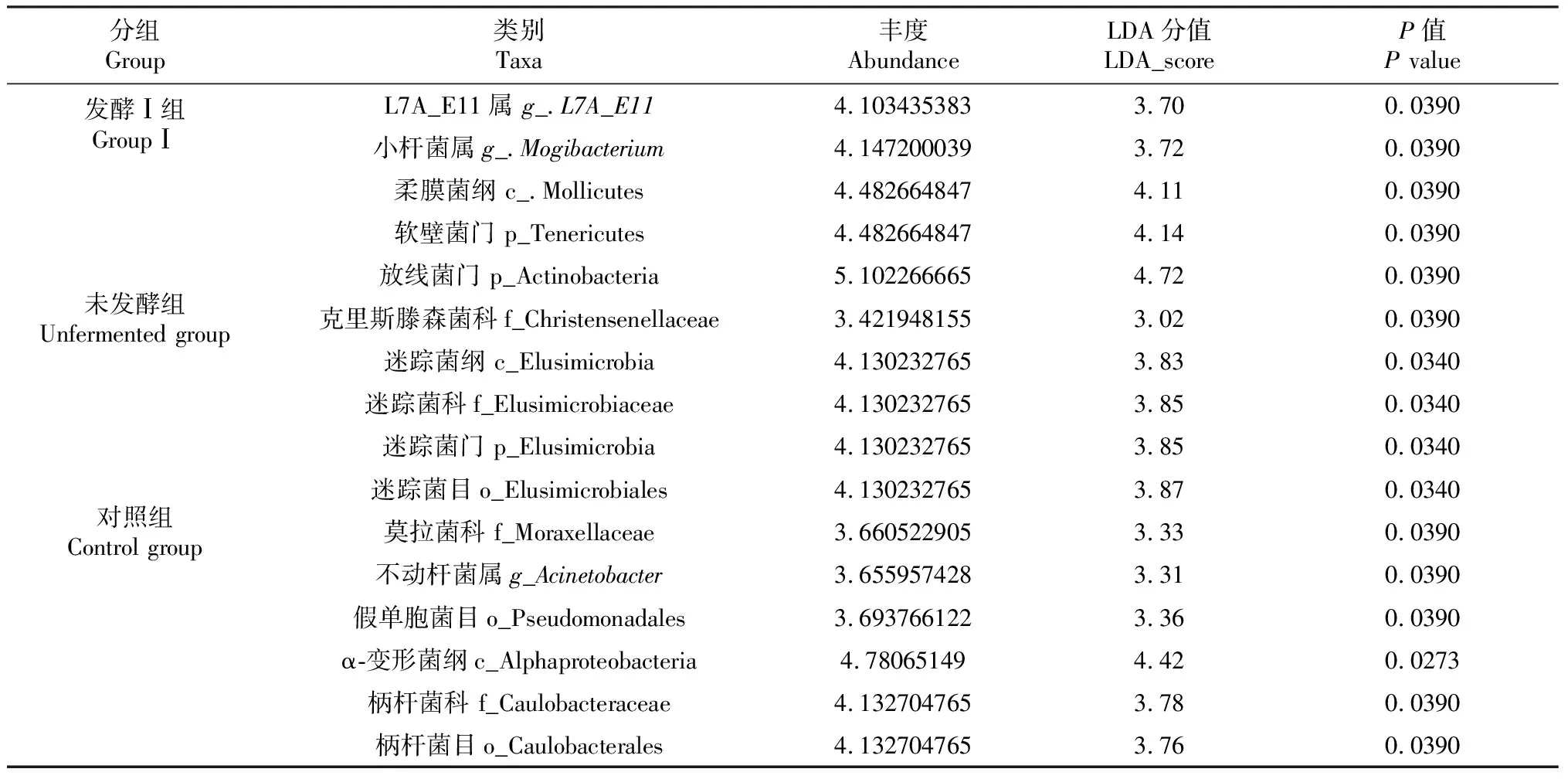
表7 羔羊十二指肠菌群组成差异分析
3 讨 论
3.1 板芪发酵液对羔羊小肠绒毛形态的影响
本研究给羔羊饲喂不同益生菌发酵板芪提取液,以期筛选可以促进羔羊生长的发酵中药饲料添加剂。发酵Ⅰ组(枯草芽孢杆菌发酵板芪提取液)平均日增重208.57 g/d,比空白对照组高75.9%。从料重比来看,发酵Ⅰ组最低,只有4.38,是空白对照组的73.5%,说明黄芪、板蓝根水提液经过发酵后可以明显提高羔羊的日增重并同时可以提高饲料转化率,这与已有报道基本一致[13-16]。小肠是消化吸收的主要部位,本研发发现发酵Ⅰ组显著提高羔羊回肠绒毛长度,对十二指肠绒毛长度提升效果最为明显,故饲喂枯草芽孢杆菌板芪发酵液可提升羔羊肠道的吸收功能,这为料重比的降低提供了有力的支撑。
3.2 板芪发酵液对羔羊肠道菌群的影响
肠道菌群是动物机体的重要组成部分,研究表明肠道菌群不仅与动物生长性能、肠道免疫相关[17],更能通过“肠-脑轴”、“肠肝轴”、“肠-肺轴”、“肠-肾轴”等影响全身的组织器官[18-21]。为探究板芪发酵液对羔羊肠道菌群的影响,对发酵组、未发酵组、对照组进行了肠道菌群测定,结果显示发酵Ⅰ组可以稳定提升羔羊肠道菌群丰度与多样性,门、属水平分析同样证明了这一点,这表明板芪发酵液可以提升羔羊肠道菌群多样性,预防肠道菌群失调,这与Wang等[22]的研究结果一致。放线菌门可分泌多种活性成分,如酶、抑菌物质、抗生素等,内含多种益生菌(如双歧杆菌等),同时在分解纤维素中具有较大作用[23];软壁菌门具有促进脂质代谢和高密度脂蛋白的能力[24];小杆菌属可形成苯乙酸,是反刍动物肠道菌降解纤维素的必需成分[25];不动杆菌属为条件致病菌,可引起肺炎、腹膜炎、脑膜炎、心内膜炎,且对大多数抗生素均不敏感[26]。本研究发现,发酵Ⅰ组显著提高放线菌门、软壁菌门、小杆菌属的相对丰度,显著下调对照组中富集的不动杆菌属。因此推测,饲喂枯草芽孢杆菌发酵板芪提取液显著提高羔羊的平均日增重,降低料重比,可能与纤维素消化相关菌(放线菌门、小杆菌属)、脂肪合成相关菌(软壁菌门)的丰度上升有直接关系。
4 结 论
枯草芽孢杆菌发酵板芪提取液可以提高肠绒毛长度与菌群多样性,提高放线菌门、软壁菌门、小杆菌属等有益菌,降低不动杆菌属等致病菌,为发酵中药预防断奶羔羊菌群失调、提高羔羊生长性能提供理论依据。
