氨基寡糖素对苦瓜枯萎病的抗性诱导作用
2022-02-08黄熊娟黄如葵冯诚诚琚茜茜梁家作陈振东黄玉辉陈小凤刘杏连
黄熊娟,黄如葵,冯诚诚,琚茜茜,秦 健,梁家作,陈振东,黄玉辉,陈小凤,刘杏连
(广西农业科学院蔬菜研究所/广西蔬菜育种与新技术研究重点实验室,南宁 530007)
【研究意义】苦瓜是我国重要的特色瓜类蔬菜,在其产业快速发展的同时,连作障碍问题也日益突出。其中,苦瓜枯萎病发病率已呈直线上升趋势,且重病区的发病率在85%以上,经济损失惨重。此外,苦瓜科研中的种质资源和中间材料因枯萎病而大量死亡,对苦瓜种质资源保存、创新及新品种选育也造成严重影响。目前,对枯萎病的防御策略主要是从耕作制度和种植方式优化、抗病品种和嫁接砧木筛选利用、土壤消毒和土壤管理、栽培管理及化学防治和生物防治等角度着手。诱导抗病技术是一种安全有效的植物病害防治技术,可通过诱抗剂刺激植物免疫系统产生广谱、持久的抗病性能,其中的氨基寡糖素(一种植物免疫诱抗剂类新型生物农药[1])对各种果树、蔬菜和作物的真菌、细菌和病毒均具有一定的防治效果[2-5],但其对苦瓜枯萎病的抗性诱导效果尚不清楚。因此,探究氨基寡糖素诱导苦瓜幼苗抗枯萎病发生的方式及诱导抗病性对苦瓜组织结构、次生代谢物质和病程相关蛋白活性变化情况的影响,对完善氨基寡糖素诱导苦瓜抗枯萎病技术具有重要意义。【前人研究进展】与传统杀菌剂相比,植物诱抗剂具有微量、广谱、持效期长、不易产生抗药性及对环境友好等特点。已有研究发现,寡糖、聚糖类和苯并噻二唑类等有机化合物类诱抗剂对多种真菌病害的抗性诱导具有较好效果[6-9]。在土传病害抗性诱导中,庄敬华等[10]研究认为,0.1和0.5 mol/L水杨酸及4.0 mol/L草酸处理土壤对甜瓜枯萎病的诱抗有效;石延霞等[11-12]利用氟唑活化酯胚根浸种结合叶面喷雾、吡唑并嘧啶衍生物叶面喷施诱导黄瓜抗枯萎病,均获得较好的诱导抗病效果;袁新琳等[13]研究认为,氨基寡糖素可有效诱导棉花抗枯萎病和黄萎病。植物次生代谢产物主要包括木质素、胼胝质和酚类化合物等,而病原物侵袭可诱导植物产生大量可溶性酚类物质,抑制病原物迁移和扩增[14],细胞壁上的大量酚类物质也与植物的抗病性密切相关[15],在病原菌侵染产生过敏性反应过程中,植物细胞中的木质素、胼胝质和酚类物质等细胞结构及植物组织木质化程度均有所增强,能阻止病原菌从植物细胞汲取营养和水分,抵御病原菌侵染[16]。已有研究表明,在寄主植物和病原物抗病反应及亲和性互作的感病反应中,过氧化物酶(POD)、多酚氧化酶(PPO)和苯丙氨酸解氨酶(PAL)等植物体内较重要的保护酶和防御酶与植物抗性密切相关[16-18]。【本研究切入点】至今,关于氨基寡糖素诱导苦瓜枯萎病抗性的研究未见报道。【拟解决的关键问题】以不同浓度诱抗剂氨基寡糖素对苦瓜幼苗进行喷雾和灌根处理,诱导苦瓜对外来病原菌产生免疫反应从而获得对枯萎病的抗性,实现抵御枯萎病能力的提升,为完善氨基寡糖素诱导苦瓜抗枯萎病技术及促进苦瓜产业可持续发展提供参考依据。
1 材料与方法
1.1 试验材料
试验于2018年7—10月在广西农业科学院蔬菜所院科研基地进行。供试诱抗剂为5%氨基寡糖素(海南正业中农高科股份有限公司,水剂),对照诱抗剂为0.5%几丁聚糖(成都特普科技发展有限公司,水剂)和6%低聚糖素(海南正业中农高科股份有限公司,水剂);供试苦瓜品种桂农科三号由广西农业科学院蔬菜研究所选育提供;供试病原菌尖孢镰刀菌苦瓜专化型(Fusariumoxysporumf. sp.Momordicae,FOM)由广西农业科学院蔬菜研究所保存提供。
1.2 试验方法
1.2.1 诱导方式 叶面喷雾诱导:配制5%氨基寡糖素1500倍液(Y-3处理),于苦瓜2叶1心期首次喷施,每隔3 d喷施1次,共喷3次,3次重复,每重复40株;对照诱抗剂为0.5%几丁聚糖300倍液(Y-1处理)和6.0%低聚糖素800倍液(Y-2处理),以喷雾清水为空白对照(CK1)。使用微量喷雾系统将药液均匀喷施于苦瓜叶面,喷雾量为200 μL/株。诱导24 h后用1×106个/mLFOM孢子悬浮液灌根接种。在接种后第15天调查苦瓜枯萎病发病情况及诱抗效果。
灌根诱导:配制5%氨基寡糖素1000倍液(G-3处理),于苦瓜2叶1心期首次灌根,每株灌根50 mL,每隔3 d灌根1次,共灌3次,3次重复,每重复40株;对照诱抗剂为0.5%几丁聚糖100倍液(G-1处理)和6%低聚糖素600倍液(G-2处理),以清水灌根为空白对照(CK2)。诱导24 h后用1×106个/mLFOM孢子悬浮液灌根接种。在接种后第15天调查苦瓜枯萎病发病情况及诱抗效果。
1.2.2 最佳诱导浓度筛选 采用灌根诱导方式,设5%氨基寡糖素800倍液(NG1-1)、1000倍液(NG1-2)和1500倍液(NG1-3)3个浓度处理,以清水灌根为对照(NG1-CK),3次重复,每重复40株,筛选5%氨基寡糖素灌根的最佳浓度,并以此浓度开展1.2.4和1.2.5试验。
1.2.3 枯萎病病情分级及诱抗效果评价 参考陈振东等[19]的方法进行苦瓜枯萎病病情分级。无病症为0级;子叶发黄为1级,子叶变黄且边缘皱缩,但真叶正常为3级;子叶皱缩枯死、部分真叶发黄为5级;真叶发黄、部分叶片黄化或停止生长为7级;全株叶片黄化萎蔫或枯死为9级。病情指数(DI)为0表示免疫,0.01≤病情指数<15.00表示高抗(HR),15.00≤病情指数<35.00表示抗病(R),35.00≤病情指数<55.00表示中抗(MR),55.00≤病情指数<75.00表示感病(S),75.00≤病情指数<100.00表示高感(HS)。诱导抗病指数越高,表示诱导效果越好。
病情指数=∑(病株数×该级代表值)/(总株数×最高级代表值)×100
诱导抗病指数=(对照病情指数-处理病情指数)/对照病情指数×100
1.2.4 氨基寡糖素诱导对苦瓜病程相关蛋白酶活性的影响 配制5%氨基寡糖素1000倍液对苦瓜幼苗进行灌根诱导(参照1.2.1中的灌根诱导方法),分别设诱导不接种(T1)、诱导后接种(T2)、未诱导只接种(T3)和未诱导未接种(T4)4个处理,每处理50株。各处理苦瓜幼苗分别于诱导接种后0、1、2、4、6和8 d取苦瓜根部,参考苏州科铭生物技术有限公司生产的PAL试剂盒、β-1,3-葡聚糖酶(β-1,3-GLU)试剂盒、POD试剂盒和PPO试剂盒说明分别进行PAL、β-1,3-GA、POD和PPO活性测定。
1.2.5 氨基寡糖素诱导对枯萎病菌侵染苦瓜的影响 配制5%氨基寡糖素1000倍液(JG1)进行灌根诱导(参照1.2.1中的灌根诱导方法),设未诱导只接种为对照(JG-CK)。接种后0、2、4、6、8、10、14、18、22和26 d分别取苦瓜根组织备用。每处理50株,对照50株。采用酸性品红染色法对苦瓜根系进行处理,处理后取出放入培养皿中,用不加酸性复红的乳酸液脱色30 min,置于TO型生物制片透明剂中透明2 min,在Olympus BX51显微镜下观察菌丝侵染情况[20]。
1.2.6 氨基寡糖素诱导对苦瓜次生代谢物质的影响 配制5%氨基寡糖素1000倍液进行灌根诱导处理(参照1.2.1中的灌根诱导方法),观察苦瓜根、茎、叶的木质素、酚类化合物和胼胝质变化情况。分别设诱导不接种(J1)、诱导后接种(J2)、未诱导只接种(J3)和未诱导未接种(J4)4个处理,每处理50株。分别于接种后0、1、2、4、6和8 d取苦瓜+1叶和+2叶(中部叶片)、根(距土表0.5 cm处)和茎(距土表0.5 cm处),将根茎处理成厚1.0 mm的薄片(横切面),叶片处理成4.0 mm叶盘,放入冰醋酸和95%酒精混合液(1∶1)中,固定24 h后置于饱和水合氯醛水溶液中,抽气去气泡静置60 d,待植物组织透明后浸泡于无水乙醇中48 h,用蒸馏水清洗3次后备用。
采用Maule反应方法测定诱导后苦瓜木质素的沉积量,将透明过的根、茎、叶组织块浸于1%(W/V)KMnO4溶液中15 min,水冲洗2次,再浸于2%(W/V)HCl中5 min,水冲洗后用4.0 mol/L NH4Cl溶液制片,在Olympus BX51显微镜下观察荧光情况。
采用甲苯胺蓝染色法测定诱导后苦瓜的酚类化合物含量,将透明过的根、茎、叶组织块浸于 0.05%甲苯胺蓝(溶于 0.05 mol/L柠檬酸缓冲液,pH 3.0)中 10 min,在相同溶液中制片,在 Olympus BX51显微镜下观察荧光情况,并测定各组织的荧光平均强度。
采用苯胺蓝染色法测定诱导后苦瓜的胼胝质含量,在透明过的根、茎、叶组织块上滴 5~10 滴 0.5%(W/V)苯胺蓝(溶于50%乙醇中)染色 4~8 h,50%乙醇(新配制)中冲洗制片,在 Olympus BX51显微镜下观察荧光情况,并测定各组织的荧光平均强度。
1.3 统计分析
试验数据采用Excel 2007、DPSV 15.10和网页版ImageJ.JS(https://cnij.imjoy.io/)进行统计分析。
2 结果与分析
2.1 5%氨基寡糖素叶面喷雾和灌根处理对苦瓜幼苗枯萎病抗性的影响
由表1可知,苦瓜幼苗叶面喷雾Y-1、Y-2和Y-3诱导接种15 d后,其枯萎病病株率分别为82.35%、94.44%和52.63%,其中,Y-1和Y-3处理分别较CK1降低5.15%和34.87%(绝对值,下同),Y-2处理较CK1提高6.94%;Y-1、Y-2和Y-3处理的苦瓜病情指数分别为54.90、62.34和30.83,其中,Y-1和Y-2处理的病情指数分别较CK1提高0.73和8.17,Y-3处理的病情指数较CK1降低23.34;Y-1、Y-2和Y-3处理的诱导抗病指数分别为-1.34、-15.08和43.09,其中,Y-3处理的诱导抗病指数极显著高于Y-1和Y-2处理(P<0.01,下同),Y-1处理与Y-2处理的诱导抗病指数差异不显著(P>0.05,下同)。说明5%氨基寡糖素1500倍液喷雾对苦瓜幼苗枯萎病抗性的诱导效果明显优于喷施0.5%几丁聚糖300倍液和6.0%低聚糖素800倍液。
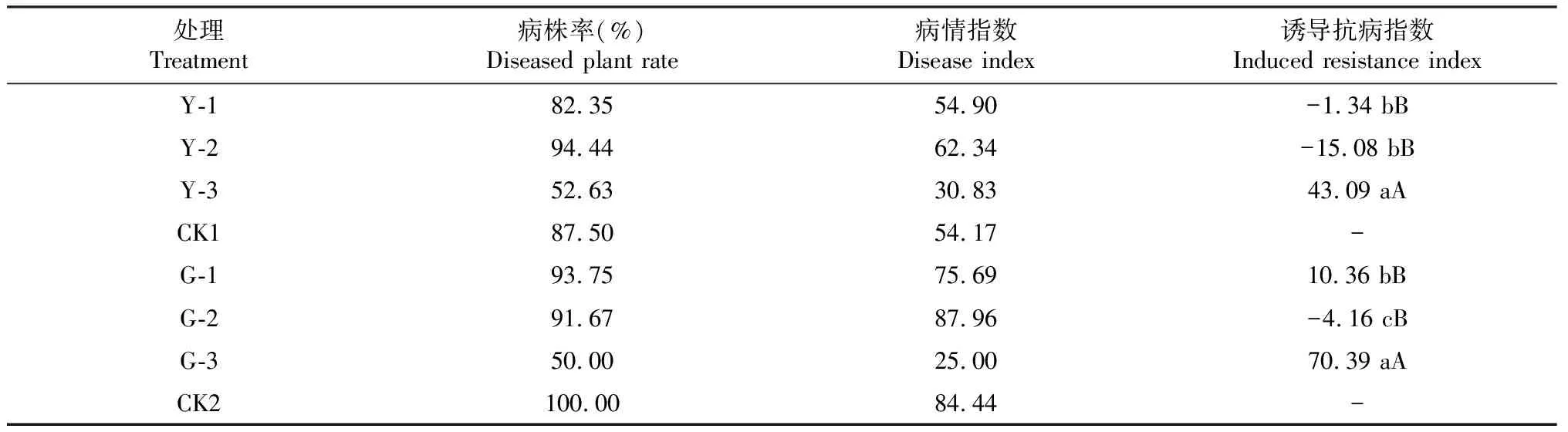
表1 诱导剂叶面喷雾和灌根处理对苦瓜幼苗枯萎病的抗性诱导效果
从表1可看出,苦瓜幼苗灌根G-1、G-2和G-3诱导接种15 d后,其枯萎病病株率分别为93.75%、91.67%和50.00%,分别较CK2降低6.25%、8.33%和50.00%;G-1、G-2和G-3处理的病情指数分别为75.69、87.96和25.00,其中,G-1和G-3处理分别较CK2降低8.75和59.44,G-2处理较CK2提高3.52;G-1、G-2和G-3处理的诱导抗病指数分别为10.36、-4.16和70.39,其中,G-3处理的诱导抗病指数极显著高于G-1和G-2处理,G-1处理显著高于G-2处理(P<0.05,下同)。说明5%氨基寡糖素1000倍液灌根对苦瓜幼苗枯萎病抗性的诱导效果优于0.5%几丁聚糖100倍液和6.0%低聚糖素600倍液灌根。
2种枯萎病抗性诱导方式的最佳诱导效果比较结果表明,5%氨基寡糖素1000倍液灌根对苦瓜幼苗枯萎病抗性的诱导抗病指数(70.39)较5%氨基寡糖素1500倍液喷雾的诱导抗病指数(40.09)高27.30。因此,下一步以氨基寡糖素灌根诱导方式开展诱导浓度筛选试验。
2.2 5%氨基寡糖素灌根诱导苦瓜幼苗枯萎病抗性的浓度筛选结果
前期试验结果表明,以5%氨基寡糖素进行灌根较叶面喷雾更适合苦瓜苗期枯萎病抗性诱导,因此,进一步开展氨基寡糖素灌根诱导浓度筛选试验。由表2可知,苦瓜幼苗灌根NG1-1、NG1-2和NG1-3诱导接种15 d后,其枯萎病病株率分别为50.00%、37.50%和50.00%,分别较NG1-CK降低50.00%、62.50%和50.00%;病情指数分别为27.22、19.44和26.11,分别较NG1-CK降低64.59、72.37和65.70;诱导抗病指数分别为70.35、73.24和71.56,其中,NG1-2处理的诱导抗病指数最高,但三者间无显著差异。说明5%氨基寡糖素800倍液、1000倍液和1500倍液灌根对苦瓜枯萎病均具有较好的诱抗效果,且抗性均达抗病(R)水平,其中1000倍液的诱导抗病效果最佳。因此,以5%氨基寡糖素1000倍液灌根进一步开展其他试验。

表2 不同浓度5%氨基寡糖素对苦瓜幼苗枯萎病的抗性诱导效果比较
2.3 5%氨基寡糖素对苦瓜根系病程相关蛋白酶活性的影响
2.3.1 对PPO活性的影响 从图1-A可看出,T1、T2和T3处理的PPO活性在诱导或接种后迅速升高,处理1 d即达峰值,以T2处理的峰值明显高于其他处理,随后3个处理的PPO活性均开始逐渐下降,至处理第6天又开始上升,处理第8天达第二峰值,但3个处理间差异较小;而T4处理的PPO活性在处理后1 d升幅较小,且在处理1 d后均均处于降低状态。可见,5%氨基寡糖素诱导和接种均可提高苦瓜幼苗根系组织的PPO活性,并维持在较高水平,有利于提高苦瓜幼苗抵抗枯萎病侵染的能力,尤其以诱导后接种(T2处理)的效果更佳。
2.3.2 对PAL活性的影响 从图1-B可看出,T2处理的PAL活性在处理后1 d达峰值,之后活性缓慢降低,在处理第2天又缓慢升高,并保持在较平稳的高水平;T1处理的PAL活性在处理后1 d达峰值,随后快速降低,处理第2天快速升高,并在处理第4天达第二峰值,随后呈降低趋势;T3处理的PAL活性分别在处理的第1天和第6天出现2个峰值,但升高幅度不大;T4处理的PAL活性在处理后呈波动降低趋势。说明5%氨基寡糖素诱导和接种均可提高苦瓜根系组织的PAL活性,并维持在较高水平,有利于提高苦瓜幼苗抵抗枯萎病侵染的能力,尤其以诱导后接种(T2处理)的效果更佳。
2.3.3 对POD活性的影响 从图1-C可看出,T1、T2和T3处理的POD活性变化趋势一致,均在处理后迅速升高,处理第2天达峰值,随后活性急剧下降,在处理第4天活性降至谷底后又迅速升高,处理第8天达第二峰值,2个峰值均以T2处理最高;T4处理的POD活性变化较平缓,无明显的升降变化。说明5%氨基寡糖素诱导和接种均可迅速提高苦瓜根系组织的POD活性,有利于提高苦瓜幼苗抵抗枯萎病侵染的能力,尤其以诱导后接种(T2处理)的效果更佳。
2.3.4 对β-1,3-GLU活性的影响 图1-D表明,T2处理的β-1,3-GLU活性在处理后快速升高,并在处理的第1天达峰值,随后活性开始下降,处理的第2天降至T4处理水平,之后活性上升,在处理的第6天达第二峰值;T1处理的β-1,3-GLU活性在处理后快速升高,在处理的第1天达峰值,随后活性开始下降,在处理2 d后又继续升高,在处理的第6天达第二峰值,且该峰值明显高于其他处理;T3处理的β-1,3-GLU活性变化趋势与T2处理相似,但活性整体较T2处理低;T4处理β-1,3-GLU活性的升降变化平缓。说明5%氨基寡糖素诱导和接种均可迅速提高苦瓜根系组织的β-1,3-GLU活性,有利于提高破坏真菌细胞壁能力,从而提高抵抗枯萎病能力。
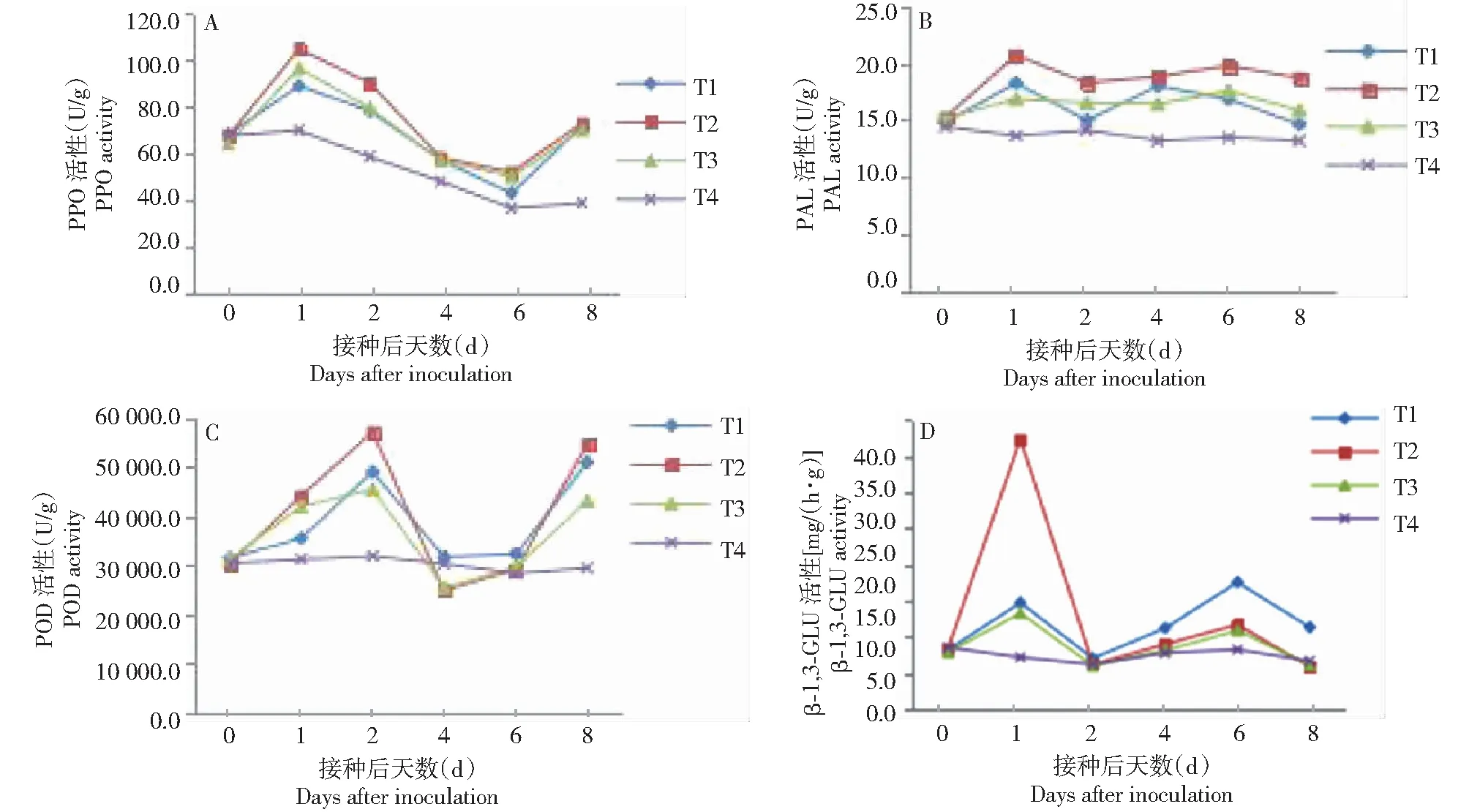
A、B、C、D分别代表PPO、PAL、POD、β-1,3-GLU活性A,B,C and D represented activities of PPO,PAL,POD and β-1,3-GLU,respectively 图1 5%氨基寡糖素诱导接种后苦瓜幼苗PPO、PAL、POD和GLU活性的变化情况Fig.1 Activity changes of PPO,PAL,POD and GLU in bitter gourd seedlings after being induced by 5% amino-oligosaccharide and inoculation
2.4 5%氨基寡糖素诱导对枯萎病菌侵染苦瓜的影响
经显微观察,经5%氨基寡糖素诱导接种后6 d,苦瓜根系中开始有枯萎病菌侵染(图2-A),接种后6~14 d根系中观察到少量菌丝,接种后18 d出现大量菌丝(图2-B),接种后22 d开始出现孢子(图2-C),接种后24 d产生大量孢子;而对照(JG-CK)在接种后2 d即发现有菌丝产生(图2-D),接种后8 d出现大量菌丝并产生孢子(图2-E),接种后14 d产生大量孢子(图2-F)。可见,5%氨基寡糖素诱导不能阻止苦瓜枯萎病菌菌丝对根系的侵染,但可延缓枯萎病菌的侵染时间,同时可阻止菌丝进一步发展和抑制孢子形成。
2.5 5%氨基寡糖素诱导对苦瓜次生代谢物质的影响
2.5.1 对苦瓜木质素沉积的影响 在5%氨基寡糖素诱导后接种0 d取样发现,J1或J2处理苦瓜幼苗的根、茎和叶片中均出现木质素沉积现象,根细胞组织(图3-A)、茎组织的韧皮部和木质部(图3-B)及叶面细胞壁(图3-C)均出现木质素沉积,但J1处理与J2处理差异不明显;随着处理时间的延长,根、茎和叶片中木质素沉积量明显增加,J1或J2处理的木质素沉积量在根组织的细胞壁(图3-D)、茎组织的细胞壁和韧皮部(图3-E)及叶片的大叶脉和细胞壁(图3-F)沉积明显。说明经5%氨基寡糖素诱导后的苦瓜组织均存在不同程度的木质素沉积现象。
2.5.2 对苦瓜酚类化合物代谢变化的影响 从图4~5可看出,在J1或J2处理的根组织中,接种后0 d开始出现荧光信号(图4-A),有酚类物质沉积(图5-A),随后平均荧光强度呈上升趋势,接种后2和6 d平均荧光强度分别达峰值,酚类物质沉积量较大(图5-B),接种后8 d平均荧光强度降低,酚类物质沉积减少(图5-C);而在J3和J4处理的根系组织中,接种后0 d出现微弱荧光信号(图4-A),J3处理在接种后1 d平均荧光强度达峰值,随后缓慢下降,J4处理在接种后2和8 d平均荧光强度分别达峰值,但整体波动不大,荧光信号不强。在J1或J2处理的茎组织中,接种后0 d无明显荧光信号(图4-B),有少量酚类物质沉积(图5-D),接种后1 d开始出现荧光信号,有酚类物质沉积(图5-E),随后荧光信号迅速增强,平均荧光强度在接种后4 d达峰值,酚类物质沉积量较大(图5-F),接种后6 d荧光信号减弱,接种后8 d信号继续增强,其中J2处理的平均荧光强度出现第二峰值;而在J3和J4处理的茎组织中,接种后0 d无明显荧光信号(图4-B),随后平均荧光强度缓慢增强,J3处理在接种后4 d出现峰值,J4处理在接种后6 d出现峰值,但荧光强度均不强。在J1或J2处理的叶组织中,接种后0 d开始出现荧光信号(图4-C),有酚类物质沉积(图5-G),接种后4 d荧光信号最强,酚类物质沉积量较大(图5-H),随后荧光信号减弱,至接种后8 d荧光信号继续减弱,酚类无明显沉积(图5-I)。说明经5%氨基寡糖素诱导后,苦瓜幼苗根、茎和叶片中均出现不同程度的酚类化合物沉积现象。
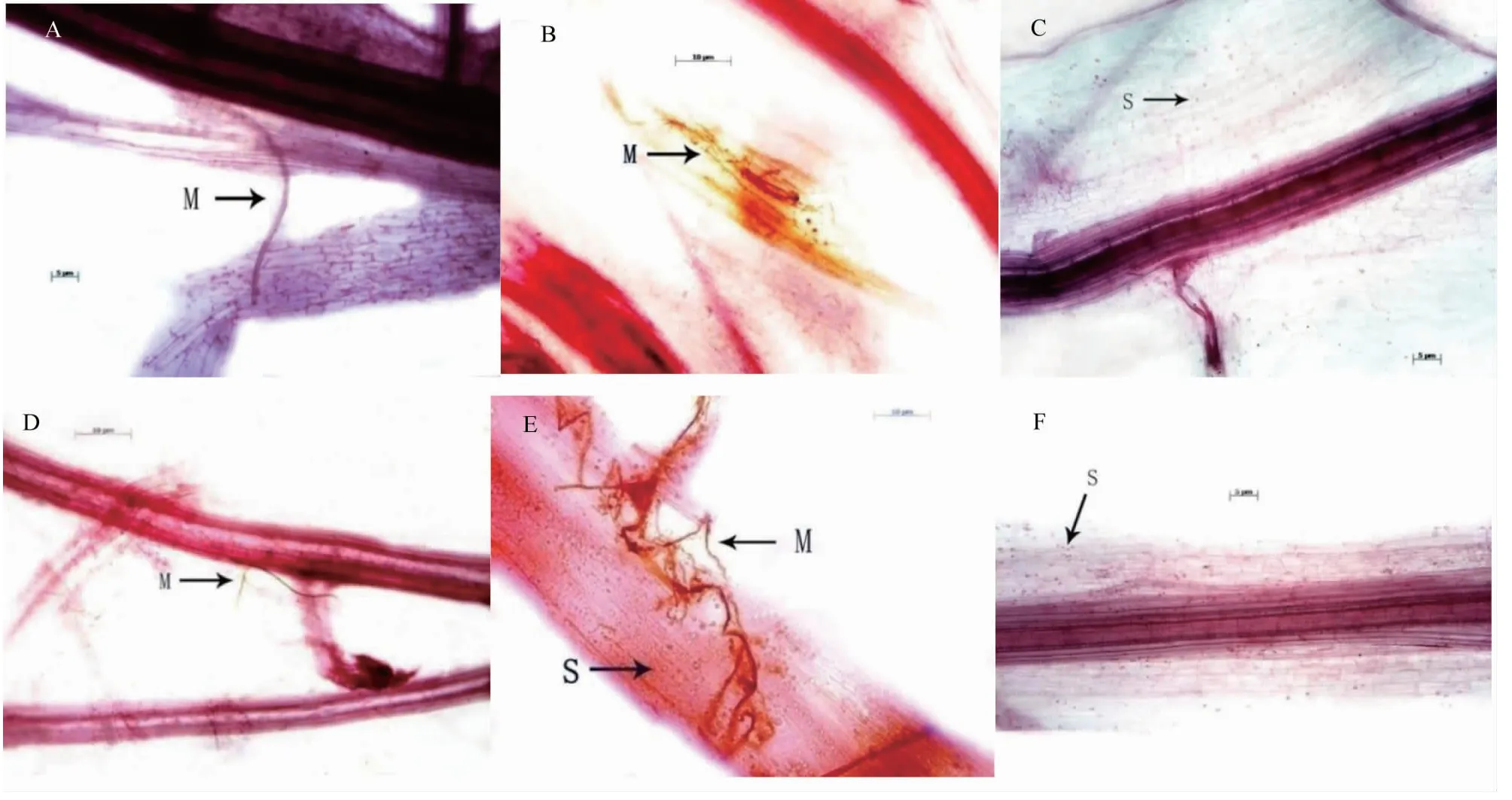
A、B、C分别代表氨基寡糖素诱导接种后6、18和22 d苦瓜幼苗根系受枯萎病菌侵染情况;D、E、F分别代表对照接种后2、8和14 d苦瓜幼苗根系受枯萎病菌侵染情况;M代表菌丝;S代表孢子A,B and C represented the wilt pathogen infection status of bitter gourd seedlings induced and inoculated with amino-oligosaccharide on 6,18 and 22 days,respectively;D,E and F represented the wilt pathogen infection status of bitter gourd seedlings in the control on 2,8 and 14 days of inoculation;M represented mycelium;S represented spore图2 5%氨基寡糖素诱导接种后苦瓜幼苗根系枯萎病菌的侵染情况Fig.2 Wilt pathogen infection status in bitter gourd roots after being induced and inoculated by 5% amino-oligosaccharides
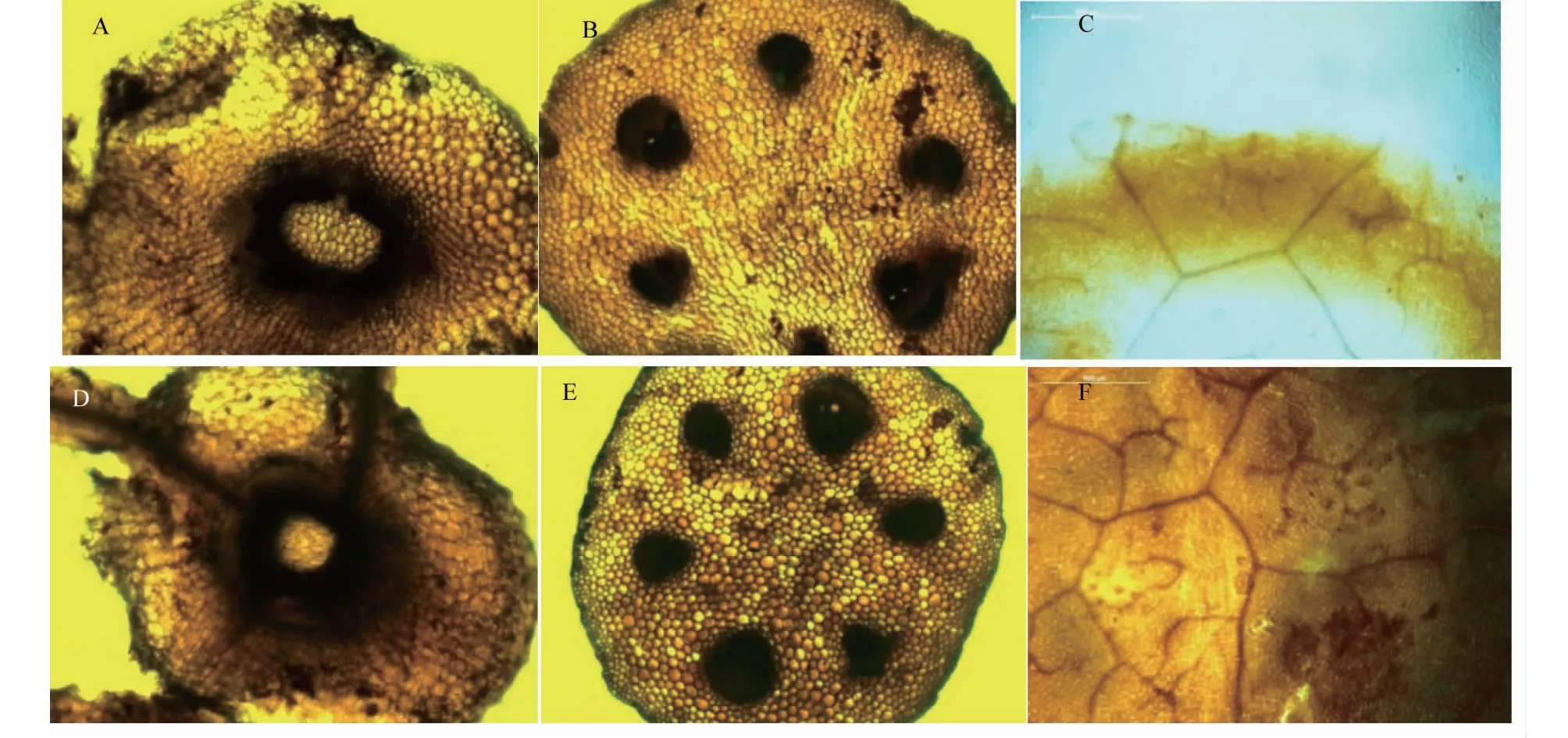
A、D分别代表诱导接种后0和8 d J1处理根系木质素的沉积情况;B、E分别代表诱导接种后0和8 d J2处理茎木质素的沉积情况;C、F分别代表诱导接种后0和6 d J1处理叶片木质素的沉积情况A and D represented root lignin deposition on 0 and 8 days of J1 treatment after induction and inoculation,respectively;B and E represented stem lignin deposition on 0 and 8 days of J2 treatment after induction and inoculation;C and F represented leaf lignin deposition on 0 and 6 days of J1 treatment after induction and inoculation图3 5%氨基寡糖素诱导接种后苦瓜幼苗根、茎和叶木质素的沉积情况Fig.3 The dynamic changes of lignin in root,stem and leaf of bitter gourd seedlings after being induced by 5% amino-oligosaccharide and inoculation
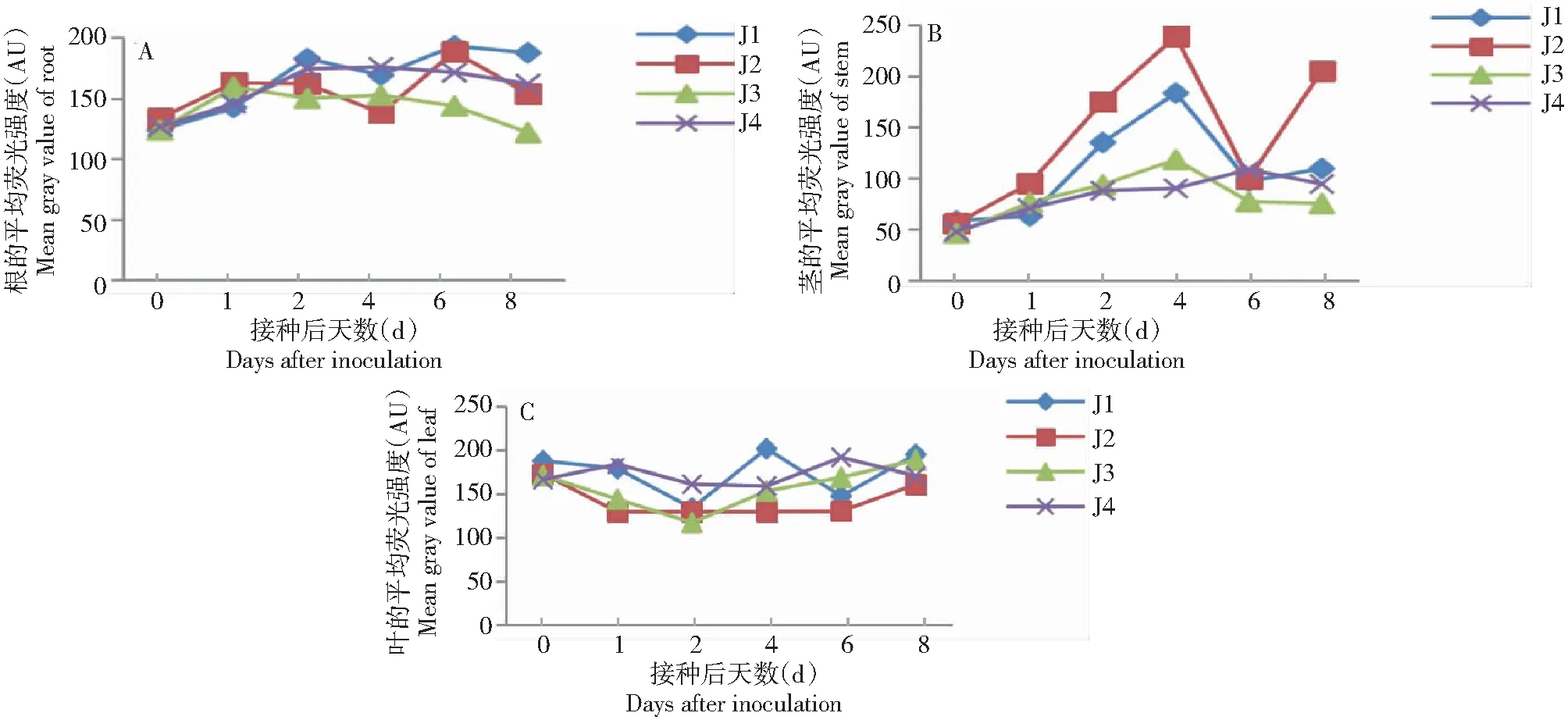
A、B、C分别代表根、茎和叶组织酚类化合物的平均荧光强度A,B and C represented the mean gray value change of phenolic compounds in root,stem and leaf,respectively 图4 5%氨基寡糖素诱导接种后苦瓜幼苗酚类化合物平均荧光强度的变化情况Fig.4 Mean gray value changes of phenolic compounds in bitter gourd seedlings after being induced by 5% amino-oligosaccharide and inoculation
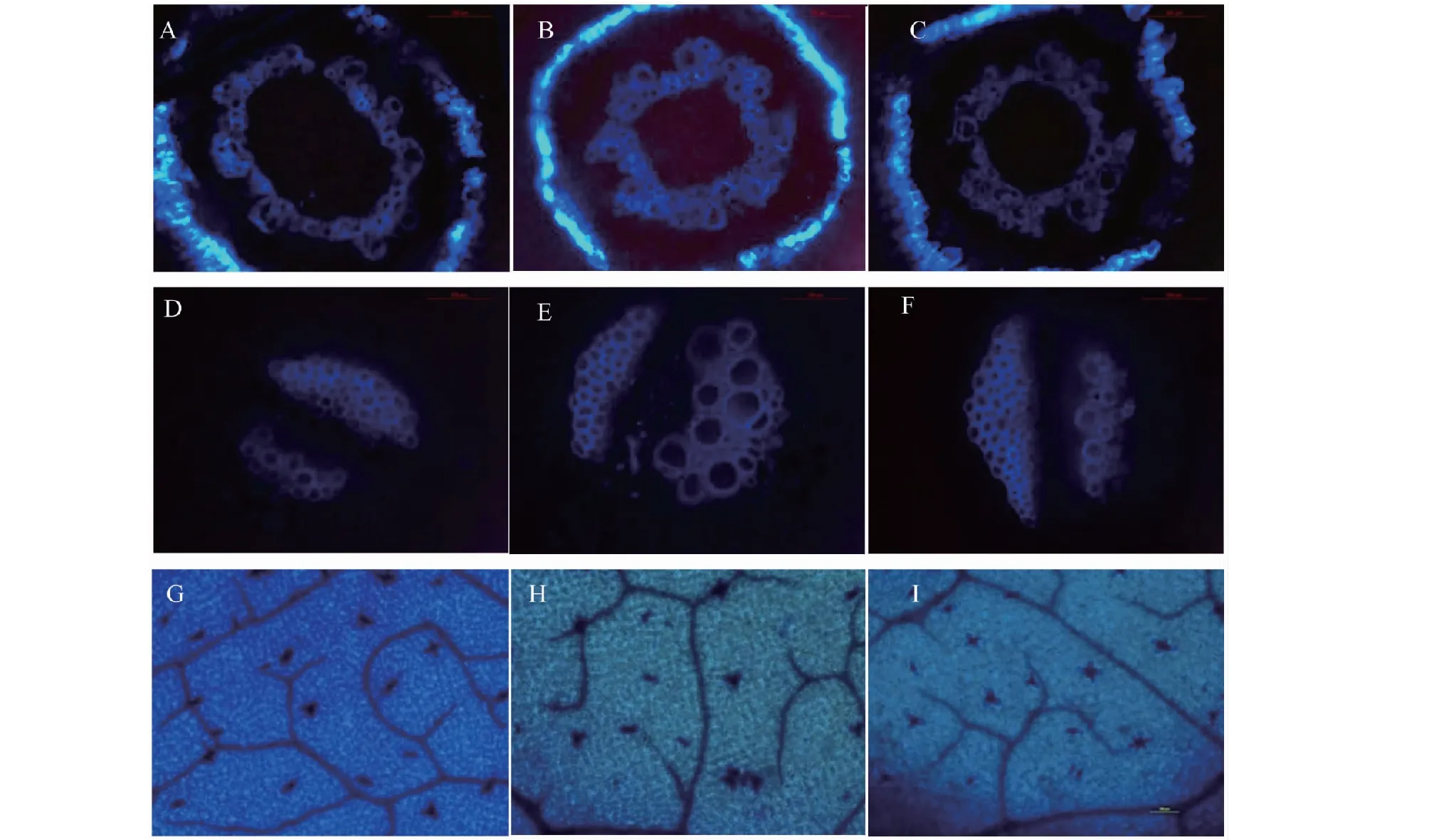
A、B、C代表诱导接种后0、6和8 d J2处理根系酚类化合物的沉积情况;D、E、F代表诱导接种后0、1和8 d J2处理茎酚类化合物的沉积情况;G、H、I代表诱导接种后0、4和8 d J2处理叶片酚类化合物的沉积情况A,B and C represented root phenolic compound deposition on 0,6 and 8 days of J2 treatment after induction and inoculation;D,E and F represented stem phenolic compound deposition on 0,1 and 8 days of J2 treatment after induction and inoculation;G,H and I represented leaf phenolic compound deposition on 0, 4 and 8 days of J2 treatment after induction and inoculation图5 5%氨基寡糖素诱导接种后苦瓜幼苗根、茎和叶酚类化合物的沉积情况Fig.5 Phenolic compound deposition in root,stem and leaf of bitter gourd seedlings after being induced by 5% amino-oligosaccharide and inoculation
2.5.3 诱导后苦瓜胼胝质的变化 从图6~7可看出,在J1或J2处理的根组织中,接种后0 d出现荧光信号(图6-A),随后平均荧光强度呈上升趋势,接种后4 d平均荧光强度达峰值,胼胝质沉积量较大,随后荧光信号和平均荧光强度减弱(图7-A);而在J3和J4处理的根系组织中,接种后0 d出现微弱荧光信号(图6-A),其中,J3处理随后呈缓慢上升趋势,接种后4 d达峰值,随后急剧下降,而J4处理的荧光信号波动相对平缓,荧光强度处于较低水平(图7-A)。在J1或J2处理的茎组织中,接种后0 d有微弱荧光信号(图6-B),接种后1 d到第一峰值,但平均荧光强度较低,随后呈下降趋势,胼胝质沉积不明显,接种后4 d后荧光信号迅速增强,平均荧光强度在接种后8 d达峰值,胼胝质沉积量较大(图7-B);而在J3和J4处理的茎组织中,接种后0 d无明显荧光信号(图6-B),随后平均荧光强度增强,但整体波动不大,荧光强度均不高(图7-B)。在J1或J2处理的叶组织中,接种后0 d开始出现荧光信号(图6-C),有胼胝质沉积,接种后6 d J1处理的荧光信号最强,胼胝质沉积量较大(图7-C),随后荧光信号减弱,接种后8 d荧光信号不明显,胼胝质无明显沉积,而J2处理在接种后2 d荧光信号最强(图6-C),胼胝质沉积量较大,随后荧光信号减弱,接种后8 d荧光信号不明显,胼胝质无明显沉积(图7-C)。说明经5%氨基寡糖素诱导后,苦瓜幼苗根、茎和叶片中均出现不同程度的胼胝质沉积现象。
3 讨 论
氨基寡糖素作为一种新型植物免疫诱抗剂在抗病诱导方面具有较好效果,已受到越来越多研究者的关注。已有研究表明,氨基寡糖素可诱导棉花抗枯黄萎病[13]、番茄抗早疫病[21]、香蕉抗褐缘灰斑病[22]和火龙果抗溃疡病[23]。檀志全等[24]研究发现,5%氨基寡糖素对葡萄霜霉病的预防效果为78.29%,对葡萄炭疽病的预防效果为60.00%。李育林[25]研究发现,喷施3%氨基寡糖素250倍液对葡萄霜霉病的防效达74.73%。本研究结果表明,5%氨基寡糖素1000倍液灌根可有效诱导苦瓜对枯萎病的抗性,诱导接种后的苦瓜枯萎病病情指数降低59.44,对枯萎病的抗性达抗病(R)水平,诱导抗病指数为70.39,与上述研究结果相似。
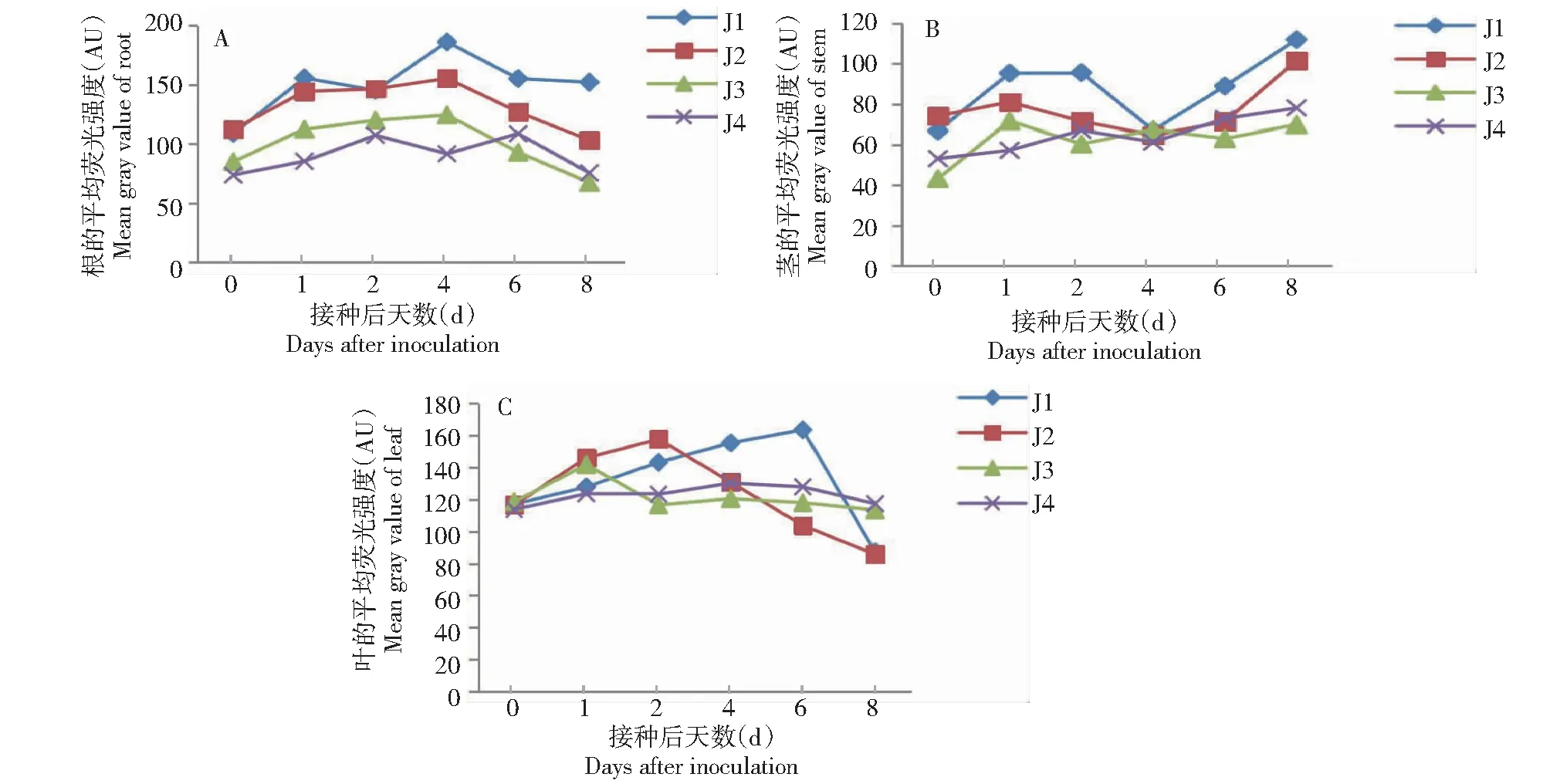
A、B、C分别代表根、茎和叶组织胼胝质的平均荧光强度A,B and C represented the mean gray value change of callose in root,stem and leaf,respectively 图6 5%氨基寡糖素诱导接种后苦瓜幼苗胼胝质的平均荧光强度的变化情况Fig.6 Mean gray value changes of callose in bitter gourd seedlings after being induced by 5% amino-oligosaccharide and inoculation
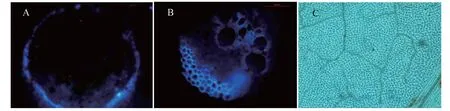
A代表诱导接种后6 d J2处理根系的胼胝质沉积情况;B代表诱导接种后2 d J1处理茎的胼胝质沉积情况;C代表诱导接种后6 d J1处理叶片的胼胝质沉积情况A represented root callose deposition on 6 days of J2 treatment after induction and inoculation;B represented stem callose deposition on 2 days of J1 treatment after induction and inoculation;C represented leaf callose deposition on 6 days of J1 treatment after induction and inoculation图7 5%氨基寡糖素诱导接种后苦瓜幼苗根、茎和叶胼胝质的沉积情况Fig.7 Callose deposition in root, stem and leaf of bitter gourd seedlings after being induced by 5% amino-oligosaccharide and inoculation
在病原菌侵染过程中,寄主植物为抵抗病原菌侵染会启动自身的免疫系统,促进细胞壁次生代谢物质活性提高及植保素和病程相关蛋白合成等诱导抗病性反应。苯丙烷代谢途径是植物最重要的次生代谢途径之一,由这一途径产生的次生物质木质素和酚类物质在植物生长发育、抵御病虫害及构成植物支撑系统等方面具有重要意义。PAL和POD均是植物苯丙烷类代谢途径的关键酶,与木质素、植保素和酚类化合物等抗性物质的形成密切相关[26]。PPO可催化木质素和酚类氧化产物的形成,产生保护性屏蔽[27]。β-1,3-GLU是植物真菌病的重要抗性物质之一,通过水解β-1,3-葡聚糖破坏真菌细胞壁而导致病原真菌死亡,发挥防御病害作用[28-30]。Liu等[31]研究发现,以苯并噻二唑(ASM)处理甜瓜,可激活甜瓜果实的内苯丙烷代谢相关酶活性及增强相关代谢物质含量,从而加强果实细胞壁和防止病原入侵。商文静[32]研究表明,壳寡糖诱导后烟叶体内与抗病性相关的各种防御酶活性均发生不同程度变化,PAL活性在接种后大幅度升高。王杰等[33]喷施6.25 mg/L氨基寡糖素能系统诱导烟草POD、PAL和SOD活性,提高烟草抗病性。袁新琳等[13]研究表明,氨基寡糖素能诱导棉叶中POD、PPO和PAL活性提高。本研究中,5%氨基寡糖素诱导可有效提高苦瓜幼苗根系中的PPO、PAL和POD活性,与前人研究结果一致[13];经过氨基寡糖素诱导接种后6 d,苦瓜根系开始有枯萎病菌侵染,接种后6~14 d根系中观察到少量菌丝,而对照在接种后2 d即发现有菌丝产生,接种后8 d出现大量菌丝,接种后14 d有大量孢子产生,说明氨基寡糖素诱导可延缓枯萎病菌侵染时间,同时可阻止菌丝进一步发展和抑制孢子形成,与石延霞等[12]、孙辉[34]、石延霞[35]的研究结果一致,表明诱抗剂氨基寡糖素可有效诱导植物枯萎病的抗性,推测其抗性生理机理可能是通过苯丙烷类代谢途径的关键酶调控木质素和酚类化合物沉淀,进而直接阻碍枯萎病菌菌丝对苦瓜的侵染而增强苦瓜对枯萎病的防御能力;诱导β-1,3-GLU提高,有效延缓苦瓜枯萎病菌的扩展速度。
4 结 论
5%氨基寡糖素诱导可激发苦瓜抗病免疫系统启动,提高苦瓜幼苗根系的PPO、PAL、POD和β-1,3-GLU活性,促进苦瓜根、茎和叶组织细胞壁中木质素和酚类物质沉积,木质化程度增加,增强苦瓜对枯萎病的防御能力,延缓苦瓜枯萎病菌的扩展速度,有效诱导苦瓜枯萎病的抗性。
