维生素D及其类似物在慢性肾脏病非透析患者中的肾脏保护作用的荟萃分析
2022-02-06王玲玲吴金岚沈士朋迟雁青刘茂东
王玲玲,吴金岚,吴 维,沈士朋,迟雁青,刘茂东
(河北医科大学第三医院 肾内科,河北 石家庄 050000)
慢性肾脏病(chronic kidney disease, CKD)主要疾病特点是血液或尿液成分异常及影像学检查异常[1],目前对CKD患者的筛查方法多是通过对血肌酐、尿白蛋白及尿蛋白/肌酐比值等结果的判读。全球疾病负担组织调查显示,1990-2016年间,全球CKD的粗发病率增加了89%,患病率增加了87%,因CKD引起的死亡率增加了98%[2]。 迫切需要寻找延缓CKD人群疾病进展的治疗方案,以改善患者生活质量,延长患者寿命。
蛋白尿作为疾病早期监测指标,不仅是CKD患者的重要临床表现之一,也是CKD患者评估疾病进展及治疗效果的重要指标[3]。多项试验研究证实,肾病综合征性质的尿蛋白量可以在体外诱导肾小管上皮细胞炎症反应及细胞毒性反应,加速肾间质纤维化[4],持续存在的蛋白尿还能直接诱发肾脏损伤,引起肾功能下降。一项对中国7个不同城市的32 650名中年人的横断面调查研究发现,微量蛋白尿与未合并心血管疾病的中国成年人10年的心血管风险显著相关,且这一关联在超重及肥胖者中尤为突出[5]。对CKD患者进行不良结局相关研究的系统评价可以发现,大量蛋白尿患者心血管不良结局发生率较一般人群增加11.27%~12.46%[6]。另外,蛋白尿增加和GFR 降低还被认为是CKD患者全因死亡率的独立预测因子。因此,在疾病的早期阶段减少蛋白尿和保护肾功能至关重要。
维生素D是一种脂溶性维生素,需与维生素D受体(vitamin D receptor, VDR)结合后发挥作用。维生素D可以通过抑制肾素-血管紧张素活性、抑制足细胞凋亡、抗炎症反应、抑制肾小管间质细胞纤维化等多种机制减少CKD患者尿蛋白排泄、保护肾脏功能[7]。利用帕立骨化醇对顺铂诱导的小鼠模型进行预处理,发现维生素D可以抑制NF-κB诱导的炎性反应并由此减轻化疗引发的急性肾损伤[8]。一项为期6个月的前瞻性随机对照研究结果表明胆钙化醇可以减少患者的尿蛋白量和尿蛋白/肌酐比值[9]。对18项随机对照研究进行系统评价,发现维生素D可以减少患者的蛋白尿,而对肾功能无负面影响[10]。
国内外各项试验研究主要针对维生素D对终末期肾脏病患者特别是肾脏替代治疗患者骨矿物质代谢的作用,而较少研究维生素D对早期CKD患者尿蛋白水平和疾病进展及预后的影响,分析维生素D及其类似物在延缓患者疾病进展中的作用。本研究的目的在于通过将维生素D及其类似物在非透析CKD患者中的临床应用的相关随机对照研究进行荟萃分析,探讨维生素D在非透析CKD患者中的肾脏保护作用,以达到减少蛋白尿、延缓疾病进展的作用。
1 资料与方法
1.1文献检索策略 对PubMed、Embase、Cochrane图书馆、Webof Science、中国知网(CNKI)、中国生物医学文献数据库(CBM)、万方数据等数据库进行文献检索,检索出关于维生素D及其类似物对CKD患者蛋白尿及疾病进展作用的相关文献,检索策略主要采用主题词与自由词相结合的方式。中文检索词包括:CKD,慢性肾脏病,慢性肾病,慢性肾脏疾病,肾炎,肾病综合征,维生素D,维生素D2,维生素D3,胆钙化醇,麦角钙化醇,骨化二醇,骨化三醇,骨化醇,25(OH)D3,1, 25(OH)2D3,蛋白尿,尿蛋白,肌酐,肾功,肾脏保护,随机对照;英文检索词包括:Renal Insufficiency, Chronic or Chronic Renal Insufficiencies or Renal Insufficiencies, Chronic or Chronic Renal Insufficiency or Kidney Insufficiency, Chronic or Chronic Kidney Insufficiency or Chronic Kidney Insufficiencies or Kidney Insufficiencies, Chronic or Chronic Kidney Diseases or Chronic Kidney Disease or Disease, Chronic Kidney or Diseases, Chronic Kidney or Kidney Disease, Chronic or Kidney Diseases, Chronic or Chronic Renal Diseases or Chronic Renal Disease or Disease, Chronic Renal or Diseases, Chronic Renal or Renal Disease, Chronic or Renal Diseases, Chronic or Vitamin D or Ergocalciferols or Calciferols or Vitamin D2or D2, Vitamin or Ergocalciferol or Cholecalciferol or Calciol or Vitamin D3or Cholecalciferols or Calcifediol or 25-Hydroxyvitamin D3or 25-Hydroxycholecalciferol Monohydrate or Monohydrate, 25-Hydroxycholecalciferol or 25-Hydroxyvitamin D3or Calcidiol or 25-Hydroxycholecalciferol or 25 Hydroxycholecalciferol or Calcifediol Anhydrous or Anhydrous, Calcifediol or Dedrogyl or Hidroferol or Calcifediol, (3 alpha, 5Z, 7E)-Isomer or Calderol or Calcitriol or 1, 25-(OH)2D3or 1, 25 Dihydroxycholecalciferol or 1, 25-Dihydroxyvitamin D3or 1, 25 Dihydroxyvitamin D3or D3, 1, 25-Dihydroxyvitamin or 1 alpha, 25-Dihydroxycholecalciferol or 1 alpha, 25-Dihydroxyvitamin D3or 1 alpha, 25 Dihydroxyvitamin D3or D3, 1 alpha, 25-Dihydroxyvitamin or Bocatriol or Calcijex or Calcitriol KyraMed or KyraMed, Calcitriol or Calcitriol-Nefro or Calcitriol Nefro or Decostriol or Osteotriol, etc.,检索时间均为建库至 2021 年12月。所有最终纳入文献均追溯并阅读引用文献,以提高检索范围。
1.2文献纳入和排除标准
1.2.1纳入标准 (1)研究对象:未接受透析治疗的CKD患者(年龄≥18周岁);(2)干预措施:试验组接受维生素D及其类似物治疗,对照组接受安慰剂治疗或设置空白对照;(3)研究类型:临床随机对照研究;(4)观察指标:24 h尿蛋白定量、血肌酐、尿蛋白/肌酐比值、尿素氮、血钙、血磷、甲状旁腺激素(PTH)。
1.2.2排除标准 (1)研究对象中包含年龄小于18周岁、孕妇、已接受血液透析或腹膜透析以及肾移植患者;(2)严重的心脑血管疾病、肝脏疾病、恶性肿瘤等;(3)研究方案不是维生素D及其类似物与安慰剂或空白对照相对比;(4)非随机对照试验;(5)动物或分子水平的研究;(6)文献类型为综述、meta分析、病例报道、会议摘要或评论、动物试验;(7)文献数据不完整。
1.3文献数据提取和质量评价 由两位研究者根据文献纳排标准各自进行筛选,交叉对比两位研究者的筛选结果,若出现分歧,则通过内部讨论或者请教导师及其他专家解决,最终确定纳入研究的文献。独立提取最终纳入文献的所有研究数据,数据提取内容包括:纳入文献的基本信息(如:文献题目、发表时间、第一作者、国家、样本量)、患者基本信息(如身高、体重、年龄、基础疾病、肾脏原发病)、干预措施(包括试验组及对照组的治疗方案及干预时间)、结局指标(包括24 h尿蛋白定量、血肌酐、尿蛋白/肌酐比值、尿素氮、血钙、血磷、PTH)。根据Cochrane偏倚风险评估工具对纳入文献进行偏倚风险评估,由两位研究者进行独立评估,评估标准包括:选择偏倚、实施偏倚、结果偏倚、失访偏倚、报告偏倚以及其他偏倚。
1.4统计学方法 采用Revman 5.4软件进行meta分析。纳入研究结果间的异质性采用Cochrane Q统计量结合I2定量进行判断。Q统计量的分析方法:若P>0.1,认为各研究结果间异质性差异无统计学意义;若P<0.1,则认为各研究之间异质性差异具有统计学意义。I2定量分析方法:异质性随I2定量数值的增加而增大,通常以25%、50%、75%为分界,一般认为I2<50%时,研究数据间异质性差异无统计学意义,采用固定效应模型进行meta分析;I2>50%时则认为各研究结果间异质性差异存在统计学意义,采用随机效应模型来进行meta分析。连续变量采用标准化均数差(standardized mean difference, SMD)为效应指标,各效应量均给出其点估计值和95%置信区间(CI),P≤0.05为差异有统计学意义;用敏感性分析来对研究结果的稳定性和可靠性进行求证。
2 结 果
2.1文献检索结果 根据文献检索策略对PubMed、Embase、Cochrane图书馆、Web of Science、中国知网 (CNKI)、中国生物医学文献数据库(CBM)、万方数据等数据库进行检索,共检索得到相关文献3 195篇。使用Endnote程序进行自动筛选,剔除重复文献后剩余2 041篇文献。按照事先制定的文献纳入及排除标准,通过阅读文献标题及摘要后筛选得到27篇文献。对剩余文献进行全文阅读后,排除18篇试验数据不完整的文献,排除1篇包含肾替代治疗患者的文献及1篇数据重复的文献,最终纳入7篇文献[11-17]。其中中文文献1篇,英文文献6篇,具体文献检索流程见图1。
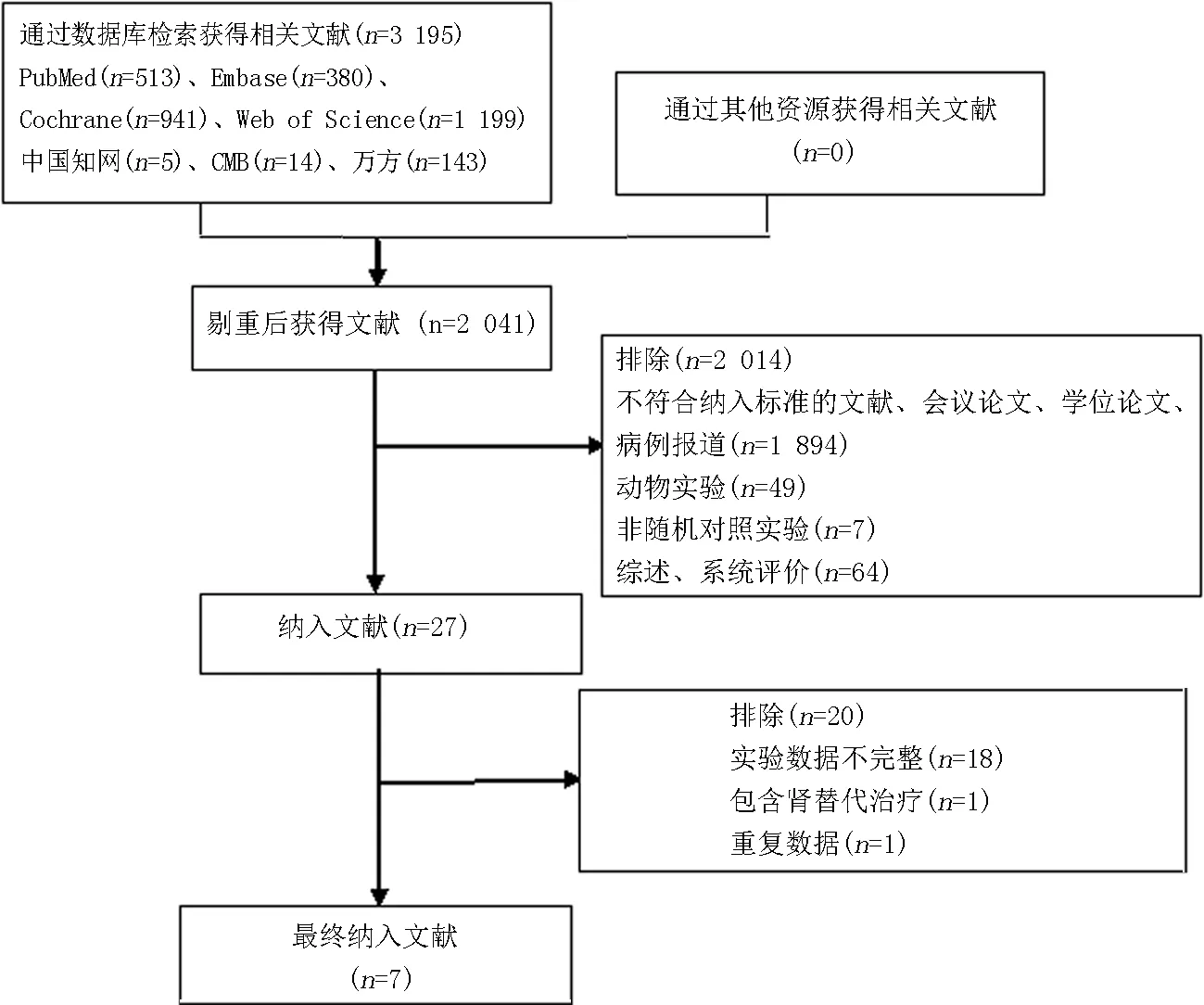
图1 文献检索流程
2.2纳入文献的一般特征及质量评价 本篇meta分析共纳入616名年龄在20~79岁、eGFR>15 ml/(min·1.73 m2)、基线时不需要进行肾脏替代治疗的患者。其中研究组给予维生素D及其类似物治疗,共纳入369名患者;对照组包括安慰剂对照和空白对照,共纳入247名患者,研究持续时间为6~48周(中位持续时间:24周)。所纳入的临床研究中,有3项临床研究干预措施为帕立骨化醇,3项临床研究干预措施为骨化三醇,1项临床研究干预措施为胆钙化醇。所有研究中出现的与研究目的无关的不良反应包括呼吸道感染、尿路感染、腹痛、腹泻、高钾血症、头痛等,严重者出现充血性心力衰竭,但没有研究报告显示上述不良反应与研究药物相关。纳入文献基本特征见表1。

表1 纳入文献的基本特征
运用Revman 5.4软件对纳入文献进行文献质量评价和偏倚风险评估。7篇文献中有5篇详细描述了随机分配序列的产生方法,5篇详细描述了隐藏随机分配序列的方法,4篇详细描述了对参与人员,尤其是研究者及受试者实施盲法的方法。各个研究均基本报告了主要结局指标的数据,并尽可能提供可供系统评价者判断选择性报告研究结果的信息。然而,本篇meta分析所纳入的研究中,几乎没有描述对研究结果评价者实施盲法的记录,并且分别有1篇文献在选择偏倚和实施偏倚中存在高危风险,可能会对研究结果产生影响,见图2。

图2 文献偏倚风险评估图
2.3疗效指标的meta分析结果 本篇meta分析纳入的所有文献均探讨了维生素D及其类似物对CKD患者蛋白尿的影响,结局指标包括24 h尿蛋白定量和尿蛋白/肌酐比值。7篇文献中有3篇评估了患者研究终点与基线时eGFR的变化,2篇文献比较了干预组和对照组血肌酐水平的改变,5篇文献报告了PTH和血清中钙离子水平的改变,4篇文献报告了应用维生素D及其类似物对CKD患者血磷的影响。
2.3.1治疗前后尿蛋白/肌酐的变化 分析尿蛋白/肌酐变化值的5项研究,其I2为65%(P=0.02),异质性相对较高,经敏感性分析证实数据相对稳定,采用随机效应模型进行meta分析,结果表明维生素D可降低非透析CKD患者的尿蛋白/肌酐比值(SMD=-0.30,P=0.001;95%CI:-0.48~-0.12), 见图3。

图3 两组治疗前后尿蛋白/肌酐比值变化的meta分析
2.3.2干预前后24 h尿蛋白量的变化 对24 h尿蛋白量的变化进行综合分析,I2为0%(P=0.85),异质性较低,采用固定效应模型进行meta分析,结果显示,与对照组相比,维生素D及其类似物可以减少早期CKD患者的24 h尿蛋白定量(SMD=-0.67,P=0.01;95%CI: -1.19~-0.14),见图4。

图4 两组治疗前后24 h尿蛋白定量变化的meta分析
2.3.3两组血肌酐变化值的比较 对CKD患者血肌酐的影响进行分析,其I2为50%(P=0.16),具有较高级别的异质性,采用随机效应模型进行meta分析,结果表明维生素D没有降低患者血肌酐的作用(SMD=-9.41,P=0.38,95%CI:-30.27~11.46),见图5。

图5 两组治疗前后血肌酐变化的meta分析
2.3.4两组eGFR变化值的比较 对eGFR变化值进行综合分析,I2为47%(P=0.15),具有中等程度的异质性,采用固定效应模型进行分析。与对照组相比,维生素D及其类似物对CKD患者的eGFR没有改善(SMD=0.94,P=0.67,95%CI:-3.35~5.22),见图6。
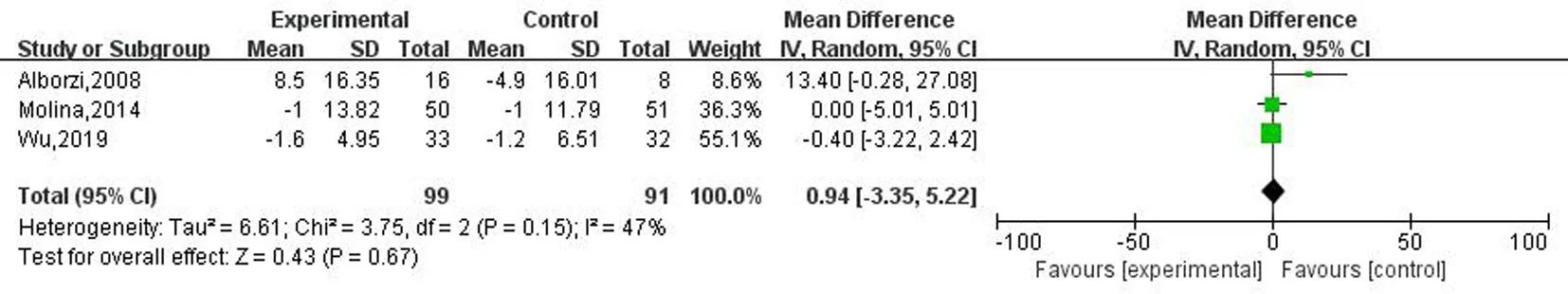
图6 两组治疗前后eGFR变化的meta分析
2.3.5干预治疗前后PTH及血钙水平的变化 综合分析PTH变化,I2为87%(P<0.01),为高度异质性分析,采用随机效应模型进行meta分析,结果表明维生素D及其类似物可降低PTH水平(SMD=-33.53,P=0.008;95%CI:-58.48~-8.58),抑制非透析CKD患者的继发性甲状旁腺功能亢进,见图7a。
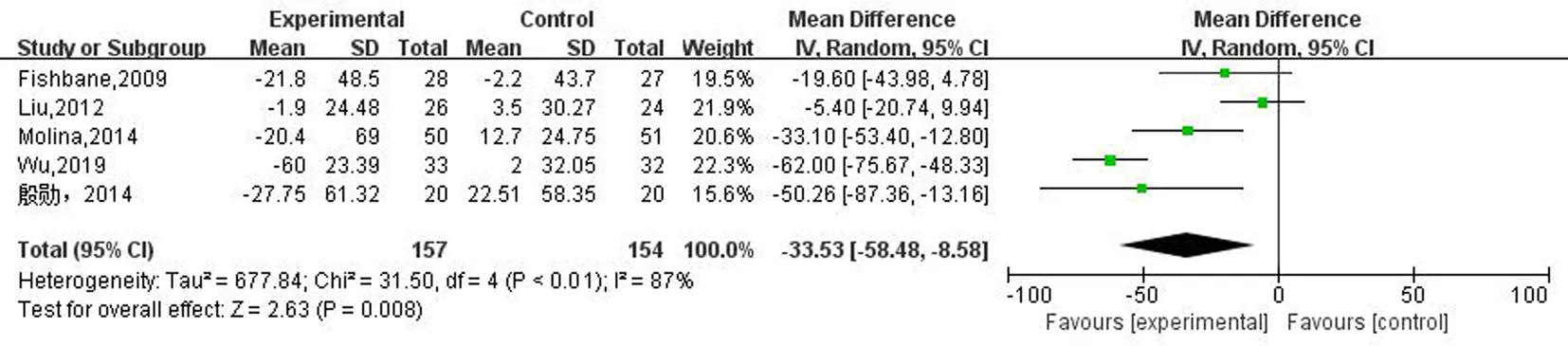
图7a 两组治疗前后PTH水平变化的meta分析
同时分析CKD患者血钙水平的变化,I2为58%(P=0.05),表明各研究之间存在高度异质性,选择随机效应模型进行meta分析。结果表明维生素D在降低CKD患者PTH水平的同时,还可以升高患者血清中钙离子水平(SMD=0.11,P=0.04;95%CI:0.01~0.21),见图7b。

图7b 两组治疗前后血钙水平变化的meta分析
2.3.6两组血磷水平的变化 对患者血磷水平进行分析,I2为0%(P=0.46),文献异质性较低,采用固定效应模型进行meta分析,差异无统计学意义,结果表明维生素D及其类似物不能降低 CKD患者血磷水平(SMD=-0.01,P=0.04,95%CI:-0.10~0.08),见图8。

图8 两组治疗前后血磷水平变化的meta分析
3 讨 论
CKD作为慢性疾病中死亡率排名第16的疾病,影响了全球8%~16%的人口,其中最主要的发病原因是糖尿病和高血压,其次是各类原发性肾小球疾病[18]。蛋白尿是多种肾脏疾病的关键生物标志物,在CKD患者的诊断和疗效评估中发挥着核心作用,蛋白尿程度甚至可以在一定范围内反映出患者的肾脏组织病理类型[19]。多项流行病学调查和疗效评价研究显示,蛋白尿是CKD患者出现疾病进展甚至发展至终末期肾脏病(end stage renal disease,ESRD)的风险分层依据,其基线水平和变化趋势是患者肾脏结局的潜在预测因子[20]。一项包含1 864名IgA患者的回顾性多中心研究发现,持续的蛋白尿缓解与患者的疾病进展风险降低密切相关[21]。因此,有效减少CKD患者尿蛋白,使其达到长时间临床缓解,对于患者的预后和生活质量极为重要。
蛋白尿的主要来源包括肾小球源性和肾小管源性,通常是由于肾小球和肾小管功能异常导致白蛋白排泄增加引起。肾小球源性的蛋白尿形成的原因一般是肾小球滤过屏障受损,导致对蛋白质的选择性滤过功能丧失,潜在发病机制包括肾素-血管紧张素系统(renin-angiotensin system, RAS)的激活、炎性细胞浸润、免疫反应、足细胞损伤、高血糖状态等,甚至出现肾小球硬化和肾间质纤维化[20]。肾小管源性的蛋白尿可能来自大量蛋白质直接滤过的造成的肾脏毒性,以及肾脏中蛋白激酶B (PKB)、磷酸肌醇3 (PI-3) 激酶和巨蛋白凋亡信号的异常调控引起的肾小管间质损伤[22]。临床常用的肾功能评价指标主要有血肌酐和eGFR,将其与蛋白尿、尿蛋白/肌酐比值等相结合,制定CKD疾病风险评估工具,有助于医生更好的进行临床分期并指导疾病监测和治疗,评估患者预后。
肾间质纤维化和肾小球硬化是蛋白尿形成及肾功能恶化过程中的重要环节,也是药物干预疾病进展最主要的基础。RAS抑制剂,作为CKD患者的常规治疗用药,可以减少血管紧张素Ⅱ合成,阻断RAS激活,从而减轻肾脏炎症反应、延缓肾间质纤维化进程[23]。盐皮质激素(如醛固酮)也具有减轻蛋白尿的概念,但是目前没有临床研究证实两类RAS抑制剂联用或者RAS抑制剂联合盐皮质激素是否能够增强其延缓CKD疾病进展的能力。新型降糖药物钠/葡萄糖共转运蛋白2(sodium/glucose cotransporter2, SGLT-2)抑制剂(如卡格列净)具有独立于降糖作用以外的肾脏保护作用,能够减少糖尿病患者的尿蛋白水平,延缓DKD进展[24]。足细胞滤过裂隙功能障碍引起的肾小球滤过屏障受损与CKD患者蛋白尿的形成关系密切,是目前抗蛋白尿治疗的新靶点[25]。
CKD患者由于维生素D合成和代谢障碍、营养状况欠佳及户外活动减少等因素,极易发生维生素D缺乏。维生素D具有减少肾胶原Ⅰ合成、抑制肾间质纤维化的作用。通过7/8肾切除术诱导CKD大鼠模型,分别给予帕立骨化醇和骨化三醇治疗,结果发现,帕立骨化醇组与骨化三醇组出现同样的抑制RAS激活、降低肾脏炎症反应的结果,从而减少肾间质纤维化[26]。单因素分析显示维生素D3补充剂对CKD患者的远期预后(包括进入透析和出现死亡等结局)具有有益作用[27]。尽管如此,仍有部分试验研究结果显示维生素D在CKD患者的疾病进展中未产生积极影响。来自美国的一项随机安慰剂对照试验,将25871名参与者进行随机分组,分别给予胆钙化醇和omega-3治疗,结果并未发现补充维生素D能够降低癌症和心血管事件的发生[28]。因此,维生素D及其类似物在人体中的骨骼外作用具有一定的不确定性,仍需更加充足的循证医学证据支持。
众所周知, RAS的异常激活在CKD患者病情进展中发挥着重要作用。通过向糖尿病肾病小鼠模型注射维生素D制剂,证明维生素D可以通过减少TGF-β表达,抑制p38丝裂原活化蛋白激酶和单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)的生成,抑制肾素表达及血管紧张素Ⅱ的合成,减少蛋白尿。免疫炎症反应已被证实为CKD患者的重要发病机制之一,维生素D可以参与机体免疫调节、抑制炎症反应,延缓肾脏病进展。此外,动物试验表明,维生素D还可以通过抑制肾脏足细胞凋亡、延缓肾组织纤维化等多种途径保护肾功能,降低 CKD 患者心血管等多种并发症的发生,最终降低患者进展至终末期肾脏病甚至发生死亡等不良事件的发生率。
本研究通过对所有纳入文献进行数据整理及meta分析,探讨维生素D及其类似物在CKD非透析患者中的肾脏保护作用。结果显示,与对照组(包括安慰剂组和空白对照组)相比,试验组应用维生素D及其类似物可以降低其24小时尿蛋白水平及尿蛋白/肌酐比值。另外,维生素D及其类似物还可以提高患者血钙水平、降低PTH,从而抑制患者继发性甲状旁腺功能亢进等并发症的发生发展。但是,比较试验组与对照组中患者血肌酐、eGFR水平在治疗前后的变化值,差异无统计学意义。如上所述,维生素D可以减少CKD患者蛋白尿水平,从而抑制疾病进展,提高疾病缓解率,这可能与维生素D抑制RAS活性、抑制肾素表达及血管紧张素Ⅱ的合成,并参与机体免疫调节、抑制炎症反应等作用相关。
本研究具有一定的局限性。首先,本研究纳入的所有文献均为短期研究,最长不超过48个月,因此可能无法反映维生素D及其类似物对CKD患者远期预后(如进展至终末期肾脏病甚至进行肾脏替代治疗、出现死亡等终点事件等)的影响。此外,本研究最终纳入文献数量较少,造成样本量相对较小,且并非所有文献均能提供可供分析的临床数据,可能会降低meta分析的可信度。因此,需要样本量更大、周期更长的临床研究来证实维生素D及其类似物对CKD患者疾病进展及远期预后的影响,充分评估其安全性和有效性。
综上所述,本研究采用meta分析的方法,对7篇关于维生素D及其类似物在CKD非透析患者中的应用的相关文献数据进行分析整合,结果发现维生素D及其类似物可以减少CKD患者24 h蛋白尿水平及尿蛋白/肌酐比值,还可以增加患者血钙水平、降低PTH、抑制继发性甲状旁腺功能亢进的发生发展。但是,没有循证医学证据支持其降低患者血肌酐、改善肾功能的作用。在安全性方面,所纳入的7篇文献均未发生严重的不良反应,部分患者出现感染或消化道症状,但没有临床证据证实这些副作用应用维生素D及其类似物相关。
