布鲁氏菌OMP10介导的小鼠骨髓源树突状细胞活化及其对小鼠T细胞增殖影响的研究
2022-02-04徐朕宇王月丽易继海童志霞邓肖玉杨宁宁徐明国苗玉和陈创夫
徐朕宇,王月丽,易继海,童志霞,邓肖玉,杨宁宁,徐明国,王 勇,孟 闯,苗玉和,陈创夫
(1.石河子大学动物科技学院,新疆 石河子 832000;2.绵羊健康养殖与人兽共患病防控协同创新中心,新疆 石河子 832000;3.江苏省人兽共患病学重点实验室,江苏 扬州 225009;4.福建省圣维生物科技有限公司,福建 南平 350000)
布鲁氏菌病(Brucellosis)是由布鲁氏菌(Brucella)感染引起的严重人兽共患病[1]。我国在90 年代中期以来该病发病率呈现连续增长态势,尤其我国主要牧区该病疫情严峻,据统计,新疆地区约有80 县/市和13 个兵团师局有不同程度的布鲁氏菌病流行,部分羊场布鲁氏菌病个体阳性率达40%以上[2-3],防控任务艰巨。接种疫苗依然是预防布鲁氏菌病的重要手段,然而目前的商用疫苗均存在不同程度的缺陷,如安全性差、有效性低、无法区别疫苗免疫和自然感染等[4],因此开发布鲁氏菌新型疫苗迫在眉睫,而新型疫苗研制的基础需要了解病原微生物感染与宿主免疫应答的机制。
布鲁氏菌作为革兰氏阴性兼性胞内致病菌,其能够利用宿主的先天免疫系统减少对模式识别受体(PRR)的刺激和减轻宿主炎性反应[5]。布鲁氏菌细胞壁由外膜蛋白(Outer membraneproteins,OMP)与外膜紧密结合的肽聚糖层(Peptidoglycan,PG)组成[6],OMP在菌体表面发挥着重要的免疫作用。其中OMP10 是布鲁氏菌重要的外膜脂蛋白,具有较强的免疫原性[7],有研究发现OMP10 基因缺失的流产布鲁氏菌突变株在小鼠体内的毒力显著减弱,且相较于野生株,该缺失株更易被清除[8]。Zwerdling 等研究发现布鲁氏菌通过OMP 影响树突状细胞(DC)的活化和抗原递呈效率[9]。未成熟的DC 具有较强的内吞作用,而成熟DC 内吞作用则会减弱[10],相关的成熟表面分子(CD40、CD80、CD86、MHC-I、MHC-II 类分子)的表达显著上调[11],相关的炎性细胞因子(IL-12 和IFN-γ 等)大量分泌[12]。且成熟的DC 具有激活T 淋巴细胞增殖的能力。布鲁氏菌侵入巨噬细胞后形成“布氏小体”,并与内质网相互作用,融合后产生内质网衍生型布氏小体,细菌在该衍生体中增殖,从而逃避宿主细胞的免疫杀伤作用[13]。但布鲁氏菌OMP10蛋白是否能够介导DC 活化,从而影响T 淋巴细胞增殖的机制,目前尚不清楚。因此,本研究体外分离培养BMDC,利用布鲁氏菌OMP10 孵育BMDC,探究鲁氏菌外膜蛋白OMP10 对小鼠骨髓源DC 活化的影响,及其在小鼠T 淋巴细胞增殖中的作用,为阐述布鲁氏菌感染与宿主免疫机制奠定实验基础,为布鲁氏菌新型亚单位疫苗研发提供参考依据。
1 材料与方法
1.1 主要实验材料pET-30a-OMP10/E. coli原核重组表达菌[14],为本实验室前期构建并保存。雌性6周龄~8 周龄昆明小鼠,6 周龄~8 周龄雌性BALB/C 小鼠均购自新疆医科大学动物实验中心。胎牛血清FBS、RPMI-1640 细胞培养液、100×青霉素/链霉素双抗溶液购自美国Gibco 公司;小鼠粒细胞巨噬细胞集落刺激因子(GM-CSF)、小鼠白介素4(IL-4)购自美国peprotech 公司;细胞用可溶性两性霉素B 购自美国Amresco公司;;10×红细胞裂解液购自美国BD公司;PE-anti-mouse CD11c、PE-anti-mouse CD80、PE-anti-mouse CD86 和PE-anti-mouse CD40 均 购 自Biolegend 公司;台盼蓝及MTT 细胞增殖及毒性检测试剂盒、细胞因子检测试剂盒购自上海碧云天生物技术有限公司;小鼠淋巴细胞分离试剂盒购自天津灏洋生物公司。
1.2 布鲁氏菌重组OMP10 蛋白(rOMP10)的表达、纯化及鉴定将重组菌pET-30a-OMP10/E. coli于含氨卞青霉素(1∶1 000)的LB 液体培养基中37 ℃培养至OD600nm值为0.6~0.8时,加入终浓度为1 mmol/L 的IPTG 诱导约6 h 后取1 mL 菌液,12 000 r/min 离心1 min,取沉淀加入80 μL 去离子水和20 μL 5×SDS Loading Buffer,混匀,煮沸10 min 后经SDS-PAGE 检测布鲁氏菌rOMP10 的表达及表达形式。进一步采用His-tag Ni 柱纯化rOMP10,利用BCA 试剂盒测定纯化蛋白浓度,采用ToxinEraserTM内毒素去除试剂盒去除目的蛋白的内毒素后备用。
1.3 小鼠骨髓源性树突状细胞(BMDC)的制备和鉴定取5 只6 周龄~8 周龄昆明小鼠,参考文献[15,16]分离小鼠骨髓源树突状细胞。无菌取小鼠股骨和胫骨细胞置于RPMI-1640 完全培养基(含灭活的10%FBS,10 ng/mL GM-CSF 和10 ng/mL IL-4)中,采用GM-CSF 和IL-4 刺激骨髓原代细胞分化为未成熟的DC,每天观察细胞形态,培养至第8 d 时通过显微镜对细胞形态鉴定后收集BMDC细胞,用PBS调整细胞浓度为1×106个/mL,分别加入1 μL PE-anti-mouse CD11c、PE-anti-mouse CD80、PE-anti-mouse CD86、PE-anti-mouse CD40,及其相应的同型抗体,4 ℃孵育20 min,利用流式细胞仪检测细胞表型(CD11、CD40、CD80、CD86)。
1.4 流式细胞术检测布鲁氏菌rOMP10 对BMDC 表型的影响本实验将1.3 中浓度1×106个/mL 的BMDC分为布鲁氏菌rOMP10 组、PBS 阴性对照组。布鲁氏菌rOMP10 组加入终浓度为50 μg/mL 纯化的rOMP10,PBS 阴性对照组加入相同体积的PBS,37 ℃,5% CO2孵育24 h 后,参照1.3 方法,利用流式细胞仪检测各组BMDC 细胞表型(CD40、CD80、CD86)的变化。
1.5 ELISA 检测布鲁氏菌rOMP10 对BMDC 细胞因子表达的影响收集1.4 中孵育24 h 后的两组BM⁃DC,1 500 r/min、4 ℃离心5 min 后吸取上清液,采用细胞因子ELISA 检测试剂盒检测BMDC 细胞因子TNF-α、IFN-γ、IL-6、IL-12、IL-10 和IL-4 的表达水平。
1.6 qRT-PCR 检测布鲁氏菌rOMP10 对BMDC Toll 样受体(TLR)及MHC-I、 MHC-II 类分子mRNA 转录水平的影响将1.4 中两组细胞孵育48 h后,1 500 r/min、4 ℃离心5 min 收集细胞,采用TRIzol 法分别提取各组BMDC RNA 并测定其浓度,采用HiFiScript cDNA 第一链合成试剂盒反转录为cDNA,分别以其为模板,以GADPH 为内参基因,采用表1中相应引物,通过荧光定量PCR 检测BMDC TLR(TLR2、TLR4、TLR9)和MHC-I、MHC-II 类分子mRNA 的转录水平,采用2-ΔΔCt法进行相对定量分析布鲁氏菌rOMP10 对BMDC TLR 和MHC 类分子的影响。反应条件:95 ℃30 s;95 ℃5 s、60 ℃10 s、72 ℃15 s,40个循环。在同样的条件下试验重复3次。

表1 引物和序列Table 1 Primers and sequences
1.7 MTT 法检测rOMP10 对小鼠脾脏T 淋巴细胞增殖的影响收集1.6 中孵育48 h 后的两组BMDC,1 500 r/min、4 ℃离心5 min 收集细胞,分别加入丝裂霉素C 终浓度为25 μg/mL 的RPMI-1640 培养液重悬细胞,以每孔100 μL 铺于96 孔细胞培养板中作为刺激细胞。无菌条件下取小鼠脾脏,利用小鼠脾淋巴细胞分离试剂盒分离小鼠脾淋巴细胞,调节淋巴细胞终浓度分别为5.0×106个/孔、5.0×106个/孔、5.0×106个/孔,以每孔100 μL 铺于96 孔细胞培养板,作为反应细胞。刺激细胞与反应细胞分别以1∶25、1∶50、1∶100 比例混合,每个比例设3 个重复孔,37 ℃、5% CO2孵育72 h 后检测各组细胞OD570nm值,通过MTT 试剂盒检测rOMP10 孵育后小鼠脾T 淋巴细胞的增殖情况,计算刺激指数(SI)=试验孔OD570nm值/对照组OD570nm值。
2 结 果
2.1 布鲁氏菌rOMP10 纯化与鉴定将重组表达菌株经LB 液体培养基培养,经IPTG 诱导后进行SDSPAGE分析,结果显示,在包涵体泳道10 ku附近出现目的条带(图1),与预期相符,表明布鲁氏菌rOMP10 以包涵体形式表达。经纯化后结果显示纯化效果较好,蛋白浓度达1.93 mg/mL。

图1 SDS-PAGE检测布鲁氏菌rOMP10的表达及纯化结果Fig.1 Expression and purification of Brucella rOMP10 detected by SDS-PAGE
2.2 小鼠BMDC 的形态学分析与表型鉴定结果经含GM-CSF 和IL-4 的RPMI-1640 刺激骨髓原代细胞培养后,于倒置显微镜观察,可见诱导第1 d细胞贴壁生长(图2A),诱导第3 d 出现少量细胞集落,轻轻摇晃培养板,部分细胞脱落,成半悬浮状态(图2B);诱导第6 d 细胞集落增加,并疏松粘附于细胞上,此时为未成熟的BMDC 细胞(图2C);诱导第8 d 大部分细胞成悬浮状态,细胞表面有明显的树突状凸起,呈现明显的DC 形态(图2D),表明此时为成熟的BMDC。

图2 培养不同时间点小鼠BMDC的形态特征Fig.2 Morphological characteristics of mouse BMDC at different time points under inverted microscope
采用流式细胞术对未成熟的BMDC 细胞表面CD11、CD40、CD80、CD86 进行鉴定,结果显示,分离细胞中含有94.6%的CD11c+细胞、表达较低水平的CD40、CD80、CD86 细胞表面共刺激分子,与典型的未成熟BMDC 细胞表型特征一致(图3),表明该细胞可用于后续试验。

图3 流式细胞术鉴定未成熟小鼠BMDC的表型Fig.3 Flow cytometry to identify the cell phenotype of mouse BMDC
2.3 布鲁氏菌rOMP10 对小鼠BMDC 表型影响的检测结果为了分析布鲁氏菌rOMP10 对BMDC 表型的影响,采用流式细胞术检测孵育24 h 的小鼠BMDC成熟度标志分子的表达。结果显示,与PBS 阴性对照相比,布鲁氏菌rOMP10 孵育BMDC 后能够极显著上调BMDC 成熟标志分子CD40、CD80、CD86 的表达水平(P<0.001)(图4)。表明布鲁氏菌rOMP10 可诱导小鼠BMDC 的成熟。

图4 流式细胞仪检测rOMP10对BMDC表面标记分子(CD40、CD80、CD86)表达的影响Fig.4 Flow cytometric detection of the effect of rOMP10 incubation on the expression of marker molecules(CD40,CD80,CD86)on the surface of BMDC cells
2.4 布鲁氏菌rOMP10 对小鼠BMDC 细胞因子分泌影响的检测结果采用ELISA 检测rOMP10 孵育24 h后BMDC 中TNF-α、IFN-γ、IL-6、IL-12、IL-10 和IL-4 的表达量,结果显示,与PBS 阴性对照相比,布鲁氏菌rOMP10 孵育BMDC 24 h 后,其诱导的细胞因子IL-6,IL-12,TNF-α 和IFN-γ 的表达量均极显著增加(P<0.01),而IL-4 和IL-10 的表达量极显著减少(P<0.001)(图5)。表明布鲁氏菌rOMP10 可诱导小鼠BMDC 的活化,促进Th1 型细胞因子的释放。
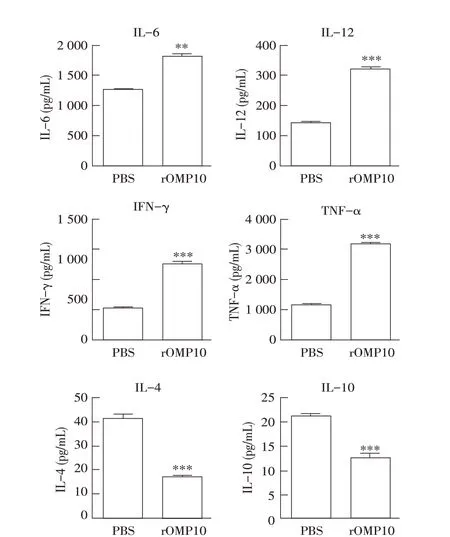
图5 ELISA检测rOMP10对BMDC细胞因子的表达水平的影响Fig.5 ELISA to detect the effect of rOMP10 incubation on the secretion of BMDC cytokines
2.5 布鲁氏菌rOMP10 对小鼠BMDC Toll 样受体(TLRs)及MHC-I、MHC-II 类分子mRNA 转录水平影响的检测结果采用荧光定量RT-PCR 检测孵育24 h 后BMDC 的TLR2、TLR4、TLR9 mRNA 转录水平和MHC-I 和MHC-II 的转录水平,结果显示,相比于对照组,实验组细胞中TLR2 mRNA的转录水平极显著升高(P<0.001),TLR4 mRNA的转录水平显著升高,TLR9 的转录水平无显著变化(P<0.05)(图6);MHC-I 和MHC-II 的转录水平均极显著升高(P<0.01)(图7)。表明布鲁氏菌rOMP10 可激活BMDC 的TLR2、TLR4 通路,并提高BMDC 的抗原递呈能力。

图6 qRT-PCR检测rOMP10对BMDC中TLR-2、TLR-4、TLR-9 mRNA转录水平的影响Fig.6 Effect of rOMP10 incubation on the transcript levels of TLR-2,TLR-4,TLR-9 mRNA in BMDC by qRT-PCR
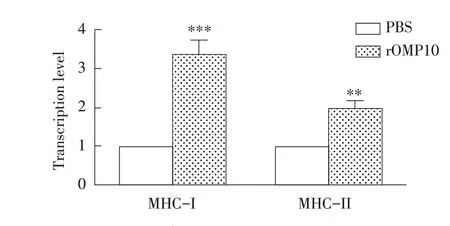
图7 qRT-PCR检测rOMP10对BMDC中MHC-I和MHC-II mRNA转录水平的影响Fig.7 Effect of rOMP10 incubation on the transcript levels of MHC-I and MHC-II mRNA in BMDC by qRT-PCR
2.6 布鲁氏菌rOMP10 介导BMDC 对T 淋巴细胞增殖影响的检测结果通过MTT 法检测rOMP10 预刺激BMDC 与T 淋巴细胞共孵育后T 淋巴细胞的增殖效率,结果显示,rOMP10 处理组比PBS 组的SI 升高2倍以上,且BMDC 与淋巴细胞的比值(DC∶T)为1∶50时rOMP10 预处理组的T 细胞增殖效率最高(图8)。表明布鲁氏菌rOMP10 介导的BMDC 活化可促进小鼠T 淋巴细胞的增殖。
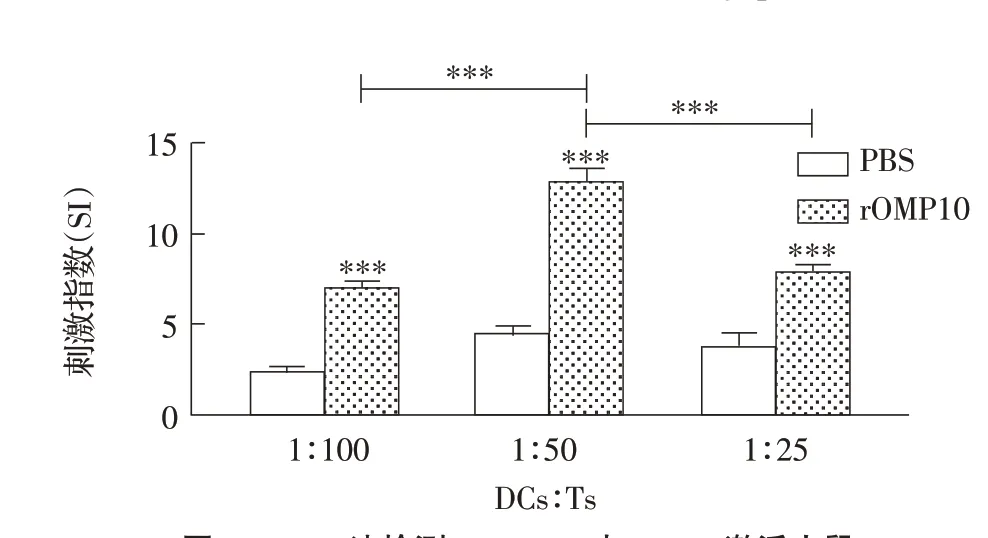
图8 MTT法检测rOMP10对BMDC激活小鼠T淋巴细胞增殖能力的影响Fig.8 Effect of rOMP10 incubation on the ability of BMDC to activate T lymphocytes in mice by MTT
3 讨 论
根据分子质量的大小可将布鲁氏菌OMP 分为3组,第一组OMP大小为10 ku、18 ku、19 ku;第二组OMP 大小主要为36 ku~38 ku;第三组OMP 的大小为25 ku~27 ku 和31 ku~34 ku[17]。OMP10 作为布鲁氏菌第一组OMP,是布鲁氏菌在侵袭过程中重要的毒力因子,能够刺激宿主机体产生免疫反应[18]。研究发现OMP10 的缺失将会降低布鲁氏菌在巨噬细胞内的存活时间和布鲁氏菌的致病性[19];且OMP10 能被布鲁氏菌疫苗免疫的小鼠血清所识别,具有良好的抗原性[20]。布鲁氏菌作为胞内菌,细胞免疫反应依然是抑制细菌胞内生存最有效的手段,而DC 是沟通天然免疫与细胞免疫重要的“桥梁”。徐龙等研究发现布鲁氏菌第3 组OMP BP26 可以活化BMDC 和增强BMDC 的抗原递呈能力[21],本研究也证实布鲁氏菌OMP10 能够显著刺激BMDC 的活化,主要相关标志分子CD40、CD80、CD86 表达上调。未成熟的BM⁃DC 具有较强的吞噬能力,当摄取抗原后将逐步诱导BMDC 的成熟,其抗原递呈能力也不断增强。因此,可认为BMDC 吞噬布鲁氏菌OMP10 是造成BM⁃DC 活化的主要原因。
TLR 属于I 型跨膜模式识别受体,是识别病原菌参与抗原递呈的主要受体。通过TLR 信号途径激活DC,使DC 发挥抗原摄取、递呈等功能,进而促进T 细胞的增值和分化,最终引起机体免疫应答反应。TLR 可以通过多种途径启动DC 的活化。研究发现TLR2 和TLR9 是通过髓样分化因子88(MyD88)信号途径激活DC,而TLR4 则可通过Toll 样受体转导途径(TRIF)或MyD88 信号途径激活DC,进而促进炎性细胞因子的分泌[22]。本研究证实rOMP10 能够激活TLR2、TLR4 mRNA 的转录,但细胞信号转导途径复杂多样,TLR 可能通过活化其下游通路,从而间接调控rOMP10 介导的BMDC 活化。此外,TLR9 在rOMP10 孵育后并无明显变化,可能由于TLR9 仅存在DC 的内质网中,主要识别细菌DNA 中非甲基化的CpG(CpG-containingoligonucleotides)序列[20]。
IL-6,IL-12,TNF-α 和IFN-γ 等细胞因子的释放,是成熟BMDC 介导宿主细胞免疫反应的关键。本实验证实BMDC 吞噬rOMP10 后促进Th1 型细胞因子(IL-6、IL-12、TNF-α、IFN-γ)的大量分泌。TNF-α 是宿主防御病原感染的重要分子[23];IL-6 是免疫细胞活化并产生扩大炎症反应的重要介质[24];IL-12是机体诱导Th1 型免疫应答、介导细胞免疫、促进IFN-γ释放的关键分子[25];研究表明IFN-γ与IL-12介导的Th1 型反应是调控布鲁氏菌胞内存活的重要原因[3]。MHC-I、MHC-II 的高表达是BMDC 发挥抗原递呈作用的关键,布鲁氏菌可以抑制IFN 诱导的巨噬细胞MHC-I、MHC-II 分子的表达能力[26-27]。成熟的DC是唯一能够有效刺激初始T 淋巴细胞增殖的抗原递呈细胞[9],外源抗原被DC 吞噬摄取后高表达MHC-I、MHC-II分子,并以复合物的形式将抗原传递给T淋巴细胞,诱导T 淋巴细胞增殖、分化,产生细胞免疫应答。 本研究发现rOMP10 能够显著刺激BMDC 高表达MHC-I、MHC-II 分子,二者与rOMP10 形成复合物的能力增强。因此,为了进一步探究rOMP10 介导的Th1 型细胞因子释放及抗原递呈关键分子的高表达是否直接影响T 淋巴细胞的活化,本研究将rOMP10 预处理后的BMDC 与T 淋巴细胞共孵育,结果证实rOMP10 活化BMDC 后有效刺激了T 淋巴细胞增殖。而T 淋巴细胞的活化有利于清除胞内的布鲁氏菌,可有效抑制细菌的复制从而降低布病的传播速度。本研究后续工作还将进一步探究rOMP10 介导的细胞免疫对布鲁氏菌胞内生存的影响。
综上所述,本研究首次证实布鲁氏菌rOMP10 能够介导BMDC 的活化,提高BMDC 抗原递呈的能力,诱导BMDC Th1 型细胞因子的释放,激活T 细胞的增殖,该结果为阐述布鲁氏菌感染与宿主细胞免疫反应机制奠定了实验基础,为开发布鲁氏菌新型亚单位疫苗提供了数据支撑。
