TEAD4与子宫颈鳞状细胞癌增殖和侵袭的关系及分子机制探讨
2022-01-27姚华娟张雨婷王红梅熊秀娟宋恩霖
姚华娟,张雨婷,王红梅,熊秀娟,宋恩霖*
(1.南昌大学抚州医学院,江西 抚州 344000;2.南昌大学基础医学院,江西 南昌 330006)
子宫颈癌是影响女性健康的常见恶性肿瘤之一,且近年其发病有年青化趋势,许多年青患者早期即出现不良的生物学行为,如局部浸润和转移,导致预后不良。故鉴定出与子宫颈癌不良生物学行为有关的分子靶标,对子宫颈癌的治疗和预后评估具有重要意义。高危型人乳头瘤病毒(HPV16/18)感染是引起子宫颈癌最主要的原因,目前有实验证据表明,在HPV16诱导下的角质细胞中存在TEAD4的高水平表达[1],说明TEAD4很可能参与子宫颈鳞状细胞癌发生发展的过程,然而它对子宫颈鳞癌的具体调节功能尚不清楚。
TEAD4(transcriptional enhancer associate domain family member 4)属于TEAD转录因子蛋白家族成员之一[2],TEAD4分子的转录激活结构域能与YAP(Hippo信号通路中主要的共激活因子)相结合,形成转录调控复合体,调控下游靶基因的转录。目前已发现,TEAD4与胃癌[3]、口腔鳞癌[4]等多种恶性肿瘤的不良生物学行为有关,但关于TEAD4与子宫颈癌的关系目前尚未见报道。本课题通过检测子宫颈鳞状细胞癌组织中TEAD4蛋白的表达情况,分析TEAD4的表达与子宫颈鳞状细胞癌不良生物学行为之间的关系,在细胞学水平观察高水平TEAD4的条件下,子宫颈鳞癌细胞增殖和侵袭能力的变化,并进一步观察此条件下癌细胞中相关信号蛋白的表达变化情况,从而研究TEAD4与子宫颈鳞状细胞癌增殖和侵袭的关系及其分子机制。
1 材料与方法
1.1 组织标本
收集南昌大学抚州医学院附属医院确诊的浸润性子宫颈鳞状细胞癌癌石蜡包埋标本50例,患者平均年龄44岁。所有患者术前均未行放、化疗。另取20例正常宫颈上皮组织标本作为对照组。
1.2 免疫组化
采用MaxVision法,石蜡标本3~5 μm厚切片,65 ℃烘箱烤片2 h,常规二甲苯脱蜡,梯度乙醇水化,自来水冲洗,柠檬酸钠抗原热修复,3%H2O2处理,PBS漂洗。取目标蛋白一抗(兔抗人TEAD4多克隆抗体,504151,成都正能生物技术有限公司;兔抗人MMP9多克隆抗体,27306-1-AP,美国Proteintech公司))工作液50 μL孵育,4 ℃过夜,PBS洗涤后,每片滴加MaxVision二抗工作液(KIT-5010,福州迈新生物公司)50 μL,室温下孵育30 min,充分洗涤后DAB显色,苏木精复染,中性树胶封固。以PBS代替一抗作阴性对照。测量平均光密度(mean optic density,MOD)进行蛋白表达半定量结果判定。在光镜下选取肿瘤组织中阳性最强的3个高倍视野(×400),数码拍照,图像分析软件Image-Pro Plus 6.0准确分割阳性区域,测量MOD值。相同条件下,每张图片测量3次,每张切片选取3张视野测量,以9次测量的MOD均值作为该视野中蛋白的表达强度。
1.3 子宫颈鳞癌SiHa细胞TEAD4基因瞬时转染
子宫颈鳞癌细胞SiHa(TCHu113,中国科学院上海细胞库)用含10%胎牛血清及双抗的DMEM培养基常规培养于37 ℃、5%CO2的细胞培养箱中。3×105/mL的细胞浓度接种2 mL细胞悬液于6孔板,24 h后更换为无血清无双抗的基础培养基。实验分为3组:control组、vector组(空载质粒)、pCMV3-TEAD4组,分别用无血清无双抗的DMEM 500 μL稀释6 μg的pCMV3-TEAD4过表达质粒(上海吉凯基因科技有限公司)、6 μg的pCMV3空载质粒(上海吉凯基因科技有限公司)和2只10 μL脂质体Sinofection(STFO2,北京义翘神州生物公司),室温孵育5 min,各自将质粒和转染试剂混合形成转染复合物,室温孵育20~25 min,加入对应孔板中。control组加入正常培养细胞的完全培养基,转染后培养6 h,更换培养基为新鲜含10%血清不含双抗的培养基,继续培养至48 h,通过Western blot检测转染效果及相关蛋白变化,每组实验重复3次。
1.4 Western blot
Ripa裂解液中加入蛋白酶抑制剂和磷酸酯酶抑制剂,配成细胞裂解液。利用该细胞裂解液裂解目的细胞从而提取总蛋白,用以检测TEAD4、p-ERK(兔抗人多克隆抗体,AF1015,购自美国Affinity公司)、total-ERK(兔抗人多克隆抗体,16443-1-AP,美国Proteintech公司)和MMP9蛋白表达;蛋白浓度测定后,按每孔20 μL上样量用Loading Buffer和Ripa液配平,沸水加热(5min)后冷却离心上样,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转至PVDF膜上。5%脱脂奶粉封闭,加入一抗4 ℃过夜;TBST洗涤后加入二抗(1:5 000)常温摇床孵育;洗涤膜后,利用ECL化学发光试剂盒孵育发光,显影。利用Image Pro Plus软件测量目的蛋白条带和内参条带的灰度值,以目的条带灰度值与内参灰度值的比值作为蛋白的相对表达水平。每组目标蛋白的表达水平检测实验重复3次。
1.5 CCK-8细胞增殖实验
将正常SiHa细胞制成细胞悬液,按每孔100 μL含2 000个细胞的浓度接种于96孔板,分为control组、vector组、pCMV3-TEAD4组,每组5个复孔,孔板中为无血清无双抗的培养基。细胞贴壁后分别对vector组和pCMV3-TEAD4组的癌细胞分别进行空质粒和pCMV3-TEAD4质粒转染,转染6 h后更换培养基为新鲜含10%血清不含双抗的培养基,继续培养至48 h,加入10%的CCK-8工作液(CCK-8试剂盒,CK04,北京沃比森科技公司),在培养箱继续培养3 h,于酶标仪450 nm处测OD值,计算各组细胞增殖活力值。
1.6 Transwell小室细胞侵袭实验
将pCMV3空载质粒(vector组)和pCMV3-TEAD4过表达质粒(pCMV3-TEAD4组)分别转染SiHa细胞48 h后,调整细胞浓度为5×104/mL,将含有基膜提取物涂层并包被有聚碳酸酯膜的Coring Transwell小室置于24孔板,于小室的上室脂膜上铺一层薄层Matrigel基质胶(约100 μL),待基质胶自然干燥后再于上室接种100 μL上述细胞悬液(含5000个细胞),通过上室的测孔于下室中加入含有15%FBS的DMEM培养基500 μL,并使得上室底部与下室培养基刚好接触,37 ℃培养24 h后,各上室加入适量的苏木精染色5 min,PBS洗涤,环形切割上室底部微孔膜,粘贴于载玻片,中性树胶固封,显微镜下(×200)随机观察5个代表性视野,计数每个视野中细胞数,取均数代表各组细胞的侵袭能力,每组实验重复3次。
1.7 统计学分析
采用SPSS19.0统计软件进行统计学分析,实验数据采用“均数±标准差”,组间比较采用t检验,相关性分析采用Spear相关分析法,P<0.05为差异有统计学意义。
2 结果
2.1 子宫颈鳞癌组织中TEAD4的表达
TEAD4在正常子宫颈上皮中的表达呈弱阳性甚至阴性(图1A);而在子宫颈癌组织中的表达呈明显强阳性,其主要表达于子宫颈鳞癌细胞的胞质和(或)胞核(图1B)。光密度检测分析发现,TEAD4在宫颈鳞癌组织的平均表达水平(0.186±0.355)显著高于其在正常子宫颈上皮中的表达水平(0.0494±0.0105,P<0.001,图1C)。
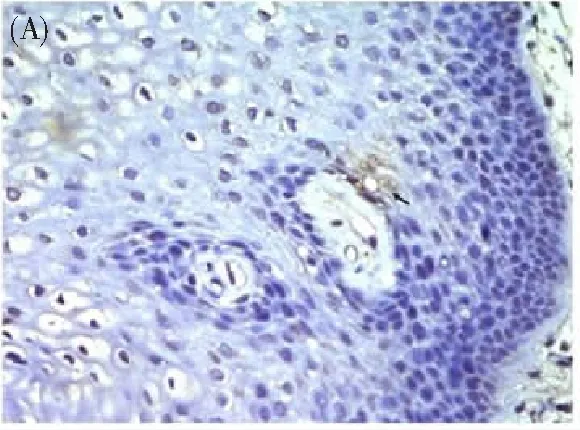
图1 (A)TEAD4在正常宫颈上皮组织中呈微弱表达(Maxvision染色,×400,箭头:微弱表达的阳性细胞)、(B)TEAD4在宫颈鳞癌组织中呈强阳性表达,表达于癌细胞的胞质和/或胞核(Maxvision染色,×400,箭头:强阳性表达的细胞)、(C)TEAD4在宫颈鳞癌(50例)中表达水平显著高于正常宫颈上皮组织(20例),*,P<0.001。
2.2 子宫颈鳞状细胞癌组织中TEAD4的表达与临床病理参数之间的关系
TEAD4的表达与子宫颈鳞状细胞癌淋巴结转移(P<0.05)、脉管浸润(P<0.05)和宫旁浸润(P<0.05)有关,与肿瘤大小、分化程度以及患者的年龄无关(表1)。
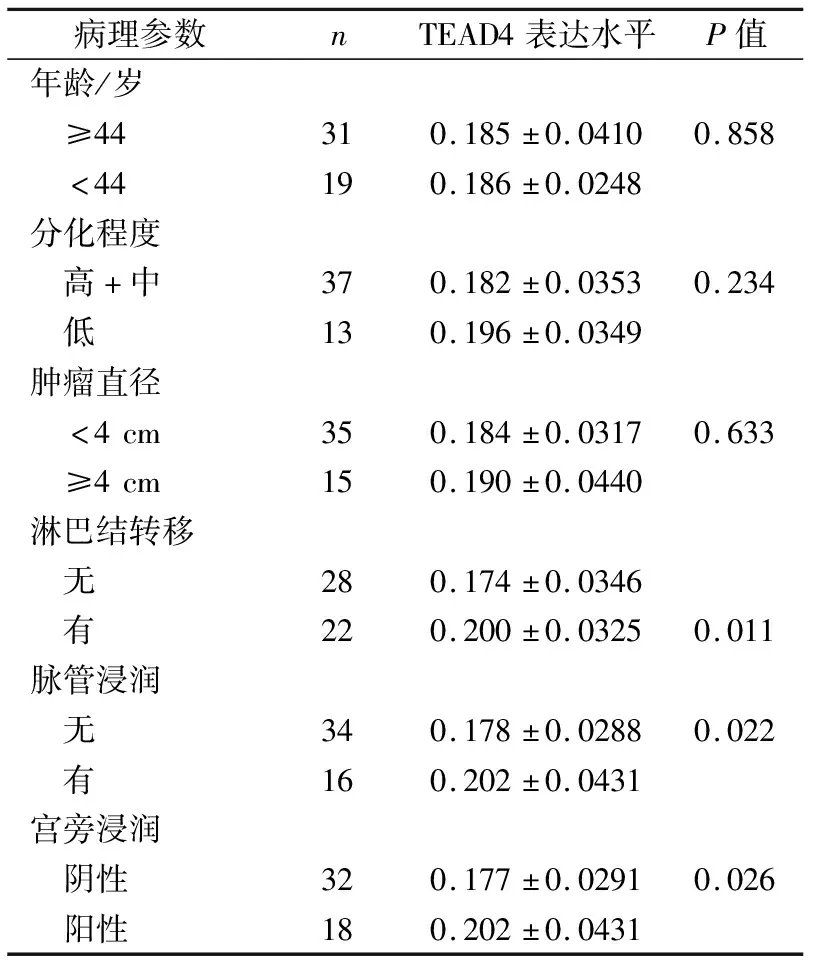
表1 TEAD4的表达与子宫颈鳞状细胞癌病理参数之间的关系
2.3 子宫颈鳞状细胞癌组织中TEAD4的表达与MMP9表达的相关性
MMP9在正常宫颈上皮组织中呈弱表达(图2A),在子宫颈癌组织中呈明显阳性表达,胞质呈棕黄色颗粒(图2B),且MMP9的表达与TEAD4的表达呈正相关(r=0.394,P<0.01,图2C)。

子宫颈鳞状细胞癌组织中TEAD4表达水平
2.4 TEAD4过表达对子宫颈鳞癌细胞增殖能力的影响
pCMV3-TEAD4质粒转染组癌细胞中TEAD4的表达水平(0.84±0.037)显著高于control组(0.43±0.061,P<0.01)和vector组(0.47±0.045,P<0.01),而control组和vector组癌细胞中TEAD4的表达水平无明显差异,说明基因转染成功(图3A-B)。CCK-8细胞增殖实验结果显示(图3C),pCMV3-TEAD4组癌细胞增殖活力(1.18±0.067)分别显著高于control组和vector组癌细胞(0.94±0.033,P<0.01;0.93±0.037,P<0.01)。

图3 (A)宫颈鳞癌细胞TEAD4基因转染组、空白对照组和阴性转染组中TEAD4蛋白的表达,con,空白对照组;vec,空质粒转染的阴性对照组;pCMV3-TEAD4,TEAD4基因表达质粒转染组、(B)TEAD4在TEAD4基因表达质粒转染组(n=3)的表达水平分别显著高于空白对照组(n=3,P<0.001)和阴性对照组(n=3,P<0.001)、(C)TEAD4基因转染组宫颈鳞癌细胞的增殖能力分别显著高于空白对照组(n=5,P<0.001)和阴性对照组(n=5,P<0.001)。
2.5 TEAD4过表达对子宫颈鳞癌细胞侵袭能力的影响
Transwell小室实验结果显示(图4A),pCMV3-TEAD4组癌细胞侵袭能力(81.3±7.23)分别显著高于control组和vector组癌细胞(55.3±8.50,P<0.05;59.0±8.54,P<0.05)(图4B)。
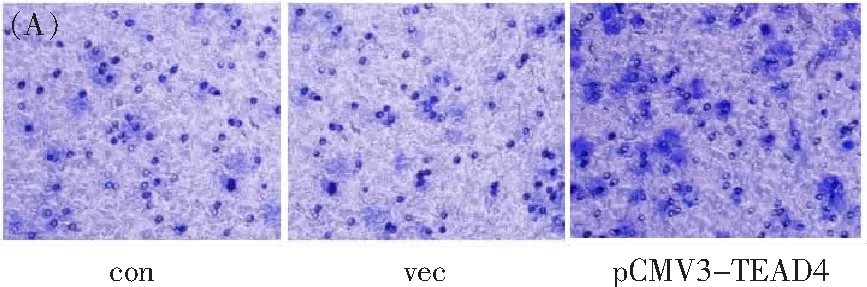
图4 (A)Transwell小室实验检测比较TEAD4基因转染组、空白对照组和阴性转染组的宫颈鳞癌细胞侵袭能力;con,空白对照组,vec,阴性对照组,pCMV3-TEAD4,TEAD4基因转染组(n=3,苏木素染色,×200)、(B)TEAD4基因转染组(n=3)癌细胞侵袭能力分别显著高于空白对照组(n=3,P<0.05)和阴性对照组(n=3,P<0.05)。
2.6 TEAD4高表达对子宫颈鳞癌细胞中ERK磷酸化与MMP9蛋白表达的影响
pCMV3-TEAD4组癌细胞中MMP9的表达水平为(0.93±0.046)显著高于未转染组(0.51±0.040,P<0.05)组(图5),而且pCMV3-TEAD4质粒转染组癌细胞中p-ERK的表达水平(0.57±0.056)显著高于control组(0.34±0.021,P<0.05),提示TEAD4高表达可上调子宫颈鳞癌细胞MMP9的表达水平(图5)。
2.7 ERK活化对TEAD4上调MMP9表达的影响
利用ERK抑制剂U0126预处理癌细胞后再进行pCMV3-TEAD4质粒转染,此联合处理组的癌细胞中p-ERK的表达水平(0.277±0.060)显著低于上述pCMV3-TEAD4质粒转染组(P<0.01),且此时联合处理组癌细胞中MMP9的表达水平(0.46±0.046)也显著低于pCMV3-TEAD4质粒转染组(0.93±0.046,P<0.01),而联合处理组和pCMV3-TEAD4质粒转染组之间的TEAD4的表达水平无显著差异性(P>0.05)(图5)。图5结果显示,高表达TEAD4能增强或提高癌细胞中p-ERK水平和MMP9的表达,且p-ERK能提高MMP9的表达,表明TEAD4能提高癌细胞中MMP9的表达是通过增加p-ERK水平实现的。
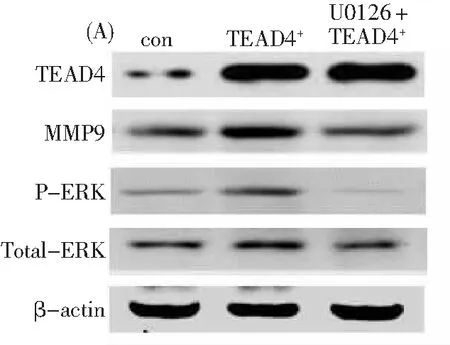
图5 (A)MMP9和P-ERK在正常对照组癌细胞、TEAD4基因转染组癌细胞和ERK抑制剂与TEAD4基因转染的联合处理组癌细胞中的表达,con,正常对照组(n=3),TEAD4+,TEAD4基因转染组(n=3),U0126+TEAD4+,ERK抑制剂U0126与TEAD4基因转染联合处理组(n=3)、(B)MMP9和P-ERK在TEAD4基因转染组癌细胞中的表达水平分别显著高于对照组(P<0.05,P<0.05),而MMP9和P-ERK在ERK抑制剂与TEAD4基因转染的联合处理组癌细胞中的表达水平分别显著低于TEAD4基因转染组(P<0.01,P<0.01)。
3 讨论
作为TEAD转录因子家族蛋白之一,TEAD4分子结构N-末端含有能与基因启动子区MACT模序结合的TEA(transcription enchance activation)结构域[5],C-末端具有与转录共激活因子结合的转录激活结构域[2]。TEAD4的分子结构特征决定了它能与Hippo信号通路中的核心转录共激活子YAP(Yes-associated protein)相结合,形成转录激活复合物,从而介导下游靶基因的转录或偶联其他信号通路的激活。Hippo在调控器官大小与组织稳态方面起着非常重要的作用[6],Hippo信号通路失调会导致器官过度生长乃至肿瘤的发生,因此TEAD4对YAP转录功能的活化作用,决定了TEAD4具有类似原癌基因的功能。TEAD4-YAP作用可通过介导多种下游靶基因的表达,调节肿瘤的代谢[7]、生长[8]、浸润[9]和转移[10]等生物学行为,从而影响恶性肿瘤的进展。有研究报道,TEAD4的高表达与头颈鳞癌[11]、膀胱癌[12]和胶质瘤[13]等多种肿瘤的不良预后有关。至于TEAD4与宫颈癌之间的关系,目前鲜有报道,然而却有实验证据表明,HPV16可诱导角质上皮细胞中TEAD4的高表达[1]。HPV16感染是宫颈鳞状细胞癌的主要病因之一,HPV16能诱导TEAD4表达上调,这一实验证据提示TEAD4很可能参与调节子宫颈鳞状细胞癌发生发展的过程。鉴于前人已研究证实TEAD4对多种恶性肿瘤进展具有调节作用,出于兴趣,本实验通过组织学和细胞学两个水平,研究TEAD4对宫颈鳞状细胞癌的生长和浸润能力的影响,并初步探讨其可能的分子机制。
本实验组织学结果显示,子宫颈鳞状细胞癌组织中TEAD4的表达水平显著高于正常子宫颈上皮组织,提示子宫颈鳞状细胞癌中存在TEAD4的高表达。进一步的临床病理参数分析结果显示,TEAD4的表达与子宫颈鳞状细胞癌淋巴结转移、脉管浸润和宫旁浸润有关,提示TEAD4可能调节子宫颈鳞状细胞癌的生长、局部浸润和转移能力等不良生物学行为,从而促进子宫颈鳞癌的发生发展。Zhang[11]等研究证实,TEAD4高表达于头颈鳞癌组织,且与肿瘤的淋巴结转移等不良生物学行为有关,我们的组织学实验结果与Zhang等的研究报道基本相符。为初步揭示TEAD4促进子宫颈鳞状细胞癌侵袭进展的可能机制,我们检测了与癌生长侵袭有关的最常见指标MMP9的表达情况,结果发现,子宫颈鳞状细胞癌组织中MMP9的表达与TEAD4的表达呈正相关关系,这一结果暗示,TEAD4可能是通过介导MMP9的表达上调从而调节子宫颈鳞状细胞癌的进展。
为进一步验证上述组织学实验结果,本课题通过基因转染的手段改变子宫颈鳞癌SiHa细胞中TEAD4的表达水平,从而观察高水平的TEAD4对子宫颈鳞癌细胞生长和侵袭能力的影响。CCK8实验结果显示,TEAD4基因转染后的癌细胞增殖活力显著高于未转染组和阴性对照组,说明TEAD4能提高子宫颈鳞癌细胞的增殖能力。Transwell小室实验结果显示,与未转染和阴性对照的癌细胞相比,TEAD4基因转染后的癌细胞表现出显著升高的侵袭能力,说明TEAD4能提高子宫颈鳞癌细胞的侵袭能力。为进一步探明TEAD4提高子宫颈鳞癌细胞增殖和侵袭能力是否与MMP9有关,本实验通过Western blotting进一步检测在上述条件下子宫颈鳞癌细胞中MMP9的蛋白水平,结果发现,在TEAD4基因转染后的癌细胞中,MMP9的表达水平也高于未转染组和阴性对照组。该结果说明,TEAD4能介导子宫颈鳞癌细胞MMP9的表达上调。MMP9是一个经典的调节因子,在不同组织起源的癌细胞中能通过不同的信号机制提高癌细胞生长和浸润能力[14-16],我们的实验结果暗示,TEAD4可能通过上调MMP9的表达而促进子宫颈鳞癌细胞的增殖和侵袭能力。诚然,TEAD4能介导多种下游效应分子的表达,例如有研究报道,TEAD4-YAP能通过介导CTGF(结缔组织生长因子)转录从而调节胃癌细胞的增长和浸润能力[17],且可通过介导Jagged1的表达上调而促进肝癌细胞的增殖能力[18]。除了MMP9之外,TEAD4是否还能通过介导其他的下游靶基因转录从而促进子宫颈鳞癌细胞的增殖和浸润能力,尚须进一步研究。
为深入研究TEAD4调节子宫颈鳞癌增殖和浸润能力的分子机制,本课题检测了在不同的TEAD4表达水平条件下癌细胞中相关信号分子的活化水平情况。在TEAD4基因转染后的癌细胞中,ERK的活化形式P-ERK的水平显著高于未转染组,说明TEAD4能活化子宫颈鳞癌细胞中ERK信号。为进一步明确TEAD4介导MMP9的表达上调是否与ERK信号的活化有关,本实验利用ERK活化抑制剂U0126预处理子宫颈鳞癌细胞,然后再进行TEAD4基因转染,结果惊奇的发现,与正常转染组的癌细胞相比,在ERK活化受抑制的条件下,癌细胞中MMP9的表达水平显著低于正常转染组,这一结果说明TEAD4是通过激活子宫颈鳞癌细胞ERK信号这一途径来上调下游靶基因MMP9的表达。Chang等研究证实[19],TEAD4能通过活化ERK信号通路而促进肺腺癌的进展,我们的实验结果与Chang的研究结果相符。作为经典的Hippo信号共激活子,TEAD4通常与YAP结合形成复合物介导下游靶基因的转录或者偶联其他信号通路的活化,但最新有学者通过与YAP结合缺陷的突变体TEAD4Y429进行回补实验证实,TEAD4能通过不依赖与YAP结合的方式调控结肠癌中Vimentin的表达,从而促进结肠癌EMT的发生[20],这可能与TEAD4分子结构中的DNA结合域的功能有关。可见,TEAD4可通过YAP依赖和YAP非依赖的方式介导下游靶分子的活化或转录,那么在子宫颈鳞癌细胞中,TEAD4介导ERK信号的活化是否具有YAP依赖性,尚需要进一步研究证实。此外,本课题组织学研究发现,TEAD4表达于子宫颈鳞癌细胞的胞质和/或胞核,TEAD4促进子宫颈鳞癌生长浸润能力是否与它在癌细胞中的表达定位有关,也值得我们深入研究。
综上所述,本研究证实子宫颈鳞癌中存在TEAD4的高表达,TEAD4能提高子宫颈鳞癌的生长浸润能力,其分子机制与TEAD4活化ERK信号从而上调癌细胞MMP9的表达有关。
