等离子体技术的固氮应用
2022-01-27卢新培雷昕雨刘大伟聂兰兰
卢新培,雷昕雨,程 鹤,刘大伟,聂兰兰
(1.华中科技大学电气与电子工程学院,湖北 武汉 430074;2.南京理工大学化学与化工学院,江苏 南京 210094)
氮是生物体必不可少的组成部分,它是氨基酸、蛋白质、核酸等的重要成份,固氮过程与人类生存息息相关[1-2]。地球大气中的N2比例高达78.09%,然而,由于其牢固的N≡N,需要高达9.79eV活化能才能将其打破[3]。因此,大气中的N2难以被大多数生物体直接利用。通过将氮分子(N2)转化为可吸收的含氮化合物(如NOx、NH3等),这一过程称为固氮。
自然界中存在两种固氮方式,一种称之为生物固氮,即利用微生物将大气中的N2转变成可吸收的含氮化物,并将其供应给植物,如根瘤菌能够将分子氮还原为NH3供宿主细胞利用[4]。另外一种是通过闪电将空气中的N2和O2结合形成氮氧化物(NOx)。基于上述两种方式,自然界每年固氮量将近3亿吨,但这远不能满足人口不断增长的需求。近一个世纪以来,基于Haber-Bosch(H-B)工艺的传统工业固氮技术支撑了全球40%的人口生存[5-6]。然而,该技术每年需要消耗全世界1%~2%的能源和3%~5%的天然气产量[6],同时H-B工艺的CO2排放占据全球工业CO2排放的12%以上[7-8],严重加剧了温室效应。由于H-B工艺带来的的高能耗,高碳排放及环境污染等问题,美国工程院将固氮列为21世纪14个大的工业挑战之一[9]。
等离子体固氮工艺被视为取代H-B工艺的下一代关键技术[10]。首先,不同于H-B工艺需要在高温(400-600℃)、高压(200-400atm)下进行,等离子体产生的高能电子可以在常温常压下打破牢固的N≡N,所以是一种高效节能的固氮技术。H-B工艺由于具有能量密集型的显著特征,因此需要进行大规模集中式生产,而等离子体固氮设备无高温和高压的需求,可以建立分布式小型工厂,实现就地生产氮肥,故其设备成本和运输成本远低于H-B工艺。另一方面,等离子体固氮可使用空气和水为原料,无需使用煤及天然气等其他化石原料,所以该固氮工艺可以实现二氧化碳零排放。最后,等离子体固氮工艺可以实现即开即用,无需预热及稳定过程,因此非常适合利用风电、太阳能等不稳定的可再生能源,实现氮肥的生产。
有数值计算表明,等离子体固氮的理论能耗值为0.2 MJ·mol-1,仅为H-B工艺的0.5倍[11],该理论能耗值是反应N2+O2→2NO所需的最小能量,即NO的形成焓。事实上,降低等离子体固氮能耗的关键在于如何选择或找到更节能、更高效的路径和方式去克服NO合成的关键化学反应——Zeldovich反应(N2(v)+O→NO+N)的反应能垒。Wang等人通过建立等离子体0-D模型,发现约化电场可以调控N2的振动激发水平,从而更节能、更高效地进行Zeldovich反应[8]由于不同等离子体类型其约化电场不相同,因此其固氮能耗也不尽相同。另外,由于不同等离子体反应器结构,其气体利用率也会不同,因此也会导致不同的固氮能耗值。有关不同等离子体类型和不同反应器结构下固氮性能的详细对比将在本文后续章节进行讨论。
本文余下部分将分别讲述等离子体固氮技术应用的两个方面,即由空气形成氮氧化物(NOx),以及由氮气(N2)和氢气(H2)合成氨(NH3)。首先,介绍其反应原理,然后,比较了目前常用于固氮技术的等离子体类型及其固氮产量与能耗,并在此基础上总结了等离子体固氮技术未来的研究重点。
1 等离子体固氮合成NOx
1.1 等离子体合成NOx的反应机制
国内外已有很多研究学者开展了等离子体合成NOx的实验或数值模拟研究,旨在找出提高等离子体合成NOx的产率和效率的方法和关键反应路径。较早的研究如Amouroux等人进行了在6.67-53.3 mbar气压范围,高频非平衡等离子体合成NOx的实验研究,并提出了形成NO的两种反应路径[12],即
(1)
(2)
(3)
N+O2→NO+O
(4)
其中,反应方程(1)和(2)揭示了第一种形成NO的反应路径,该过程是在高气压以及低氮氧比的条件下直接合成NO;反应方程(3)和(4)揭示了第二种形成NO的反应路径,该过程是在低气压以及低氮氧比的条件下让N2解离合成NO。另外,该作者从这项研究中发现氮的反应性程度与其振动程度成正比,而且固氮效率会随着等离子体反应器表面与体积之比的降低而降低,即表面反应在NO合成中也起了重要作用。Macheret等人研究了大气压非平衡等离子体合成NO的能耗,他们指出氮的振动激发是高效合成NO的反应路径[13]。Cheng等人通过构建纳秒脉冲等离子体合成NO全局模型,发现电子激发分解产生激发态N*原子和O在NO产生过程中起主导作用[14]。另外,他们还研究了等离子体与催化剂的协同作用,发现了等离子体高瞬时功率诱导催化剂活化的机制,从而导致表面反应速率的提升[15]。Rapakoulias等人[16]开展了等离子体和非均相催化剂(如MoO3和WO3)协同合成NO的实验研究,发现振动激发的N2(N2(v))对NO的产生起到非常重要的作用。该过程的反应机理如下:
(5)
(6)
上述产生NO的反应可大致分为三个步骤[16-17],首先,通过等离子体内各种粒子之间的碰撞增加N2的振动能量,导致这些N2在固体表面发生极化和吸附,进而分解为Nads。然后,这些固体表面的Nads与金属氧化物中的游离O发生表面反应产生NOads。最后,通过解吸附过程释放NO。
从上述反应步骤可以看出,合成NO的关键在于破坏N2分子中的N≡N(9.77 eV)[3]。下述反应方程(7)给出了一种破坏N≡N的方式,即通过低振动态N2进行振动分解形成N。反应方程(7)和(8)给出了通过振动态的N2合成NO的总反应步骤,该反应机制也被称为Zeldovich机制[3],即首先通过低振动态N2进行振动分解形成N,然后N与O2发生放热反应产生NO和O,同时生成的O也会与N2反应形成NO,从而使反应不断进行。
(7)
(8)
当然,并非所有的等离子体固氮反应都是以N2的振动分解为主导,有些等离子体类型,如介质阻挡放电(DBD)主要是通过电子激发实现N2的离解,从而产生NO。但是,由于电子激发路径的能耗较高,所以其固氮效率远低于Zeldovich机制[3],因此,使用这一等离子体类型合成NOx的产率和能效都会比较低,这一点我们将在1.2节进行讨论。
1.2 不同等离子体反应器合成NOx效果
事实上,首次报道有关等离子体固氮合成NO的工作是在1908年[18-19],通过Birkeland-Eyde工艺中的高温电弧放电产生较高浓度的NO,但由于其能耗过大,后被H-B工艺取代。然而,近年来由于各种不同类型等离子体的兴起,尤其是非热平衡等离子体出现,导致等离子体固氮合成NOx再一次成为热点。不同于传统热等离子体,非热平衡等离子体会优先加热电子,导致电子能量能够高达十个eV量级,而气体温度却远低于电子,从而实现在常温常压下高效打破N≡N。从而极大地降低等离子体固氮的能量损耗。正因为如此,等离子体固氮最低能耗的理论值仅为传统H-B工艺的0.5倍。
对于等离子体固氮合成NOx,国内外研究学者围绕多种不同的放电类型,开展了大量等离子体固氮研究,其中包括火花放电[20-23],射频放电[24],激光放电[25],电晕放电[20,26],辉光放电[21,27],填充床式DBD[21,28],滑动弧等离子体[6,8,21,29],微波等离子体[30,31],以及等离子体射流与水反应[5,32]。图1给出了直流辉光等离子体、微波等离子体、DBD以及滑动弧等离子体这四种常见等离子体类型的反应器结构示意图。表1给出了部分等离子体固氮的NOx产率和能耗测量结果。
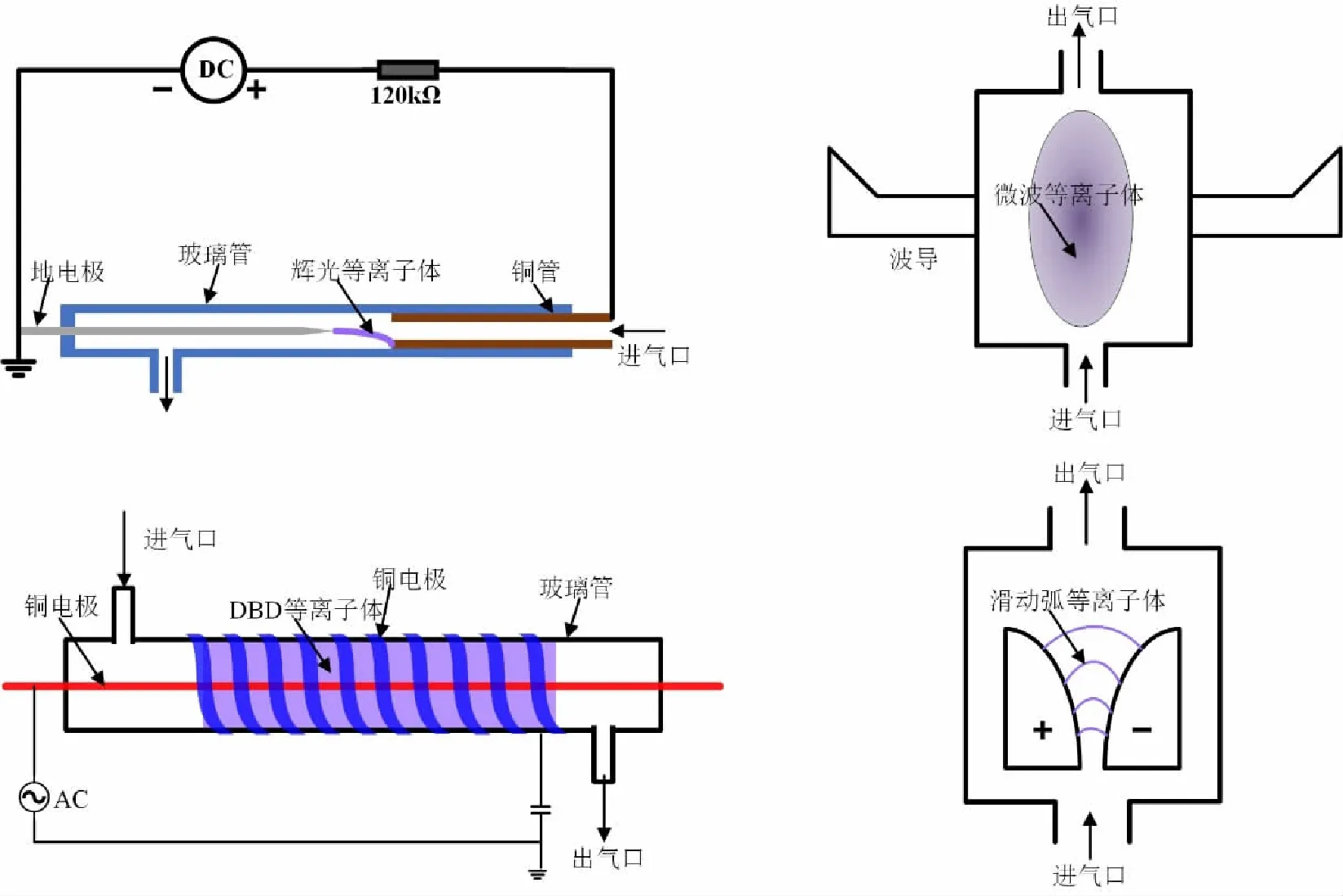
图1 四种常见等离子体类型的反应器结构示意图
从表1可以看出,在不同放电类型之间,NO产率通常在百分之几的范围内,但其固氮能耗值范围差异非常大,从0.28 MJ·mol-1到1057 MJ·mol-1。
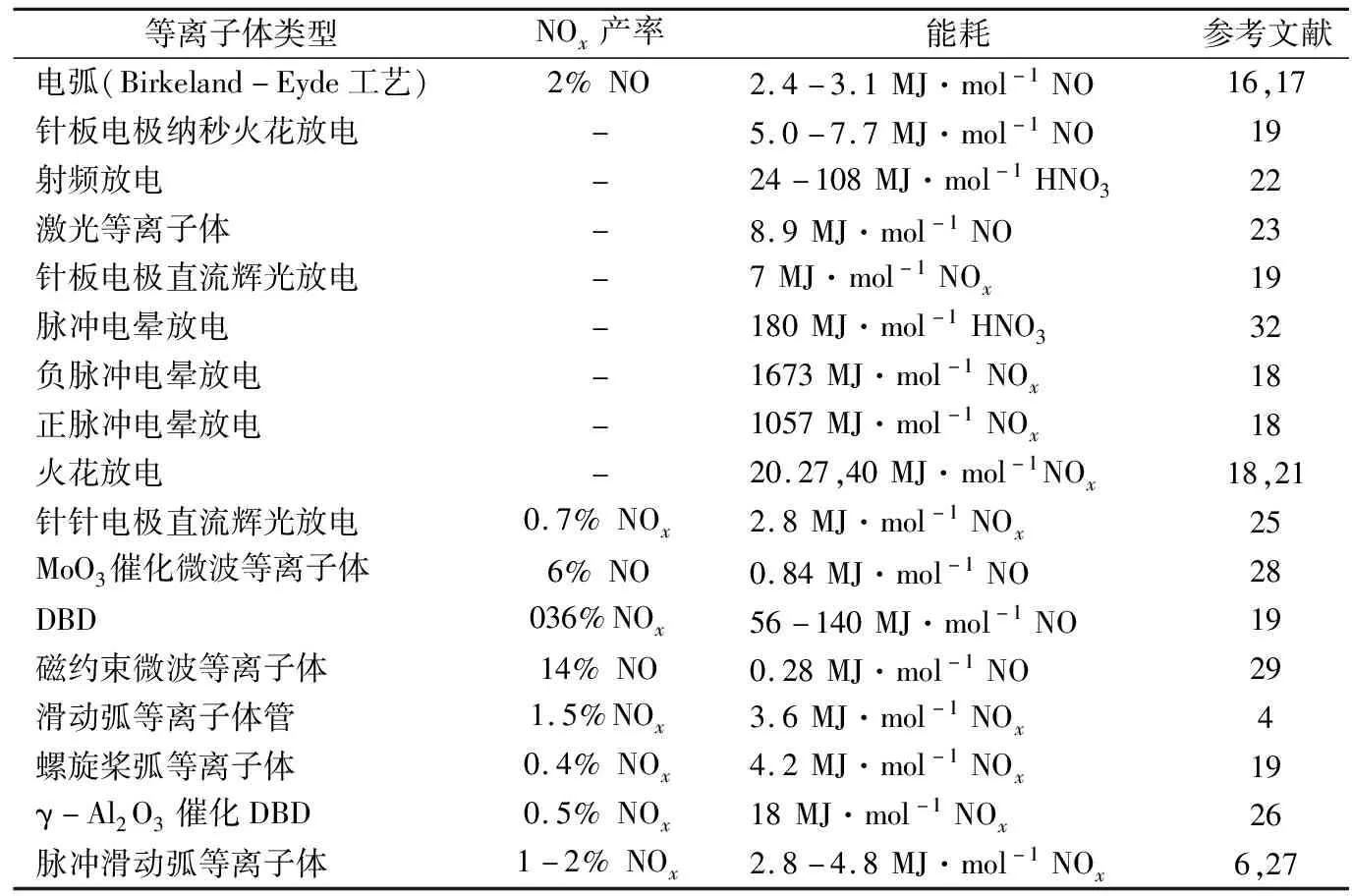
表1 各种等离子体类型的NOx产率和能耗结果
从表中的实验数据可知,低压下运行的微波等离子体固氮效果最佳,如微波等离子体协同催化固氮的NO产率为6%,耗能为0.84 MJ·mol-1;磁约束的低压微波等离子体的最高NO产率为14%,其对应的最低能耗仅为0.28 MJ·mol-1。但是,微波等离子体在低压运行时均需要真空设备,还需要对反应器进行冷却,故微波等离子体较难被工业推广应用,而且其能耗值也并未考虑真空设备和冷却设备的能耗,因此,微波等离子体的实际能耗会高于该测量结果。除了微波等离子体,滑动弧等离子体被认为是最具前景的等离子体固氮形式[8,33],因为滑动弧等离子体可以在大气压下有效利用振动态N2粒子。目前,Patil等人得到了滑动弧等离子体固氮的最好效果,即NOx的产率为2%,能耗为2.8 MJ·mol-1[29],但该固氮效果仍具有较大的优化空间。
另一方面,从表中可以发现,与微波等离子体或滑动弧等离子体相比,DBD等离子体即使与催化剂结合使用,其固氮能耗仍然较高。其潜在原因是由于DBD的特征约化电场在100~200 Td之间[34],因此等离子体固氮的化学反应主要以电子激发为主,而电子激发需要更高的能耗,从而导致高能耗固氮。但是,由于DBD等离子体能够在大气压下操作,易于规模化,并且能够与催化剂结合实现协同固氮,因此,DBD等离子体固氮仍然是未来固氮研究的重要方向之一。
1.3 等离子体合成NOx的研究重点
目前,等离子体合成NOx的固氮技术尚处于起步阶段,迄今报道的等离子体合成NOx的能耗仍远高于H-B工艺,无法满足工业应用需求。因此,为了实现固氮规模化应用,如何提高NOx转化率、以及降低固氮能耗都是未来研究的重点。
从等离子体合成NOx的反应原理来看,NOx的产生首先依赖于N≡N的分解过程。理论研究认为[1,8,35],等离子体N2分解机制主要包括以下五种方式:电子碰撞直接分解(9);电子激发分解(10);电子与离子的复合分解(11);激发态碰撞分解(12);振动分解(13),具体哪种机制在何种条件下起主要作用很大程度上取决于放电类型。
e+N2→e+2N
(9)
(11)
(12)
N2(v)+M→2N+M
(13)
其中,反应(13)的M为任意中性粒子。通过对这五种分解机制进行分析可以看出,对于分解机制(9)~(11),电子起着关键性的作用,而对于(12)和(13)这两种机制,首先必须产生激发态N2*和振动态N2(v),而他门的产生也离不开电子碰撞,因此他们的产生也离不开电子。另外,对于振动分解(13),通过对振动态粒子的诊断就可以直接获取各振动能级N2(v)的信息。因此,电子和振动态粒子密度和温度是深入了解N2分解机制的关键,也是提高N2分解效率的关键,故对电子和振动态粒子的密度和温度进行诊断,并实现对它们的调控从而使N2高效分解,是未来固氮研究的重点方向之一。
另一方面,理论和实验研究表明[15,36-38],等离子体和催化剂存在协同效应。催化剂的存在可以诱导某些关键反应路径的改变,如在催化剂作用下,等离子体中某些处于较低振动能级的N2粒子的反应速率可能会显著提升,从而实现较低振动能级的N2在催化剂表面上直接分解。因此,为了深入了解等离子体协同催化下的固氮反应路径,研究协同效应对电子密度和振动态粒子密度的影响,必须结合等离子体协同催化仿真模型,对等离子体与催化剂协同反应机理开展系统深入研究。
2 等离子体合成NH3
2.1 等离子体合成氨的反应原理与动力学分析
为了提高合成氨的转化率和能量效率,必须深入了解等离子体合成氨中的中间产物和化学途径[39]。方程(14)为N2和H2作为反应物合成NH3的总反应方程式,其动力学过程可以通过幂方程(15)来描述[40]。
N2(g)+3H2(g)→2NH3(g)
(14)
(15)
其中,α和β的值越大代表合成氨速率越快。已有动力学分析表明[41],与传统基于过渡金属热催化下的合成氨方法相比,等离子体合成氨的反应系数α和β的值较低,即等离子体合成氨的速率相对较慢。而且,由于α值普遍低于β值,因此,等离子体合成氨的动力学反应更多地受N2解离的限制,即提高N2解离速率是提高等离子体合成氨速率的关键[42-43]。另外,合成氨的反应机制也可以通过反应(16)~(20)来描述[44-45]:
N2→2N*
(16)
H2→2H*
(17)
N*+H*→NH
(18)
(19)
(20)
在上述等离子体反应粒子中,NH自由基是NH3形成的前体,其浓度对氨合成速率有很大影响[46]。Hong等人通过考虑电子、振动粒子以及表面吸附反应,发现自由基与振动激发分子之间的反应对合成氨具有显著影响。另外,他们还指出等离子体合成氨机制中,气相中的电子激发和振动激发反应、以及表面吸附的自由基对于合成氨的重要性。反应(16)~(20)可以分解成更为详细的气相反应(21)和(22)[47],表面吸附反应(23)和(24)[39]、及气相和表面吸附粒子之间的协同反应(25)和(26):
e+N2→e+2N
(21)
N+H2(ν)→H+NH
(22)
N+surf→N(s)
(23)
H+surf→H(s)
(24)
NH+H(s)→NH2(s)
(25)
NH2(s)+H(s)→NH3
(26)
其中surf代表催化剂吸附表面;(s)代表表面吸附粒子;(υ)代表振动激发的分子。在气相中,由电子激发N2形成的N与振动激发的H2反应形成NH自由基,然后,这些NH自由基可以通过与气相中的H反应或被催化剂表面吸附的H反应形成NH3[47]。因此,从反应原理来看,促进N2在气相中的解离和促进表面吸附反应是提高等离子体合成氨效率的关键。
2.2 不同等离子体反应器的合成氨效果
Uyama等人首次实现在大约700 Pa的压力下,使用微波和射频等离子体合成氨[48]。为了避免使用真空系统进行等离子体合成氨反应,用DBD等离子体合成氨的方式近年来受到广泛关注。
表2列出了近年来有关等离子体合成氨的研究结果[49-59],从表中可以看出,许多研究集中在DBD与金属催化剂结合使用方面。研究发现DBD等离子体与不同类型催化剂协同催化合成氨的效果也不一样,其能耗变化范围较广,量级从几百MJ·mol-1到1 MJ·mol-1。比如,在单催化系统中,即仅使用一种金属(如MgO、铜丝等)作催化剂,使用毛状铜丝催化合成氨的效果比MgO催化合成氨的效果好[58,60],这是因为毛状铜丝催化剂可以增加电极的表面积,允许更多的放电,从而实现高效合成氨。另外,Iwamoto等人[61]对Au、Pt和Pd等不同毛状金属催化剂进行了对比分析,发现对于毛状金属催化剂,Au的活性最高,催化效果最好。第二种催化系统称为“催化剂-载体系统”,其金属催化剂(如Ru)会覆在MgO或Al2O3载体表面,该类型催化剂与等离子体协同合成氨就能源效率而言,比单催化系统表现更好[50,53,62],但其性能仍然不如第三种催化系统,即催化剂-载体和促进剂系统[56]。研究表明[63-65],使用碱金属促进剂,如Cs、Ba和K,能够有效降低N2解离的势垒,提高催化体系的催化活性,并促进等离子体合成氨过程中中间产物NHx的不稳定,从而提高合成效率和转化率,故综合来看,等离子体结合第二、三种催化系统的合成氨效果较好。

表2 各种等离子体类型的NH3产率和能耗结果
2.3 等离子体合成氨的研究重点
目前,已经报道了一些不同类型催化剂来辅助等离子体合成氨方面的工作。从实验结果来看,合成氨产率和能效都有了显著提升,但与H-B工艺相比,合成氨产率和能量效率仍然较低,因此,如何提高氨产率和能效仍然是目前需要突破的难点。从等离子体合成氨反应机理和已有实验结果来看,设计或采用不同类型催化剂结合促进N2的解离和促进表面吸附反应是提高等离子体合成氨效率的关键之一。但由于等离子体的复杂性以及高反应性,等离子体合成氨的物理化学反应路径错综复杂,故通过等离子体诊断技术,厘清反应路径,找到N2的解离最佳反应路径是目前等离子体合成氨的研究重点之一。此外,由于等离子体化学反应的非选择性会导致最终生成产物的多样性,因此,也需要合理设计出针对等离子体环境的催化剂,来提高NH3的产率。最后,需要注意的是,有研究表明,等离子体对氨有分解作用[66-67]。虽然等离子体功率的增加会导致高能电子的增加,促进NH3的合成,但其也会导致重要反应中间体(如NH*)的增加,从而导致逆反应的发生(氨分解)[68],因此,等离子体合成氨反应应该在较低功率下进行,并且等离子体功率的最优取值范围仍需要进一步探索。此外,Wang等人[69]证明了等离子体可以在Fe催化剂的帮助下分解氨,而且也有研究表明,Fe、Co、Cu和Ni等过渡金属在等离子体辅助氨分解过程中表现出相对较高的活性[70-71]。因此,为了尽量减少等离子体合成氨过程中NH3的离解,等离子体功率的应避免使用过渡金属,并设计或选择合适的催化剂来降低逆反应的速率,从而提高氨产率也是未来的研究重点之一。
3 结论和展望
本综述讨论了等离子体固氮技术的优势、目前的研究进展以及研究重点。等离子体固氮技术的主要优势在于其易于模块化、分布式生产,因而生产及运输成本低,通过使用可再生能源,在操作方面极具灵活性,并且可以实现CO2零排放。然而,如何提高等离子体固氮效率仍需要进一步开展研究。目前,国内外学者针对不同放电等离子体源开展了大量的固氮效率分析,并探究固氮反应机理,以及等离子体和催化剂之间的协同固氮机制等。未来的研究的重点主要包括三个方面:首先是掌握调控电子密度和振动态粒子分布的关键方法,实现N2高效分解;第二是明晰等离子体固氮的核心反应路径,调控放电参数实现等离子体固氮效率的提升;第三,厘清等离子体与催化剂间的协同作用机理,开发出高效地等离子体协同催化系统,实现协同固氮效率最优。
