盐酸美他环素片《中国药典》2020年版微生物限度检查方法适用性试验
2022-01-27杭婧
杭 婧
(淮安市食品药品检验所,江苏 223300)
盐酸美他环素是一种半合成四环素,具有免疫抑制、抗炎、抗菌谱广等特点,对多种革兰阳性菌和革兰阴性菌均有明显的抗菌作用,对立克次体、支原体、衣原体也存在抑制作用。盐酸美他环素片在临床上通常用于治疗斑疹伤寒、痤疮、输卵管炎、支原体属衣原体属导致的感染等。本品为口服非无菌化学药品固体制剂,处方不含脏器提取物,目前还没有关于本品《中国药典》2020年版微生物限度适用性检查的报道。
本试验采用常规法、稀释法、中和法、薄膜过滤法进行试验。旨在消除供试品对试验菌的抑菌作用,真实反映本品的微生物污染状况。参考《中国药典》2020年版四部通则1105、1106、1107,进行了微生物限度检查方法适用性试验。
1 仪器与材料
1.1 仪器 洁净工作台(BCM-1600A,苏州安泰空气技术有限公司);电热恒温鼓风干燥箱(101-3,上海跃进有限公司);SPX-350型生化培养箱;集菌仪(杭州泰林HTY-2000B);高压蒸汽灭菌锅(MLS-3781L-PC型,松下);生物安全柜(BSC-1304IIA2,苏州安泰空气技术有限公司);电子天平(PL6001,梅特勒公司)。
1.2 供试品 盐酸美他环素片(批号201002,规格:0.1 g,江苏正大清江制药有限公司)。
1.3 验证用菌 枯草芽孢杆菌[CMCC(B)63501]、金黄色葡萄球菌[CMCC(B)26003]、铜绿假单孢菌[CMCC(B)10104]、黑曲霉[CMCC(F)98003]、白色念珠菌[CMCC(F)98001]均来源于中国食品药品检定研究院。
1.4 培养基与试剂 胰酪大豆胨液体培养基(TSB)(批号1090522),来源于北京三药科技开发公司。沙氏葡萄糖琼脂培养基(SDA)(批号191012)、麦康凯液体培养基(批号1096825)、麦康凯琼脂培养基(批号1103195)、胰酪大豆胨琼脂培养基(批号1083181)、沙氏葡萄糖液体培养基(SDB)(批号1091022),来源于广东环凯微生物科技有限公司。以上培养基规格均为250 g。无菌氯化钠注射液(250 ml∶2.25 g,批号200514 2C),江苏淮安双鹤药业有限责任公司。氯化镁(AR,上海振兴试剂厂,批号20210114)。
2 方法与结果
2.1 菌液制备 接种金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌的新鲜培养物至胰酪大豆胨液体培养基中,30~35℃培养18~24 h,用无菌氯化钠注射液制成每1ml含菌数小于100 cfu的菌悬液备用;接种白色念珠菌的新鲜培养物至沙氏葡萄糖液体培养基中,20~25℃培养24~48 h,用无菌氯化钠注射液制成每1 ml含菌数小于100 cfu的菌悬液备用。接种黑曲霉的新鲜培养物至沙氏葡萄糖琼脂斜面培养基上,20~25℃培养5~7 d,用含0.05%(ml/ml)聚山梨酯80的无菌氯化钠注射液制成每1 ml含孢子数小于100 cfu的孢子悬液备用。
2.2 供试液制备 取供试品10 g,加稀释液pH 7.0氯化钠-蛋白胨缓冲液100 ml(若加中和剂则含10 g氯化镁),匀浆仪混匀,作为1∶10供试液。取1∶10供试液10 ml,加上述稀释液90 ml,混匀,作为1∶100供试液。取1∶10供试液2 ml,加上述稀释液98 ml(若加中和剂则每100 ml含10 g氯化镁),混匀,作为1∶500供试液。
2.3 微生物计数方法适用性试验
2.3.1 供试液与菌液先混合
2.3.1.1 试验组 取“2.2”项下制备的供试液10 ml,加入“2.1”项下制备的试验菌液0.1 ml,混匀,使每1 ml供试液中含菌量不大于100 cfu。每皿加1 ml含菌供试液,倾注相应培养基,分别按规定培养。
2.3.1.2 菌液组 取稀释液(pH 7.0氯化钠-蛋白胨缓冲液)代替供试液,按“2.3.1.1”项下方法操作,加入试验菌液并进行微生物回收试验。
2.3.1.3 供试品对照组 取制备好的供试液,以稀释液(pH 7.0氯化钠-蛋白胨缓冲液)代替菌液同“2.3.1.1”项下方法操作。
2.3.1.4 试验结果 根据《中国药典》2020年版,各试验菌回收比值在0.5~2,符合方法适用性试验要求。若试验组菌落数减去供试品对照组菌落数的值小于菌液对照组菌落数的50%,可采用增加稀释液或培养基体积;加入适宜的中和剂或灭活剂;薄膜过滤法等方法去除或灭活产品的抗菌活性[1],结果见表1。由表1可知,需氧菌总数、霉菌和酵母菌总数的菌数回收率均低于0.5,故加入中和剂以及稀释法再次进行试验,结果见表2-3。由表2得出,中和剂对照组菌落数与菌液对照组的菌落数比值在0.5~2范围内。表2和表3得出,5种菌的试验组菌数减去供试品对照组菌落数的值与菌液对照组菌落数的比值低于0.5,说明不适合用上述方法进行需氧菌总数、霉菌和酵母菌总数计数。考虑到本品的强抑菌作用,考虑用加中和剂薄膜过滤法进行验证,结果见表4-5。中和剂对照组菌落数与菌液。
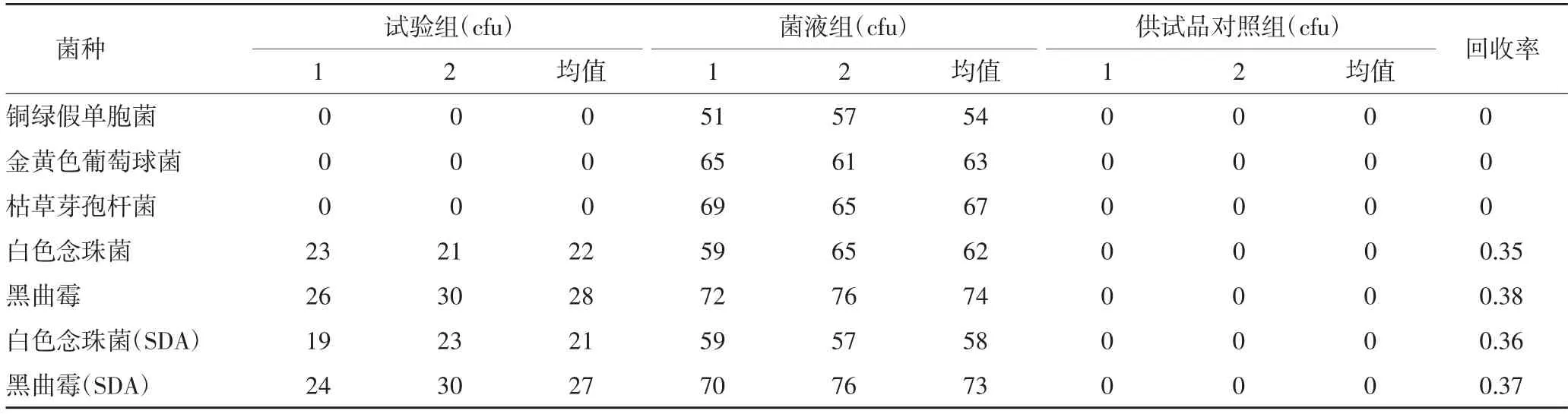
表1 计数方法适用性试验结果(平皿法,1∶10供试液)
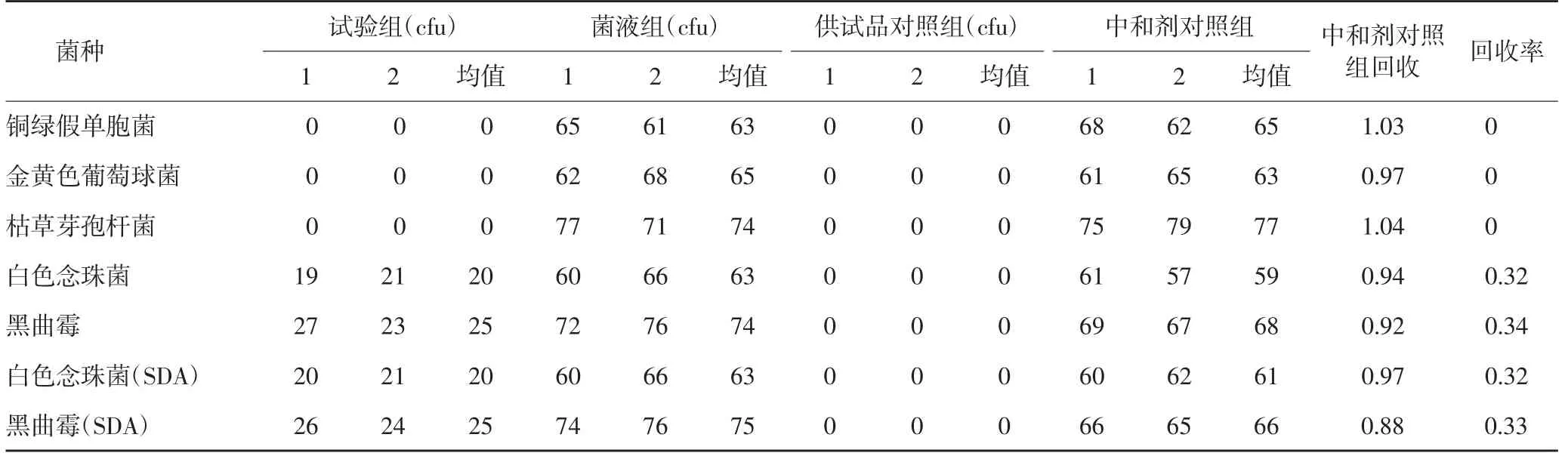
表2 计数方法适用性试验结果(加中和剂平皿法,1∶10供试液)

表3 计数方法适用性试验结果(稀释法,1∶100供试液)
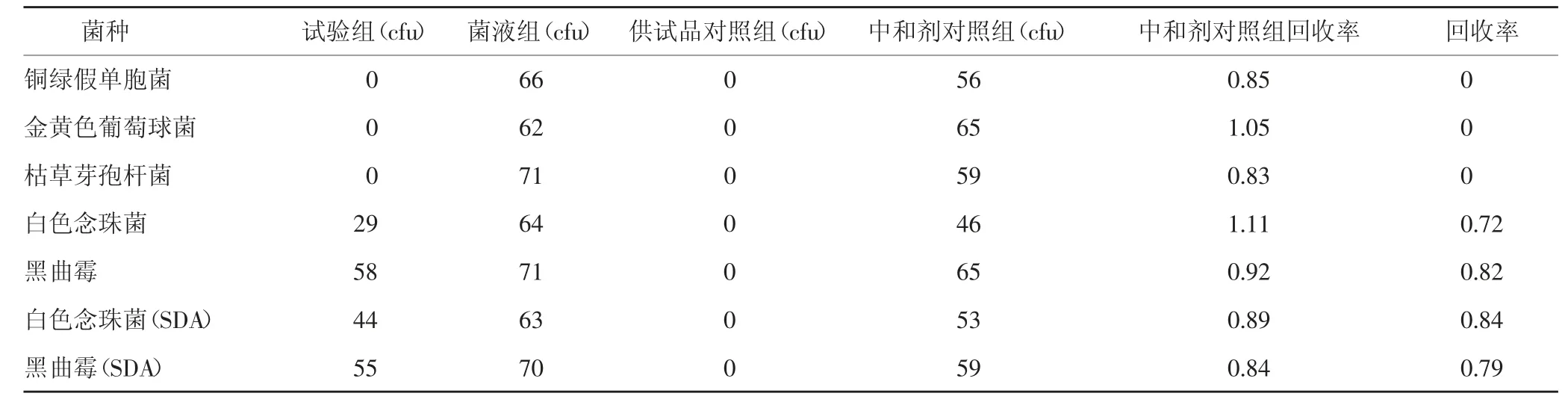
表4 计数方法适用性试验结果(加中和剂薄膜过滤法,1∶10供试液)
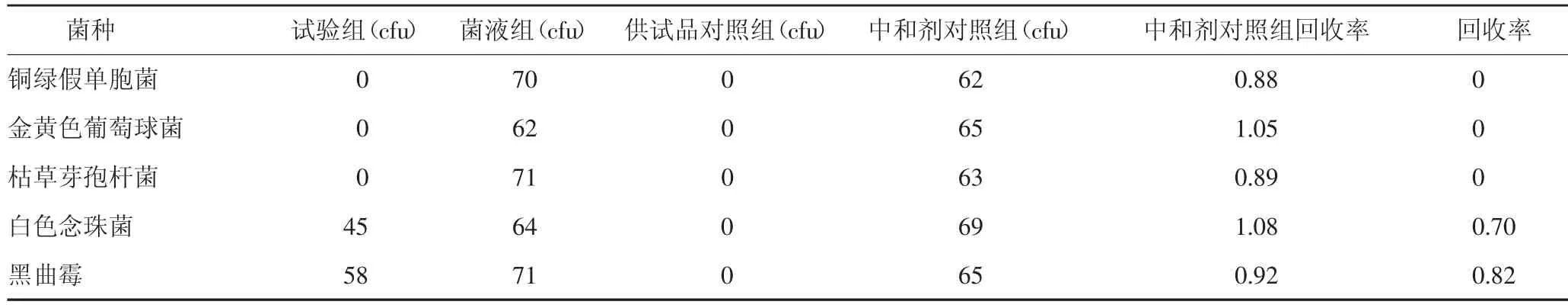
表5 计数方法适用性试验结果(加中和剂薄膜过滤法,1∶500供试液)
对照组的菌落数比值在0.5~2范围内。表4可以看出白色念珠菌、黑曲霉的试验组菌数减去供试品对照组菌落数的值与菌液对照组菌落数的比值在0.5~2范围内,说明可用该法进行该供试品的霉菌和酵母菌总数计数;铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌的试验组菌数减去供试品对照组菌落数的值与菌液对照组菌落数的比值均小于0.5,说明不适合用上述方法进行需氧菌总数计数。
2.3.2 供试液与菌液后混合
2.3.2.1 试验组 取“2.2”项下制备好的1∶500供试液10 ml,静置10 min,取上清液1 ml至250 ml稀释液中,混匀。经两膜滤器过滤后,用无菌氯化钠注射液冲洗滤膜,两膜共冲洗1 750 ml,在最后一次冲洗时加入试验菌(小于100 cfu)抽干后,取出滤膜,菌面朝上贴入规定培养基平板上,分别按规定培养。
2.3.2.2 菌液组 稀释液代替供试液,按试验组操作加入试验菌液并进行微生物回收试验。
2.3.2.3 供试品对照组 取“2.2”项下供试液,以稀释液代替菌液同试验组操作。
2.3.2.4 结果 采用后加菌薄膜过滤法试验,铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念珠菌、黑曲霉的试验组菌数减去供试品对照组菌落数的值与菌液对照组菌落数的比值均在0.5~2范围内,说明可用该法进行该供试品的需氧菌总数计数。结果见表6。
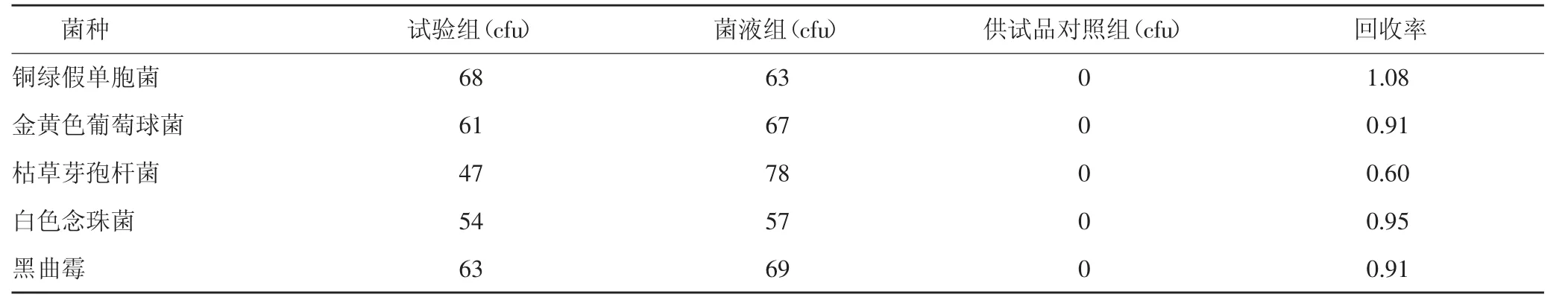
表6 需氧菌总数计数方法适用性试验结果(后加菌薄膜过滤法,1∶500供试液)
2.4 控制菌检查检查方法适用性试验 本品为口服非无菌化学药品固体制剂,处方不含脏器提取物,故其控制菌检查大肠埃希菌。
2.4.1 常规法和稀释法
2.4.1.1 试验组 取“2.2”项下的1∶10供试液10 ml,分别接种至100 ml(常规法)和500 ml(稀释法)胰酪大豆胨液体培养基中,加入1 ml(<100 cfu)的大肠埃希菌。
2.4.1.2 阳性对照组 用无菌氯化钠注射液代替供试液,其余同试验组操作。
2.4.1.3 阴性对照组 用无菌氯化钠注射液代替供试液,不加菌液,其余同试验组操作。
2.4.1.4 供试品组 不加菌液,其余同试验组操作。
2.4.1.5 选择和分离培养 按《中国药典》2020年版规定,取上述培养物1 ml分别接种至100 ml麦康凯液体培养基中,42~44℃培养24~48 h。取麦康凯液体培养物划线接种于麦康凯琼脂培养基平板上,30~35℃培养18~72 h。
2.4.1.6 试验结果 试验组未检出大肠埃希菌,表明上述方法不适用于大肠埃希菌检查。见表7-8。
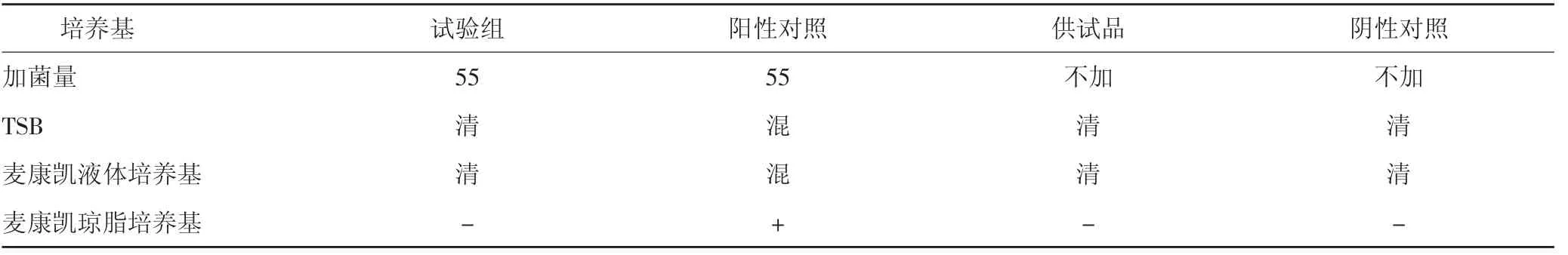
表7 大肠埃希菌方法适用性试验结果(常规法)
2.4.2 薄膜过滤法
2.4.2.1 试验组 取“2.2”项下的1∶10供试液,静置10 min后,取上清液10 ml,用240 ml无菌氯化钠注射液稀释,混匀。经滤器过滤后,用无菌氯化钠注射液冲洗滤膜,共冲洗750 ml,在最后一次冲洗时加入试验菌(小于100 cfu)抽干后,取出滤膜,至100 ml胰酪大豆胨液体培养基中,按规定培养。
2.4.2.2 阳性对照组 用无菌氯化钠注射液代替供试液,其余同试验组操作。
2.4.2.3 阴性对照组 用无菌氯化钠注射液代替供试液,不加菌液,其余同试验组操作。
2.4.2.4 供试品组 不加菌液,其余同试验组操作。
2.4.2.5 选择和分离培养 按《中国药典》2020年版规定,取上述培养物1 ml分别接种至100 ml麦康凯液体培养基中,42~44℃培养24~48 h。取麦康凯液体培养物划线接种于麦康凯琼脂培养基平板上,30~35℃培养18~72 h。
2.4.2.6 结果 试验组检出大肠埃希菌,表明上述方法可用于大肠埃希菌检查。结果见表9。

表8 大肠埃希菌方法适用性试验结果(稀释法)
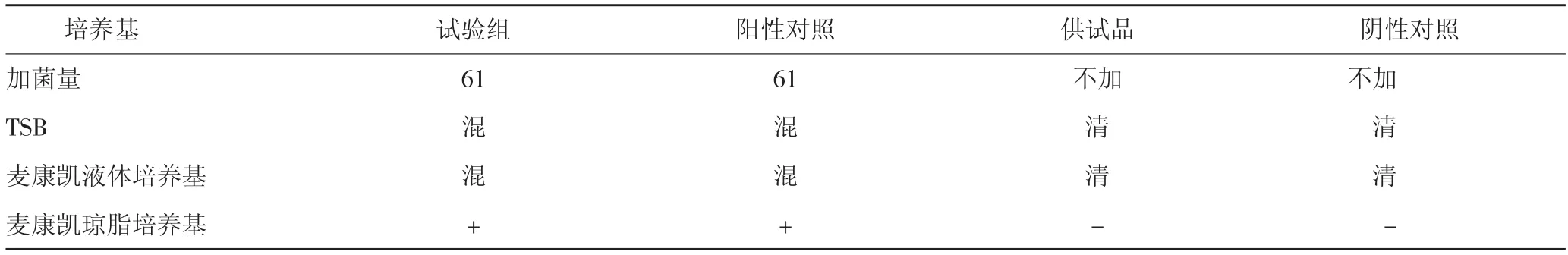
表9 大肠埃希菌方法适用性试验结果(薄膜过滤法)
2.5 结果 经验证,取1∶500供试液10 ml经静置10 min后,取上清液1 ml至250 ml无菌氯化钠注射液(冲洗液)中,经薄膜过滤法(两膜滤器,每膜每次冲洗约80 ml,总冲洗量1 750 ml)处理,用于需氧菌总数计数;取1∶10供试液1 ml至250 ml冲洗液中,经薄膜过滤法(每次冲洗约75 ml,总冲洗量750 ml)处理,用于霉菌和酵母菌总数计数;取1∶10供试液经静置10 min后,取上清液10 ml至240 ml冲洗液中,经薄膜过滤法(每次冲洗约75 ml,总冲洗量750 ml)处理,用于大肠埃希菌检查,依法检查(《中国药典》2020年版四部通则1105、1106、1107)。
3 讨论
2005 年版《中国药典》首次规定,在建立药品的微生物限度检查法或无菌检查法时,应先进行检查方法的验证,以确认所采用的方法适合于该药品的检查。验证的意义在于保证检验结果准确、可靠及检验方法的完整性。其在保证检验方法的科学性和检验结果的准确性方面大大缩短了《中国药典》与国外药典的差距,是促使我国药品此类检查方法更加合理、科学和严谨的重要途径[2]。《中国药典》2015年版微生物限度检查微生物计数法(通则1105)方法适用性试验中规定,应首先在供试液环节加入验证菌株进行回收率测定[3]。由需氧菌总数、霉菌及酵母菌计数适用性试验结果可知盐酸美他环素片对铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌、白色念珠菌、黑曲霉很强的抑制作用,故本试验在平皿法、稀释法、中和剂法之后,回收比值仍小于0.5。
按照2020年版《中国药典》,如果供试品对微生物生长的抑制作用无法以其他方法消除,供试液可经过中和、稀释 或薄膜过滤处理后再加入试验菌悬液进行方法适用性试验。本试验中在选择适用性方法时从平皿法到稀释法逐步试验,测定需氧菌总数时采用1∶10供试品平皿法,增加稀释液体积,加中和剂以及前加菌薄膜过滤法均无法消除供试品的抑菌性。最后通过后加菌薄膜过滤法直接彻底消除抑菌作用,回收比值在0.5~2。因此药品微生物试验应综合考虑试验方法以及加菌方式对试验结果的影响,通过方法学适用性试验,严格按照实验操作规程进行试验。
