高脂饮食诱导的肥胖相关子宫内膜病变小鼠模型中circRNA表达谱分析及相关ceRNA构建*
2022-01-27李艳辉肖诚瑀汪宏波
李艳辉,肖诚瑀,赵 蓉,汪宏波
(华中科技大学同济医学院附属协和医院妇产科,武汉 430022)
子宫内膜癌(endometrial cancer,EC)是全球女性中最常见的恶性生殖系统肿瘤之一,2020年最新的流行病数据显示全球EC发病人数超过41万[1]。EC有两种发病类型:I型雌激素依赖型及II型非雌激素依赖型。肥胖与I型EC高度相关[2]。近几十年来,随着人类饮食结构和生活习惯的改变,全球范围内肥胖发病率显著上升,尤其是在年轻女性中。近期研究显示,1988年至2016年间,45岁以下女性肥胖率增加了16%以上,而同期该年龄段的女性EC发病率增加了14倍[3]。肥胖也是子宫内膜不典型增生或癌变的最强的独立危险因素[4]。多种机制,包括肥胖导致的女性内分泌和代谢紊乱、胰岛素抵抗及慢性炎症反应等,均被认为与肥胖相关的I型EC发病相关[5]。但肥胖致肿瘤的发病机制可能是多方面的,且目前远未完全阐明。为了更好地阐明其中的分子机制和作用途径,并对这些关系做出更有力的结论,需进一步研究饮食摄入和饮食模式在子宫内膜病变中的具体分子机制[6]。
竞争性内源RNA(competitive endogenous RNA,ceRNA)即长链非编码RNA(longnoncoding RNA,lncRNA)及环状RNA(circRNA),与mRNA可通过竞争相同的microRNA反应元件(MicroRNA reaction elements,MREs),从而调控相应靶基因的表达[7]。研究发现,circRNA的异常表达及其参与ceRNA网络在多种人体疾病,包括肿瘤、神经系统疾病和自身免疫性疾病等的发生发展中扮演关键性调控作用[7]。但在子宫内膜不典型增生或癌变中,circRNA的作用目前仍知之甚少,特别是circRNA参与的ceRNA网络是否在肥胖/代谢综合征诱发的子宫内膜病变中发挥作用,目前尚不完全清楚。
本实验通过高脂饮食和(或)17β-雌二醇喂养CD-1(ICR)小鼠构建子宫病变模型,采用高通量RNA-seq检测lncRNA、circRNA、mRNA转录组谱改变,并利用生物信息学方法分析预测与子宫内膜病变过程可能相关的ceRNA网络,为阐明子宫内膜不典型增生或癌变的发生机制及潜在的治疗靶点提供新思路。
1 材料与方法
1.1 材料来源
1.1.1 实验动物 72只清洁级6周龄CD-1(ICR)雌鼠(北京维通利华公司),18~25g,饲养于华中科技大学动物实验中心无病原体(SPF)动物房,每5只一笼,饲养温度(25±2)℃,湿度(55±5)%,维持12h的光/暗循环。本动物实验经华中科技大学动物保护与利用委员会批准许可。
1.1.2 标本采集 收集2016年1月至2017年6月在华中科技大学同济医学院附属协和医院手术的子宫内膜癌患者的癌组织标本10例(年龄范围42~65岁)。纳入标准:经手术病理分期证实为I~III期的子宫内膜样腺癌;术前未接受放化疗,未服用激素类药物;临床病例资料完备。收集同期因子宫肌瘤、卵巢良性囊肿行手术治疗的患者的子宫内膜标本10例(年龄范围38~53岁)作为对照。对照患者纳入标准:月经均规律,术前6个月内未服用激素治疗,且均处于子宫内膜增殖期。本研究经本院伦理委员会审批同意【批准号:IORG0003571】,患者术前均签署知情同意书。两组患者的基本临床资料对比见表1。
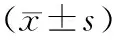
表1 两组患者的基础临床资料对比
1.1.3 主要试剂 生化级17β-雌二醇购自美国Sigma-Aldrich公司;小鼠喂养用高脂饲料(D19452,脂肪、糖水化合物及蛋白供能占比分别为60%、20%、20%)购自北京华阜康有限公司;小鼠血清甘油三酯(TG)试剂盒购自南京建成生物工程研究所;Trizol购自美国Invitrogen公司;cDNA合成试剂盒及Universal SYBR qPCR Master Mix试剂盒购自德国Qiagen公司。
1.2 方法
1.2.1 人体组织标本的采集 人子宫内膜癌组织采集于腹腔镜手术切除标本,而正常人子宫内膜经诊断性刮宫获取。采集的标本经PBS溶液冲洗去除血液,2h内转入液氮罐内保存,备后续试验使用。
1.2.2 实验动物分组及干预 小鼠购入后经正常饮食喂养1周,随机分为正常热量饮食组(对照组,C组)、17β-雌二醇喂养组[E2组,每只小鼠经口给予500μg/(kg·d)的17β-雌二醇。E2用量参照先前的实验研究[8-9]]、高脂饲料喂养组(HFD组)及高脂饲料+雌激素喂养组(HFD+E2组,17β-雌二醇经口给药量同E2组),每组各18只。各小鼠干预后每周称重记录体重变化。
1.2.3 标本收集 于分组干预后的第13周各组取6只,及干预后第26周各组取12只,在小鼠子宫内膜增殖期(通过阴道涂片观察)将小鼠麻醉后取其眼静脉血2mL。小鼠断颈处死后,取下腹纵切口于子宫颈与子宫体交界部切下子宫,立即称重。称重后在体视显微镜下纵向剖开子宫。于冰上切取部分小鼠子宫标本用于组织学检查,其余子宫标本采用手术刀背刮下子宫内膜组织,进行RNA抽提。后续RNA实验分析的均是单只小鼠子宫内膜组织。
1.2.4 子宫内膜组织学检查 子宫石蜡包埋,切片,苏木精-伊红(HE)染色。由两名病理医师各自独立阅片,并根据2014年修订的WHO子宫内膜病变分类,将子宫内膜病变分为两类:子宫内膜增生不伴不典型增生(EH)和子宫内膜不典型增生(AH)[10]。
1.2.5 总RNA提取 Trizol法从各组大鼠子宫内膜组织、人子宫内膜癌组织及人正常对照子宫内膜组织中提取总RNA,实验均在冰上及无RNA酶条件下进行。Nanodrop 2000分光光度计测定总RNA浓度和纯度。
1.2.6 高通量RNA测序 小RNA文库构建及测序由上海欧易生物科技有限公司进行。实验步骤严格按操作指南进行,依次进行核糖体核糖核酸(rRNA)的去除、RNase R消化、片段化、第一链cDNA合成、第二链cDNA合成、末端修复、3'末端加A、连接接头、富集步骤,完成测序样本文库构建。采用Illumina测序仪进行双端测序。测序过程在Illumina提供的数据收集软件控制,并进行实时数据分析。
1.2.7 生物信息学分析 应用R语言平台edgeR程序包分析样本间的差异表达基因,得到P-value后运行多重假设检验校正,通过控制错误发现率(FDR)来确定P-value的阈值,校正后的P-value即Q-value;并计算样本间差异表达mRNA、circRNA的差异表达倍数(Fold-change)。差异表达mRNA、circRNA的筛选标准均为干预组(HFD+E2、HFD及E2组)与对照组表达差异倍数≥2且q-value<0.05。应用分层聚类以显示mRNA、circRNA表达模式的总体差异。对生物过程(biological process),细胞成分(cellular component),分子功能(molecular function)三个层次上以及各个pathway上对应的差异基因数目进行统计,P<0.05,FDR<0.05认为有统计学意义。对于circRNA则对其亲本基因进行GO分析和KEGG分析。使用miRanda工具预测microRNA与差异circRNA的靶向关系,应用TargetScan、RegRNA和miRTarBase等数据库,酌情计算miRNA与circRNA或mRNA之间的结合关系。TargetScan提供的上下文+得分用于miRNA的排名和交互对的映射。并使用Cytoscape绘制circRNA与miRNA的互作网络图。
1.2.8 实时荧光定量PCR检测 确定高通量测序筛选出的差异表达mRNA、circRNA在人子宫内膜癌组织及正常子宫内膜组织中的表达水平。采用Trizol法从组织中提取总RNA,并逆转录成cDNA。以cDNA模板按实时荧光定量PCR技术检测试剂盒说明书进行PCR扩增。反应条件:95℃ 10min,1个循环;94℃ 30s,55℃ 60s,72℃ 30s,共35个循环。每个样本3个复孔。以磷酸甘油脱氢酶(GAPDH)基因作为内参照,采用2-ΔΔCt的方法对目标mRNA、circRNA的表达水平进行相对定量。各目的基因及内参基因的引物序列见表2。

表2 实时荧光定量PCR技术检测的相关基因的引物序列

2 结 果
2.1 不同饮食干预过程中各组小鼠中体重、血清甘油三酯及子宫大小变化趋势 饮食干预后,相较对照组和17β-雌二醇组(E2组),HFD组和HFD+E2组小鼠的平均体重显著增加(P<0.05),但HFD与HFD+E2组小鼠无显著差异(图1A)。饮食干预后第13、26周,HFD组及HFD+E2组小鼠的血清TG水平均显著高于对照组及E2组(P<0.05),但HFD组与HFD+E2组无显著差异(图1B)。
饮食干预后第13、26周,相较对照组,HFD+E2组和E2组子宫体重显著增大[(9.48±0.41)g,(8.81±0.60)g vs (7.06±0.31)g,P<0.01];但HFD组小鼠子宫重量与对照组相比并无显著差异[(7.46±0.33)g vs (7.06±0.31)g,P>0.05]。见图1C。
2.2 高脂饮食和(或)雌激素暴露诱导小鼠子宫内膜病变 饮食干预后第13周,100%(6/6)的HFD+E2组和66.7%(4/6)E2组小鼠子宫内膜呈现不伴有不典型的子宫内膜增生状态,且子宫内膜腺体/间质比例明显增加;但在HFD组和对照组小鼠子宫内膜组织学检查均为正常。饮食干预后第26周,100%(12/12)HFD+E2组、83.3%(10/12)的HFD组及91.7%(11/12)的E2组小鼠子宫内膜均呈现增生状态;并且25%(3/12)的HFD+E2组、25%(4/12)的HFD组及16.7%(2/12)的E2组小鼠的子宫内膜出现腺体形状不规则、结构复杂,腺上皮呈真复层结构并向腺腔内凸起、搭桥,且具有核异型性,提示出现子宫内膜增生伴不典型。对照组小鼠子宫内膜结构仍均正常。但持续26周的高脂饮食和(或)E2干预均未能诱导出子宫内膜癌变。见图2。

图2 分组饮食干预26后各组小鼠子宫内膜代表性组织学表现
2.3 高脂饮食和(或)雌激素诱导小鼠子宫内膜组织差异表达的mRNA和circRNA的筛选 高通量RNA-seq结果显示:上千个mRNA,LncRNA及circRNA在小鼠子宫内膜组织内表达。见图3。干预第26周时HFD+E2、HFD、E2三组中相对于对照组的共同差异表达基因中差异倍数前十的基因见表3。其中5个基因(Cyp2f2、Hp、Angptl7、Ctla2a、Gpx3)在3组中均显示下调,4个基因(Plat、Acta2、Tnc、Gstm7)在HFD+E2、HFD组中显著上调,而Serpinb11基因在HFD、E2组中均上调。
高通量RNAseq结果还显示:高脂饮食±E2干预后的第13周、第26周,HFD+E2组、HFD组及E2组小鼠子宫内膜与对照组比较,存在大量差异表达的circRNA。表4列出的是干预第26周,HFD组相较对照组差异倍数排名前十且是已知的circRNA,并利用miRanda预测各circRNA的microRNA反应元件(MREs),并列出得分最高的四个MREs(表4)。

图3 高通量RNAseq结果

表3 HFD+E2组、HFD组及E2组与对照组相比排名前十的共同差异表达mRNAs
2.4 高脂饮食和(或)雌二醇干预后小鼠子宫内膜差异表达mRNA功能分析 GO富集提示,差异表达的mRNAs对脂代谢和(或)外源雌激素对免疫应答、DNA复制调控及代谢途径的影响较大。KEGG通路富集分析提示,高脂饮食和(或)E2干预后子宫内膜组织mRNA转录谱在Wnt信号通路、p53信号通路、细胞周期及系统性红斑狼疮等信号通路中显著富集。结合GO和KEGG分析的结果,雌激素和高脂饮食可能通过调节免疫反应、细胞增殖及代谢过程诱发子宫内膜病变。见图4。

图4 高脂饮食和(或)雌二醇干预后小鼠子宫内膜差异表达mRNA的GO富集分析(A)和KEGG通路分析(B)
2.5 qRT-PCR验证差异表达mRNA及circRNA以人正常子宫内膜组织作为对照,qRT-PCR验证测序筛选出的3个差异表达mRNA及3个差异表达circRNA(PLAT、Tnc、Slc16a14;mm9_circ_011137、mm9_circ_012214、mm9_circ_017142)在人EC组织内的表达变化。结果显示:上述6个RNAs均在人EC和子宫内膜组织内表达;除mm9_circ_012214外,其余2个circRNA及3个mRNA在人EC中的表达增降趋势与测序结果一致。见图5。

图5 人EC样品中的RNA-seq验证

表4 HFD组与对照组比较已知的排名前十差异表达circRNA及其预测的microRNA反应元件(MREs)
2.6 ceRNA网络预测 使用miRanda等工具预测microRNA与差异circRNA的靶向关系,结合差异表达的mRNA结果进一步对可能存在的circRNA-miRNA-mRNA网络进行预测(图6),RNA-seq显示HFD+E2组和HFD组中差异表达的Ntrk3、Ltbp1、SLC16A14、Lgr6在子宫内膜病变中可能通过ceRNA机制受到调控。ceRNA子网络中mRNA和circRNA的RNA-seq差异表达情况,见表5。

图6 circRNA-miRNA-mRNA网络差异表达的circRNA(蓝色图标)与差异表达的靶向mRNA(绿色图标)Ntrk3、Ltbp1、SLC16A14、Lgr6之间可能存在的miRNA(红色图标),提示了子宫内膜病变中ceRNA网络的存在可能性

表5 ceRNA子网络中mRNAs和circRNAs的RNA-seq差异表达
3 讨 论
肥胖相关的致癌机制多年来一直是临床、基础研究中的热点。阐明肥胖相关肿瘤的分子机制,被认为是任何以减重作为预防或治疗干预的公共卫生措施得以实施的基础。本研究中,通过长达26周的高脂饮食干预ICR小鼠,构建了肥胖及高脂血症小鼠模型,组织学研究证实高脂饮食(肥胖)促进小鼠子宫内膜腺体增生;值得关注的是26周的高脂饮食干预下小鼠子宫内膜出现了不典型增生,其发生率与持续的17β-雌二醇干预组相当(25% vs 16.7%)。这一研究结果从动物模型上揭示了高脂饮食摄入、肥胖与子宫内膜病变的高度相关性。Cheng等[8]采用高脂饮食和(或)E2喂养C57BL/6小鼠12周后,发现高脂饮食促进了小鼠子宫内膜腺体的增殖;与本研究中第13周收集的小鼠子宫内膜标本组织学观测结果一致,Cheng等[6]研究中各小鼠也未出现子宫内膜不典型增生或癌变。Wilkinson等在BDII/Han大鼠(一种遗传性易患子宫内膜癌的大鼠)中分别给予高脂饮食与正常对照饮食喂养15个月后,9只正常饮食组大鼠及12只高脂饮食组大鼠内均有4只大鼠出现子宫内膜癌变;虽然高脂饮食干预下的BDII/Han大鼠EC发病率并无显著增加,但推测其原因可能主要与研究样本量过少相关。目前的研究结果均认为,高脂饮食(肥胖)与持续的雌激素刺激相似,可促进子宫肥大,子宫内膜腺体增生、不典型增生甚至癌变。
为进一步探明高脂饮食下导致的肥胖与子宫内膜病变的内在分子机制,本研究对不同饮食干预下的小鼠子宫内膜分别进行高通量RNA-seq。结果证实,高脂饮食干预13周(此时小鼠子宫内膜尚未出现增生改变),就可诱导小鼠子宫内膜RNA转录谱出现显著改变。为探究差异表达mRNAs的潜在功能,本研究中进一步采用生物信息学方法,GO富集分析显示高脂饮食和(或)外源雌激素对免疫应答、DNA复制调控及细胞能量代谢途径等术语富集。KEGG通路分析表明,高脂饮食和(或)E2干预后子宫内膜组织mRNA转录谱在Wnt信号通路、p53信号通路、细胞周期及系统性红斑狼疮等信号通路中显著富集。这一研究结果与Cheng等[8]采用高脂饮食喂养C57BL/6小鼠后子宫内膜差异转录本功能分析一致,在其研究中GO和KEGG分析显示E2和(或)HFD调控的基因主要负责免疫应答、炎症应答和代谢途径。由于免疫反应、代谢途径、Wnt信号通路[11]、P53信号通路[12]等在子宫内膜癌发生发展中的作用已被众多研究证实。因此本研究中小鼠子宫内膜转录谱测序结果也提示:高脂饮食(肥胖)可能通过改变小鼠子宫内膜转录谱,进而促进子宫内膜病变。
本研究中通过进一步延长干预时间及深度测序分析circRNA、LncRNA表达谱的改变,探讨了高脂饮食对小鼠子宫内膜cicrRNA、LncRNA、miRNA的影响,及通过构建了ceRNA作用网络探讨了RNA转录后调控机制。circRNA参与下的ceRNA网络是RNA间相互作用新机制[7],但在子宫内膜癌中circRNA参与的ceRNA网络分析目前尚少。本研究对差异表达的circRNA可能参与的ceRNA网络进行了生物信息学预测,通过限制circRNA与mRNA差异表达的一致性确定了4个潜在的ceRNA子网络:Ntrk3、Ltbp1、SLC16A14、Lgr6。神经营养蛋白酪氨酸激酶受体3(Ntrk3)是一种神经营养因子受体基因,已经在肺癌、乳腺癌和肝细胞癌中证明是潜在的致癌基因[13],并在结直肠癌中高甲基化[14]。其3'UTR区域已被证明可与miR-509、miR-128[15]和miR-497直接结合[16],并与LINC00978在胃癌中形成ceRNA网络,调控肿瘤细胞增殖[16]。Ltbp1编码潜在TGF-β结合蛋白(latent TGFβ binding protein),通过与TGF-β的共价连接使其处于潜伏期,对TGF-β折叠、分泌、基质定位和活化至关重要[17]。Ltbp1在食管癌中可通过上皮-间质转换和肿瘤相关成纤维细胞转换,促进肿瘤的进展[18];SLC16A14又名MCT14,是细胞膜上单羧酸转运蛋白(monocarboxylate transporter,MCT)家族的孤儿成员,MCT蛋白介导单羧酸盐如乳酸的转运,在肿瘤细胞有氧糖酵解过程中避免了细胞内乳酸水平过高、细胞酸化引起的反馈抑制[19],SLC16A14在上皮性卵巢癌中证实可作为肿瘤进展的标志物[20]。Lgr6是富含亮氨酸的G蛋白偶联受体,在人体组织中广泛分布,作为糖蛋白激素受体家族的新成员,目前尚未发现其生理性配体,故又称Lgr6为孤儿受体[21]。Lgr6(G蛋白偶联受体)表达阳性的乳腺癌细胞[22]和肺癌细胞显示出自我更新和分化特性以及更高的致癌潜力,被认为是具有恶性潜能的干细胞样细胞群[23]。
本研究也有一些不足的地方:首先,研究终点设定在饮食干预后的第26周,进一步延长高脂饮食干预时间是否将诱导ICR小鼠子宫内膜不典型增生率的升高,甚至癌变的发生尚不清楚。此外,主要关注了HFD±E2干预下各组小鼠子宫内膜RNA表达谱的变化,并未对比各干预组内有不典型增生和无不典型增生的小鼠子宫内膜RNA表达谱的差异。而这种差异可能对了解子宫内膜病变过程中RNA时空表达变化具有重要意义,因此值得在接下来的研究中进一步探讨。
综上所述,本研究通过长达26周的高脂饮食建立肥胖相关小鼠子宫内膜病变模型,证实了高脂饮食导致的肥胖、高甘油三酯血症与小鼠子宫内膜病变高度相关。并通过对不同饮食干预组小鼠子宫内膜的高通量RNA-seq发现高脂饮食、肥胖可诱导小鼠子宫内膜组织mRNA、LncRNA、cicrRNA转录谱出现显著改变,这些改变有可能改变了子宫内膜的稳态,而导致小鼠子宫内膜病变。而差异表达cicrRNA的ceRNA作用机制与子宫内膜病变或癌变的相关作用值得进一步研究探讨。本研究拓宽了我们对非编码RNA参与高脂饮食、肥胖在子宫内膜癌发生、发展和预后的理解,也为进一步研究肥胖相关子宫内膜病变的分子途径提供了新思路。
