核桃叶浸提液对4种作物种子萌发及幼苗生长的化感效应
2022-01-22王一峰陈耀年赵淑玲王明霞胡文斌
王一峰,陈耀年,赵淑玲,王明霞,胡文斌
(1.陇南师范高等专科学校 a.农林技术学院;b.陇南特色农业生物资源研发中心,甘肃 成县 742500; 2.成县核桃科技服务中心,甘肃 成县 742500)
植物在生长过程中,会向周边环境分泌次生代谢物质,促进或抑制其他植物的生长,这种促进或抑制作用称为化感作用[1],具有化感作用的植物称为化感植物,化感植物通过茎叶的挥发、淋溶、根系分泌,或在植物残体腐解时将化感物质分泌到环境中,对受体植物产生化感效应[2]。作为植物间相互作用方式,化感效应广泛存在并影响着农林业生产,合理利用化感作用,可以有效指导生产实践[3]。
核桃(Juglans regiaL.)是优良的油料树种,也是干果、材用和绿化树种,是世界四大干果之一[4-5]。作为适应性最强,分布最广的核桃属经济林树种,核桃在我国广泛分布,种植面积巨大,核桃产业已成为我国重点发展的产业之一[6]。然而核桃从幼树到盛果期所经历的时间较长,造林初期植株间空间较大,容易导致杂草丛生,增加生产成本,也容易造成水土流失,不利于环境保护。农林复合种植模式作为新型生产方式,能充分利用土地,保护土壤免受侵蚀、保护环境,增加经济效益,已成为当前保持水土、恢复生态和提高土地利用率的一项重要途径[7-8]。林下间作其他作物是当前农林复合生态系统的重要形式,因其具有高产、稳产、高效的经济和生态效益被广泛应用于生产实践[9-10]。然而,由于大多数植物存在化感效应,物种间关系不协调,容易造成林下间作作物生长不良的现象,导致总体效益下降[11]。
核桃是最早发现的化感植物之一,早在2000年前就被发现[12]。有研究表明,核桃会通过叶片、果皮及根系分泌胡桃醌、酚类、黄酮类、亚油酸、棕榈酸等化合物来抑制其他作物种子萌发及生 长[13]。已有研究证明核桃叶片浸提液对其他作物种子萌发及幼苗生长具有抑制作用[14-15]。廖梦雨等[16]研究发现,核桃叶浸提液对三叶鬼针草种子萌发存在低促高抑的双重效应。张琴等[17]研究表明,不同浓度的核桃叶水浸提液对棉花种子萌发、幼苗生长及棉花枯萎病菌菌丝生长均表现出抑制效应,且抑制作用随浸提液浓度的增高而逐渐增强。然而,我国核桃化感作用研究起步较晚,且因目前核桃林下间作主要以林草间作模式为主,关于核桃化感作用的研究受体多以草种为主,以粮食作物、油料作物及中草药为受体的研究较少。因此,研究核桃对粮食作物、油料作物及中草药的化感作用,筛选适合核桃林下间作的作物种类,采用核桃农林复合的生产模式,可以有效防治核桃林地杂草,改善土壤养分状况,节约投资,提高经济收入,实现核桃产业的可持续发展。陇南地处甘肃南部,核桃产业作为陇南的主要产业,是当地农民创收的主要经济来源。但由于当地气候湿润,核桃林下大量滋生杂草,使得核桃生长受到抑制,增加了管理成本,且因核桃造林初期空间较大,土地利用率低下。基于此,本研究以核桃叶片作为供体植物,以当地主要种植的小麦、油菜、桔梗、苦参等作物种子作为受体植物,研究核桃叶水浸提液对4 种作物种子萌发及幼苗生长的化感效应,以期为当地核桃林下间作物种的选择提供理论依据。
1 材料与方法
1.1 试验材料
核桃叶片采自甘肃省成县大路沟国家核桃良种基地2年生嫁接核桃苗,品种为‘香玲’;小麦为‘潘林麦’,油菜为甘蓝型油菜‘陕油15’,均为成县农户惠赠;桔梗和苦参种子购自成县药材市场。
1.2 核桃叶浸提液的制备
采集核桃树当年生枝条上的鲜叶,用蒸馏水冲洗干净,置试验台自然晾干后剪成1 cm 左右的小片,称取250 g 碎叶,充分研磨后,加入500 ml 蒸馏水置振荡器震荡24 h,1 000 r/min 离心2 min, 弃沉淀,重复3 次,将上清液定容至500 ml,得到 0.5 g/ml 的核桃叶片水浸提液母液,置4 ℃冰箱中备用。试验时将母液分别稀释成0.02、0.04、0.06、0.08、0.10 mg/ml 的5 个浓度梯度,以蒸馏水 为CK。
1.3 试验设计
试验采用随机区组设计,分小麦、油菜、桔梗、苦参4 组,每组各6 个处理(浓度),每处理重复3 次,共72 个处理。从4 种供试作物中,挑选籽粒饱满、大小一致的种子,经5%的次氯酸钠消毒3 min 并用蒸馏水冲洗3 次后均匀播种在培养皿(直径为9 cm)中的滤纸上,其中,小麦、油菜和桔梗每皿播50 粒,苦参每皿播20 粒,播种后按试验设计加入适量不同浓度的核桃叶片水浸提液,以水浸液不淹过种子为准。播种后于室温、自然光下进行发芽试验,并根据培养皿中液体情况每天补充适量的浸提液,以保证种子萌发及正常生长需要。
1.4 指标测定
参照王一峰等[18]的方法,于播种当天开始,以后每天观察种子萌发情况,以胚根长度≥1 mm为萌发标准(记为发芽第1 天),分别于发芽第3天和第7 天统计发芽势和发芽率。在发芽的第15天从每个培养皿中拔出10 株相应植物幼苗,分别测定其主根长、苗高及整个培养皿中的幼苗鲜质量。用化感指数(RI)表示化感作用强弱。发芽势、发芽率及RI的计算公式如下:

式(3)中,T为处理值,CK为对照值。RI绝对值的大小代表化感作用强度。当RI>0时,表示存在促进效应;当RI<0时,表示存在抑制效应。
1.5 数据处理
利用SPSS 23.0 软件对不同处理下各种作物萌发及幼苗生长指标进行单因素方差分析,不同处理间用S-N-K 法进行多重比较。同时采用双因素方差分析评价不同作物种类与核桃叶片水浸液浓度的主效应;用Origin 2018 软件制作图表。
2 结果与分析
2.1 不同浓度的核桃叶浸提液对4 种作物种子萌发的影响
2.1.1 不同浓度的核桃叶浸提液对4 种作物种子发芽势的影响
由图1 可知,不同浓度核桃叶浸提液对4 种作物种子发芽势的影响总体表现为在低浓度下具有促进作用,高浓度下具有抑制作用,但化感作用的强弱因受体植物种类不同而存在差异。核桃叶浸提液对小麦种子发芽势的影响在不同浓度间差异不显著(P>0.05),在0.04 g/ml 之前表现为促进作用,在大于0.06 g/ml 时则表现为抑制作用,且抑制作用大于促进作用,在浓度为0.04 g/ml 时,发芽势为92.00%,较对照(91.33%)提高了0.7%;在浓度为0.10 g/ml 时,发芽势为88.00%,较对照(91.33%)下降了3.33%。核桃叶浸提液对油菜种子发芽势的影响在不同浓度间差异显著 (P<0.05),在浓度为0.02 g/ml 时表现为促进作 用,发芽势为87.33%,较对照(84.67%)提高了 2.66%;随着浸提液浓度的升高,表现为抑制作用,且浓度越高抑制作用越强,浓度为0.10 g/ml 时抑制作用最强,发芽势为69.33%,较对照(84.67%)下降了15.34%。核桃叶浸提液对桔梗种子发芽势的影响在不同浓度间差异显著(P<0.05),在浓度为0.02 g/ml 时,发芽势有所降低,但与对照差异不显著(P<0.05),浓度在0.04 ~0.08 g/ml之间时均表现为促进作用,在0.04 g/ml 时促进作用最强,发芽势为94.00%,较对照(87.33%)提高了6.67%;当浓度升高到0.10 g/ml 时,表现为抑制作用,发芽势为82.00%,较对照(87.33%)降低了5.33%。核桃叶浸提液对苦参种子发芽势的影响在不同浓度间差异显著(P<0.05),浓度在0.02 ~0.06 g/ml 时表现为促进作用,浓度为 0.06 g/ml 时促进作用最强,发芽势为63.33%,较对照(45.00%)提高了18.33%,且与对照差异显著(P<0.05),当浓度大于0.06 g/ml 时表现为抑制作用,浓度为0.10 g/ml 时抑制作用最强,发芽势为41.67%,较对照(45.00%)降低了3.33%。方差分析结果表明(表1),核桃叶浸提液对4 种作物种子发芽势的影响在不同作物种类间和不同浓度间的差异均达到极显著水平(P<0.01)。

表1 不同浓度核桃叶浸提液处理下4 种作物发芽势的方差分析Table 1 Variance analysis of germination potential of four crops treated with walnut leaf extracts of different concentrations
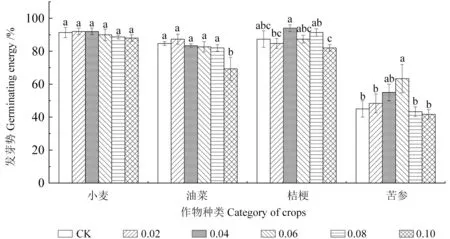
图1 不同浓度核桃叶浸提液对4 种作物种子发芽势的影响Fig.1 Effects of different concentrations of walnut leaf extracts on seed germination potential of four crops
2.1.2 不同浓度的核桃叶浸提液对4 种作物种子发芽率的影响
由图2 可知,不同浓度核桃叶浸提液对4 种作物种子发芽率的影响表现为促进和抑制作用,且在不同作物种类间存在差异。不同浓度的浸提液对小麦种子发芽率的影响表现为低浓度下的促进作用和高浓度下的抑制作用,但不同浓度间的化感作用差异不显著(P>0.05),当浓度为0.02 和0.04 g/ml 时对小麦种子发芽率具有一定的促进作用,当浓度为0.04 g/ml 时小麦种子发芽率为99.33%,比对照(95.33%)提高了4.00%;当浸提液浓度高于0.06 g/ml 时,对小麦种子发芽率具有抑制作用。不同浓度的浸提液对油菜种子的发芽率表现为抑制作用,且随着浓度的升高,抑制作用增强,当浓度为0.08 和0.10 g/ml 时,油菜种子的发芽率分别为85.33%和84.67%,比对照(92.00%)分别下降了6.67%和7.33%,且与对照差异显著(P<0.05)。不同浓度的浸提液对桔梗种子发芽率的影响表现为低浓度下的促进作用和高浓度下的抑制作用,且抑制作用强于促进作用,当浓度低于0.04 g/ml 时表现为促进作用,但促进作用与对照相比差异不显著(P>0.05),当浓度高于0.06 g/ml 时表现为抑制作用,浓度为 0.10 g/ml 时抑制作用最强,发芽率为86.00%,比对照(92.67%)下降了6.67%,且与对照差异显著 (P<0.05)。不同浓度的浸提液对苦参种子发芽率的影响表现为低浓度下具有促进作用,且在一定范围类随着浓度的升高,促进作用增强,当浓度为0.06 g/ml 时,发芽率最高,为76.67%,比对照(53.33%)提高了23.34%,且与对照差异显著 (P<0.05),当浓度为0.08 和0.10 g/ml 时表现为抑制作用,发芽率分别为46.67%和45.00%,分别比对照(53.33%)降低了6.66%和8.33%。方差分析结果表明(表2),核桃叶浸提液对4 种作物种子发芽率的影响在不同作物种类间和不同浓度间的差异均达到极显著水平(P<0.01)。

表2 不同浓度核桃叶浸提液处理下4 种作物发芽率的方差分析Table 2 Variance analysis of germination percentage of four crops treated with walnut leaf extracts of different concentrations
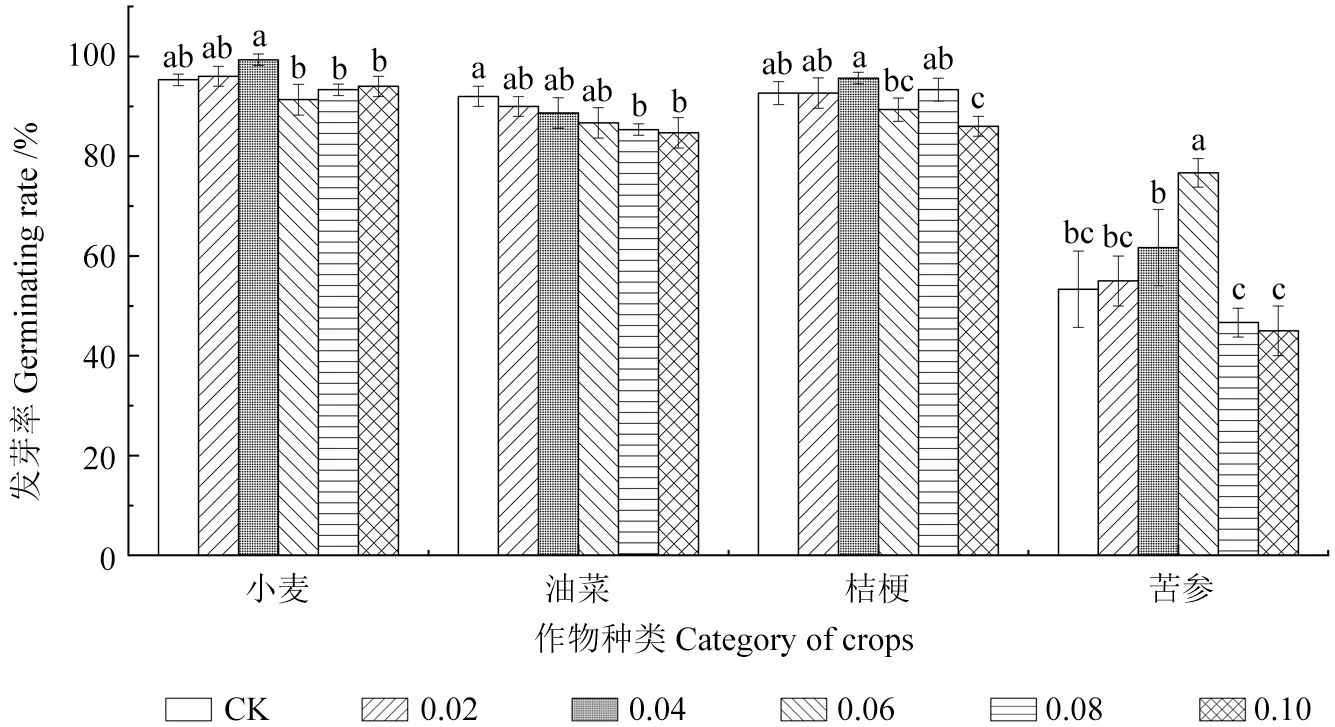
图2 不同浓度核桃叶浸提液对4 种作物种子发芽率的影响Fig.2 Effects of different concentrations of walnut leaf extract on seed germination rate of four crops
2.1.3 不同浓度的核桃叶浸提液对4 种作物种子发芽的化感指数的影响
化感作用的强弱常用化感指数作为衡量指标,本试验中化感指数是由发芽率计算所得(图3)。由图3 可知,不同浓度的浸提液对不同作物种子发芽的化感作用强弱不同,其中,对苦参种子发芽的化感作用最强,其次是油菜种子和桔梗种子,对小麦种子发芽的化感作用最弱。
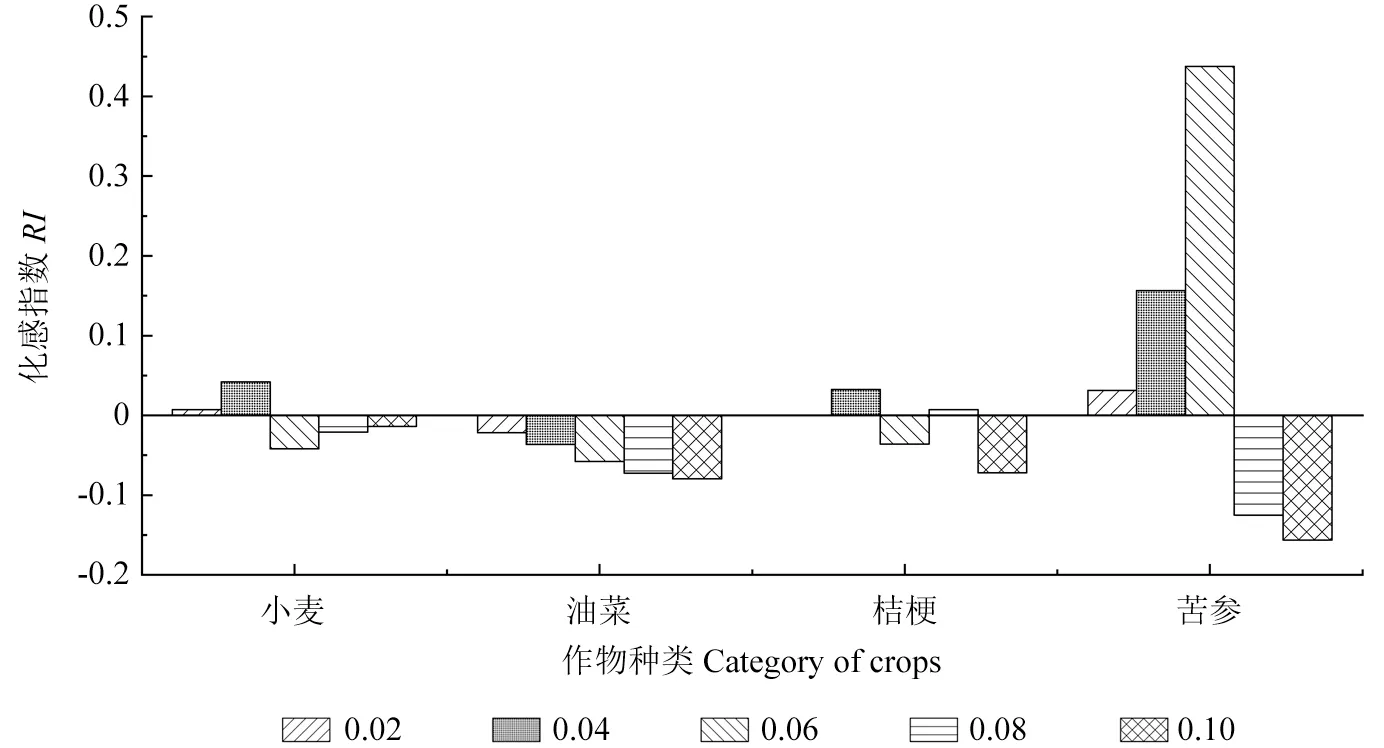
图3 不同浓度的核桃叶浸提液对4 种作物种子发芽率的化感指数Fig.3 Allelopathy index of walnut leaf extracts of different concentrations on seed germination rate of four crops
2.2 不同浓度的核桃叶浸液对4 种作物幼苗生长的影响
由表3可知,核桃叶浸提液在浓度低于0.02 g/ml 时对小麦苗高具有一定的促进作用,当浓度高于0.02 g/ml 时对小麦苗高具有一定的抑制作用,但促进和抑制作用与对照差异均不显著;浸提液对油菜苗高的影响表现为抑制作用,随着浓度的升高,抑制作用逐渐增强,当浓度为0.10 g/ml 时,抑制作用最强,且与对照差异显著;浸提液对桔梗苗高也存在抑制作用,但抑制作用不明显,与对照差异均不显著;浸提液对苦参苗高在0.02 ~0.06 g/ml 时具有促进作用,但促进作用与对照差异不显著,当浓度达到0.08 g/ml 以上时表现抑制作用,且抑制作用与对照差异显著。当浸提液浓度低于0.06 g/ml 时对小麦的主根长具有促进作用,但促进作用与对照差异不显著,当浓度高于0.08 g/ml 时对小麦主根长表现为抑制作用,且抑制作用与对照差异显著;浸提液对油菜主根长的影响表现为抑制作用,且随着浸提液浓度的升高,抑制作用增强,在 0.06 g/ml 时与对照差异显著,在0.10 g/ml 时与对照差异极显著。不同浓度的浸提液对小麦幼苗鲜质量具有抑制作用,但抑制作用与对照差异不显著;浸提液对油菜幼苗鲜质量表现为抑制作用,随着浸提液浓度的升高,抑制作用增强,当浓度高于 0.08 g/ml 时,抑制作用与对照差异显著;当浸提液浓度低于0.04 g/ml 时,对桔梗幼苗鲜质量表现为促进作用,但促进作用与对照差异不显著,当浸提液浓度高于0.04 g/ml 时,对桔梗幼苗鲜质量表现为抑制作用,当浓度高于0.08 g/ml 时抑制作用与对照差异显著;当浸提液浓度低于0.06 g/ml 时,对苦参幼苗鲜质量表现为促进作用,在0.06 g/ml 时与对照差异显著,当浓度高于0.06 g/ml 时,表现为抑制作用,但与对照差异不显著。进一步方差分析结果表明(表4),核桃叶浸提液处理下,不同作物种类间主根长、苗高、幼苗鲜质量等幼苗生长指标差异达到了极显著水平(P<0.01);浸提液浓度对作物幼苗主根长、苗高影响差异极显著(P<0.01),但对幼苗鲜质量的影响差异不显著(P>0.05)。另外,从浸提液对不同作物间化感综合效应(表5)可知,核桃叶浸提液对4 种作物的综合效应均为抑制作用,其中对油菜的化感效应最强,其次是桔梗,对小麦和苦参的化感效应最弱。
表3 不同浓度核桃叶浸提液处理下4 种作物幼苗生长指标的影响(±s)†Table 3 Effects of walnut leaf extracts with different concentrations on seedling growth indexes of four crops

表3 不同浓度核桃叶浸提液处理下4 种作物幼苗生长指标的影响(±s)†Table 3 Effects of walnut leaf extracts with different concentrations on seedling growth indexes of four crops
† 同列不同小写字母表示处理间在0.05 水平存在显著性差异,不同大写字母表示处理间在0.01 水平存在显著性差异。 The different lowercase letters within the same column indicate significant difference at 0.05 level, and uppercase letters indicate significant difference at 0.01 level.
作物种类 浸提液浓度 苗高 主根长 苗鲜质量Crop type Extract concentration /(g·ml-1)Seedling height /cm Main length /cm Seedling fresh mass /g CK 17.53±0.10 aA 11.51±1.22 abAB 8.91±0.80 aA 0.02 18.80±0.29 aA 14.87±0.46 aA 8.43±0.61 aA小麦Wheat 0.04 15.02±2.85 aA 9.54±0.31 bcB 8.28±1.15 aA 0.06 17.97±0.37 aA 11.65±1.49 abAB 8.39±0.49 aA 0.08 15.56±0.41 aA 7.57±1.09 cB 7.90±0.27 aA 0.10 15.11±0.82 aA 7.02±1.09 cB 7.93±0.83 aA油菜Rape CK 15.47±0.56 aA 13.03±0.43 aA 4.6±0.58 aA 0.02 13.90±0.68 abAB 12.61±0.46 abA 4.5±0.58 abA 0.04 12.98±0.91 abAB 12.30±0.96 abA 4.43±0.88 abA 0.06 12.74±0.40 abAB 11.05±0.69 bcAB 4.33±0.88 abA 0.08 11.71±0.95 bAB 10.78±0.84 bcAB 4.27±0.33 bA 0.10 11.14±0.31 bB 9.36±1.04 cB 4 .23±0.88 bA桔梗P.grandiflorus CK 2.30±0.31 aA 1.49±0.13 aA 0.46±0.01 abAB 0.02 1.70±0.27 aA 1.199±0.06 aAB 0.46±0.01 abAB 0.04 1.97±0.13 aA 1.15±0.29 abAB 0.48±0.01 aA 0.06 1.88±0.35 aA 1.06±0.30 abAB 0.45±0.01 bcAB 0.08 1.96±0.03 aA 1.11±0.12 abAB 0.47±0.01 abAB 0.10 1.38±0.16 aA 0.70±0.15 bB 0.43±0 .01 cB苦参S.flavescens CK 2.27±0.39 abA 2.42±0.35 aA 1.81±0.15 bcB 0.02 2.82±0.69 abA 2.21±0.15 aA 1.87±0.09 bcB 0.04 2.87±0.23 abA 2.06±0.30 aA 2.09±0.15 bB 0.06 3.24±0.13 aA 2.34±0.49 aA 2.61±0.06 aA 0.08 1.54±0.26 bA 0.60±0.07 bB 1.59±0.06 cB 0.10 1.22±0.24 bA 0.49±0.05 bB 1.53±0.09 cB
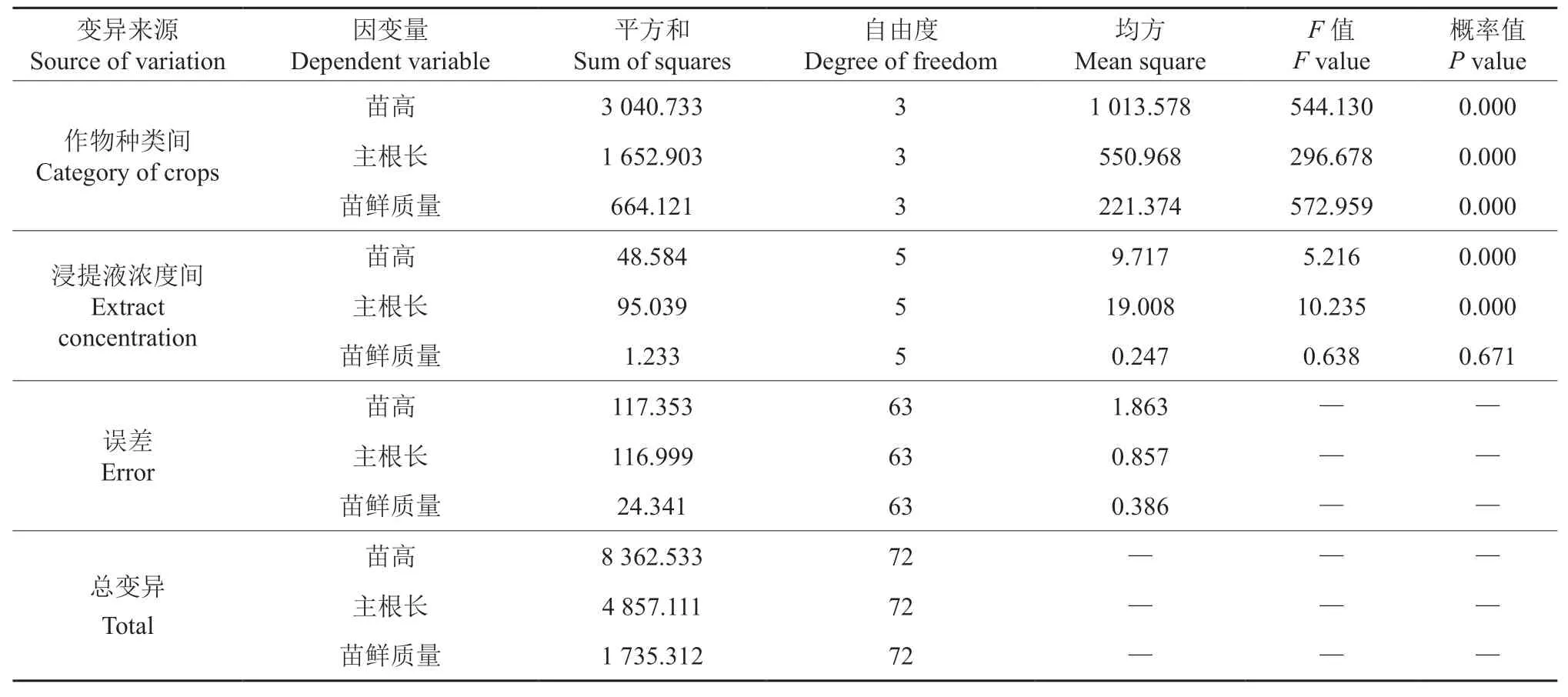
表4 不同浓度浸提液对4 种作物幼苗生长指标的方差分析Table 4 Variance analysis of different concentrations of extracts on growth indexes of four crop seedlings
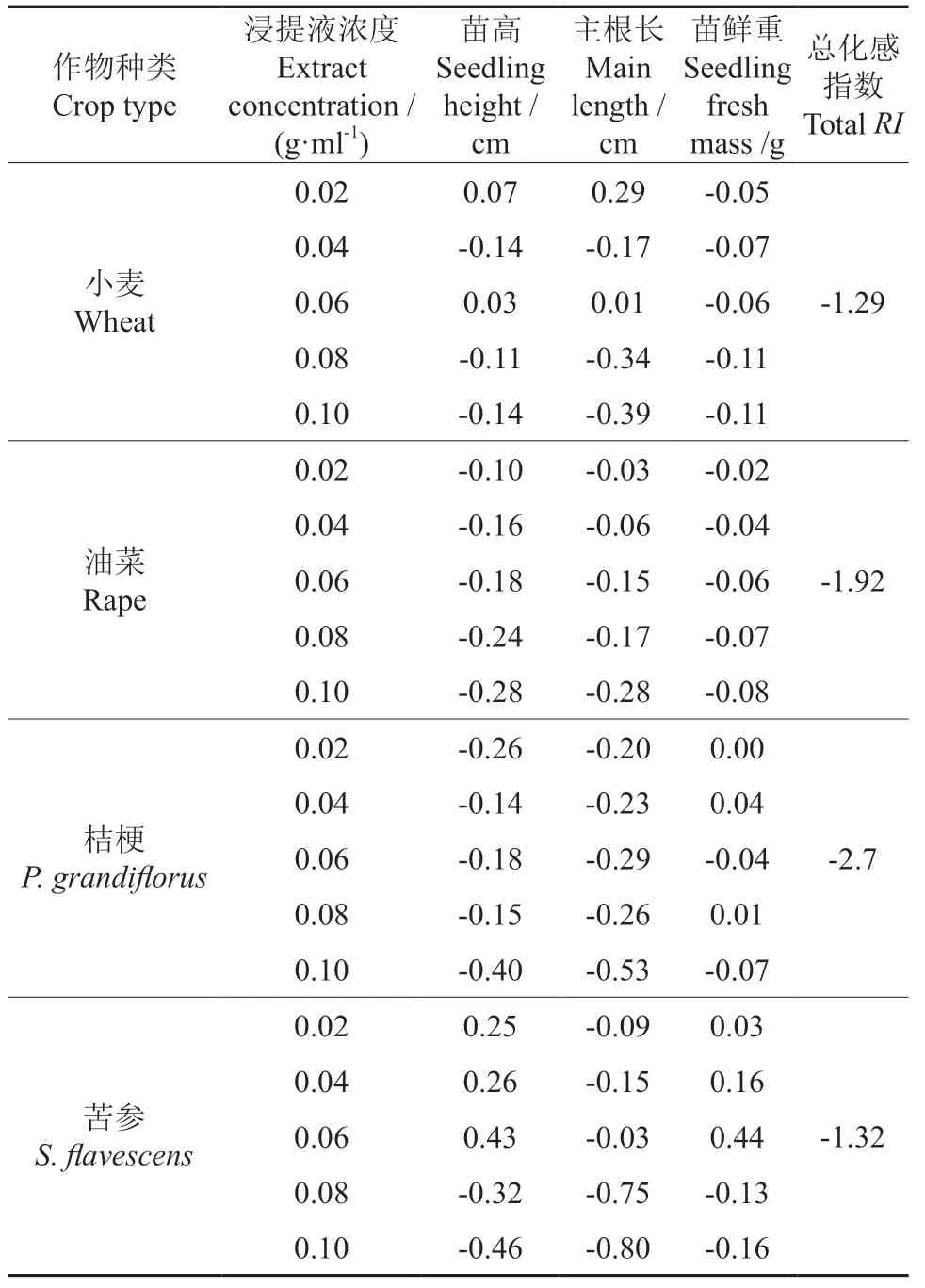
表5 不同浓度浸提液对4 种作物幼苗生长指标的化感指数Table 5 Allelopathy index of different concentration extracts on growth index of four crops seedlings
3 讨论与结论
化感作用是植物进化过程中形成的一种对环境的适应机制,它的存在有利于保持物种的竞争优势[19],具有化感作用的植物,几乎所有组织和器官中都能合成化感物质[20-21],以化感植物的器官为供体,利用水浸提法是收集化感物质的最常用方法[22],已被广泛用作植物化感作用的研究[23-26]。 作为植物生命周期中的关键环节,种子萌发对植物生长发育至关重要,农业生产中,种子萌发情况和苗期长势对作物产量影响很大,研究化感物质对种子萌发及幼苗生长的影响具有重要意义。也有学者认为植物叶片中含有化感物质较多[27]。因此,本试验以核桃叶片作为化感物质的供体,用水浸提法收集核桃化感物质,在前人研究基础上设置了更高浓度(0.02、0.04、0.06、0.08、0.10 g/ml) 的多个质量浓度梯度,研究了不同浓度核桃浸提液对4 种作物种子萌发及幼苗生长的影响,结果表明:核桃叶浸提液对4 种作物种子的萌发及幼苗生长都有不同程度促进和抑制的双重作用,表明核桃叶浸提液对4 种作物种子萌发及幼苗生长均存在化感效应,但相同浓度的浸提液对不同作物种子萌发及幼苗生长的化感强度不同,相同浓度的核桃叶浸提液对同一作物幼苗不同生长指标的化感强度也不相同,表明同一化感物质对不同受体植物的化感效应不同,同一受体不同生长部位对化感作用的敏感性不同。
不同浓度的核桃叶浸提液对4 种作物的发芽势均表现为低促高抑的双重效应,但抑制作用强于促进作用,其中油菜种子发芽势对浸提液浓度最敏感,当浸提液浓度为0.04 g/ml 时转为抑制作用,且随着浓度的升高抑制作用增强;其次为小麦和桔梗,当浸提液浓度为0.06 g/ml 时转为抑制作用;当浸提液浓度低于0.06 g/ml 时对苦参种子的发芽势具有促进作用,且在这一范围类随着浓度的增大,发芽势增高,当浓度高于0.08 g/ml 时转为抑制作用。不同浓度的核桃叶浸提液除了对油菜种子发芽率表现为抑制作用外,对其它3 种作物种子发芽率的影响同发芽势的基本一致。
本试验中,不同浓度核桃叶浸提液处理下4种作物幼苗生长指标测定结果表明,相同浓度的浸提液对不同受体作物影响不同或对同一作物不同生长指标影响不同,这与前人的研究结果相一致[28-30]。其中,浸提液对作物主根长的化感作用最强,其次是苗高,对苗鲜质量的化感作用最弱,这与沈平[31]、王蓓等[30]的研究结果相一致。Chon等[32]研究发现,植物根部对化感物质的反应较地上部分更敏感,有人猜测可能是根部与处理液直接接触,最先受到伤害,地上部分只有当根系受害作用积累到一定程度时才会表现[33],这与本试验中核桃叶浸提液对4 种作物主根长的化感作用强于苗高和幼苗鲜质量的结论相一致。
本试验中,浸提液对不同作物幼苗生长的综合化感效应分析结果表明,核桃叶浸提液对4 种作物的综合效应均为抑制作用,其中对油菜种子的抑制作用最强,其次是桔梗,对小麦和苦参种子的抑制作用最弱,这可能是由于小麦和苦参种子对核桃化感物质的耐受度强,也可能由于油菜和桔梗种子籽粒较小且种皮较薄,容易受到浸提液的损伤,导致种子对水分的吸收困难造成的,因此,可以在农林复合种植模式中,适当选择种子较大、种皮较厚的作物,以保证种子的正常萌发和幼苗生长,为最终的作物产量打下良好基础。
本研究还存在一定的不足之处,比如本试验使用水浸提法获取核桃叶片中的化感物质,只能提取水溶性或亲水性的化感物质,且水浸提试验用时较短,忽略了土壤及土壤中微生物对核桃叶片腐解时化感物质的释放和表达产生的影响。因此,采用不同提取方法研究核桃化感物质的化学成分,同时收集核桃凋落叶,采用盆栽试验,模拟核桃凋落叶的自然腐解过程,研究核桃凋落物对其他作物的效应,将是本课题组下一步研究的方向。
