杜仲根际与非根际土壤微生物的差异研究
2022-01-22李德文季倩如周文玲吴嘉仪唐中华赵雨森
李德文,季倩如,刘 英,周文玲,吴嘉仪,唐中华,赵雨森
(东北林业大学 a.森林植物生态学教育部重点实验室;b.化学化工与资源利用学院; c.林学院,黑龙江 哈尔滨 150040)
植物的生长会导致其根际土壤发生变化[1]。研究植物生长中根际与非根际间的土壤性质差异性,对指导植物林建设有重要的理论和实践意义。土壤理化指标是土壤相关研究的基础,通过对土壤pH、碳氮磷等含量的测定,可以直观的得出土壤养分含量的变化。土壤微生物是土壤内部物质循环的主要生物因子,是物质循环的关键驱动者[2]。 林地土壤微生物在维持和提高土壤肥力、促进森林物质、能量循环中起着重要作用。目前,土壤养分循环涉及的功能基因类别广泛,例如,在土壤氮循环方面,有可以研究土壤中固氮菌类群多样性的nifH基因、在土壤中起硝化和反硝化作用的amoA、nirS、narG和nirS基因,在磷循环方面,也有起矿化作用的phoD基因等等。这些基因表达量的变化均与其理化性质改变密切相关,通过研究土壤养分循环基因的变化来探讨植物根际与非根际环境的差异是农林土壤研究的重点。
杜仲(Eucommia ulmoidesOliv.)是杜仲属仅存的孑遗植物,是退耕还林系统中具有广泛市场前景的绿色树种之一,树皮和树叶均可用药,具有很高的药用价值和经济价值[3]。对于不同地区同种植物根际土壤微生物群落的分析已有很多,以杜仲为例,不同种植地的杜仲根际微生物皆存在不同程度差异,而这些差异性会导致杜仲主要有效成分发生改变[4-5],在相同生境下,距离杜仲不同距离的土壤微生物成分的研究还较少,而根际与非根际土壤养分含量及微生物的差异的研究对于杜仲培育具有重要意义。基于此,本文通过研究杜仲根际与非根际土壤理化性质及微生物群落结构等的差异,探讨杜仲种植对于其土壤营养元素含量的微生物影响机制,以期为今后人工林生态系统的科学管理提供一定的理论依据与数据支撑。
1 材料与方法
1.1 供试材料采集
土壤样品于2020年10月8日在东北林业大学校园内采集,选取栽种的杜仲植株采集其根际土壤与非根际土壤,根际土采用抖落法,非根际土采用“S”型采样法,各取5 个取样点并分别均匀混合,一部分风干用于土壤理化性质的测定,一部分直接带入实验室进行土壤微生物群落分析,一部分液氮运输,立即进行DNA 提取以用于后续功能基因分析。
1.2 研究方法
1.2.1 土壤理化指标测定
参照土壤农化分析方法[6]分别测定土壤pH、电导率、含水量等土壤基本理化指标。
采用重铬酸钾外加热法测定土壤有机碳含量;采用半微量凯氏定氮法测定土壤全氮含量;采用NaOH 熔融——钼锑抗比色法测定土壤全磷含量;采用碱解扩散法测定土壤碱解氮含量;采用靛酚蓝比色法测定土壤铵态氮含量;采用紫外分光光度法测定土壤硝态氮含量;采用碳酸氢钠提取——钼锑抗比色法测定土壤速效磷含量[7]。
1.2.2 Biolog-Eco 测定
采用Biolog-Eco 法[8-9]测定土壤微生物功能多样性,称取10 g 新鲜土壤样品,置于灭菌后的内含90 mL 0.85% NaCl 溶液的三角烧杯中, 200 r/min 下振荡30 min 后,继续用NaCl 溶液稀释至10-3g/mL,把稀释液加入到Biolog-ECO 板的96 个孔中(每孔各150 μL),25 ℃下暗环境培养10 d,每隔24 h 在酶标仪上测定590 nm 下吸光值。
1.2.3 土壤微生物功能基因表达量测定
使用E.Z.N.A.®Soil DNA Kit 试剂盒(Omega公司)提取土壤DNA。根据试剂盒步骤进行提取,获得的DNA 于-80 ℃下保存,再用紫外分光光度计进行DNA 浓度及纯度的测定,同时进行凝胶电泳检测,得到优质DNA。随后,采用qPCR 法测定根际及非根际土壤功能基因表达量,表1 为扩增引物序列。
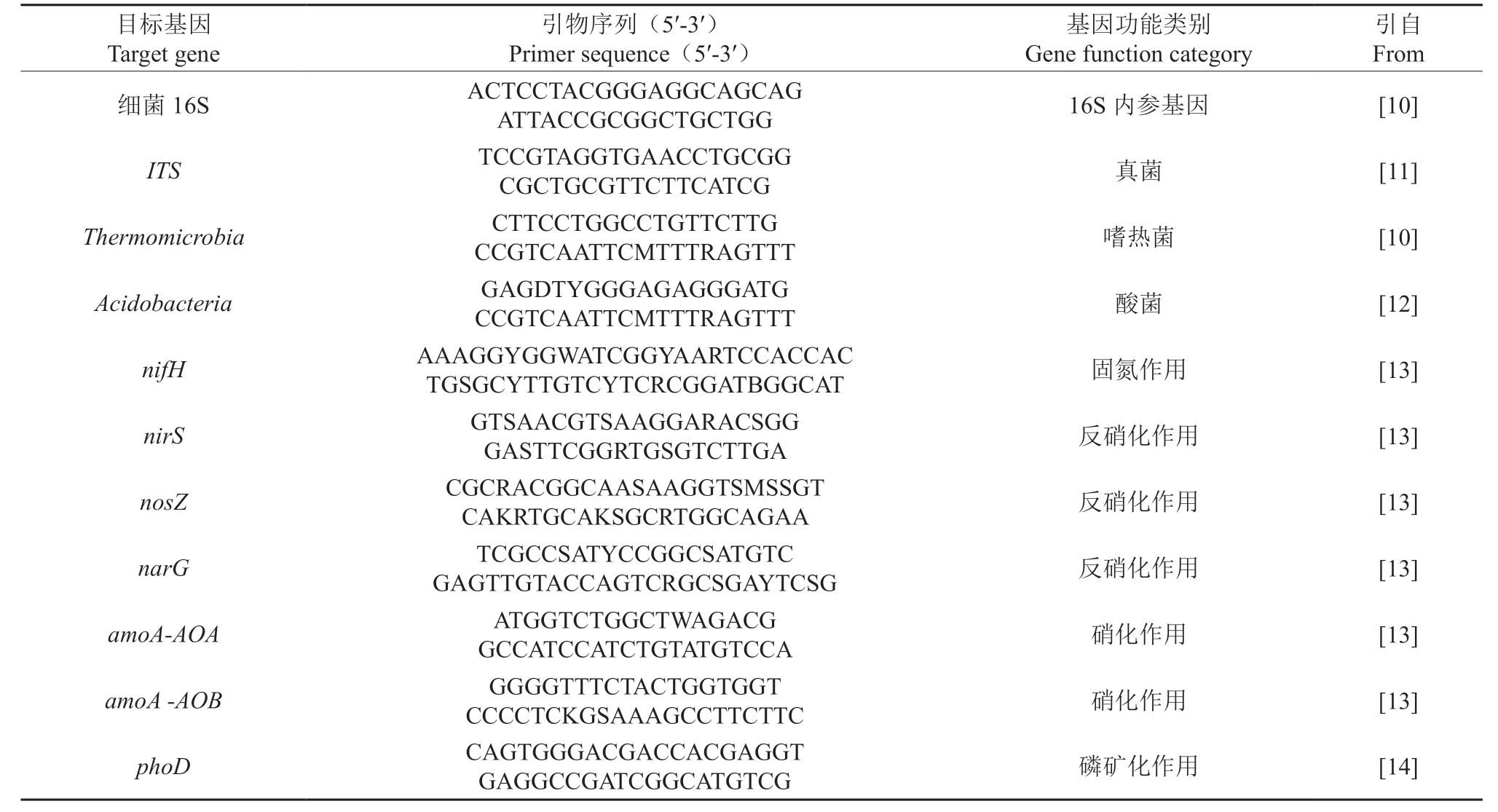
表1 土壤养分循环微生物功能基因PCR 扩增引物序列Table 1 PCR amplification primer sequence of soil nutrient cycling microbial functional genes
1.3 数据处理
采用SPSS 19.0 统计分析软件进行样本T 检 验;采用Canoco 5.0 软件进行冗余分析;采用Excel 软件作图。
2 结果与分析
2.1 根际与非根际土壤理化指标差异分析
由表2 可知,杜仲根际与非根际土壤理化指标均存在差异。其中根际土壤(GJ)电导率低于非根际土壤(FG),GJ 全氮含量达到2.42± 0.08 g/kg,比FG 全氮含量高30.81%,GJ 碱解氮含量高达65.33±2.69 g/kg,是FG 的1.39 倍,根际硝态氮含量比非根际含量低,上述指标均差异显著(P<0.05);土壤有机碳、全磷、速效磷等GJ 指标的含量也均高于FG 含量。杜仲GJ 与FJ间土壤碳、磷含量在差异不显著,土壤氮含量影响显著(P<0.05)。
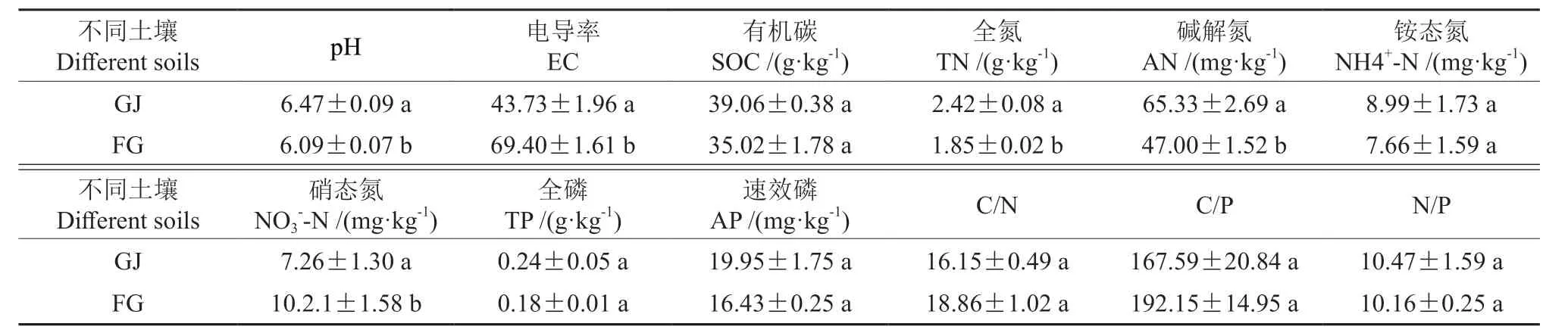
表2 杜仲GJ 与FG 理化指标含量†Table 2 Content of physical and chemical indexes in GJ and FG of E.ulmoides
2.2 根际与非根际土壤微生物群落功能多样性指数变化分析
由图1 可知,杜仲GJ、FG 微生物AWCD 值随着培养时间的延长,对碳源的利用总量也都呈逐渐增加的趋势,即微生物活性随着培养时间的延长而变强;土壤微生物在培养24 h 后,逐渐适应了Biolog-Eco 微平板基质环境,AWCD 值快速增长,直至144 h,此时其中微生物对于碳源的利用明显增加,随后又缓慢增长,直至最后趋于稳定。不同培养阶段杜仲GJ 的AWCD 均显著高于FG,说明GJ 的微生物群落碳源利用量及代谢活性均高于FG。

图1 土壤微生物群落AWCD 随培养时间变化Fig.1 AWCD of soil microbial community changed with incubation time
由表3 可知,不同类型土壤微生物群落代谢存在活性差异,其中GJ 的总碳源的利用能力(AWCD),物种McIntosh 指数(U)均显著大于FG (P<0.05),在Simpson 指数(D)、Shannon 指数(H)上无明显差异。

表3 土壤微生物群落 144h AWCD 和多样性指数Table 3 144h AWCD and diversity index of soil microbial community
2.3 根际与非根际土壤功能性微生物表达量的差异分析
6 种氮循环功能基因(nifH、nirS、nosZ、narG、amoA-AOA、amoA-AOB)以及Thermomicrobia和ITS基因的GJ 表达量均高于FG,其中ITS基因相差3.92E+05、nifH基因相差4.70E+04、nosZ基因相差2.40E+05,它们的GJ 与FG 表达量间多存在显著差异(P<0.05);而GJAcidobacteria表达量为6.26E+05,远远低于其FG 该基因表达量,GJPhoD表达量也比其FG 表达量低43%,与上述基因恰好相反。Thermomicrobia、nifH、nirS、amoA-AOB、narG基因的拷贝数较低。
2.5 根际与非根际土壤理化指标与功能基因的相关分析
根据冗余分析(Redundancy analysis,RDA) 中箭头的长度、各功能基因之间的夹角以及冗余分析排序可知(图3),在杜仲GJ 中影响最大的是phoD和Acidobacteria基因,它们与土壤铵态氮、碱解氮、全磷呈正相关;与硝态氮、全氮等呈负相关,RDA 两轴的累积贡献率分别为76.45%和23.55%。杜仲FG 两轴的累积贡献率分别为81.94%和18.06%,nirS基因与phoD基因对其土壤理化指标影响最显著,它们与土壤全氮、速效磷、全磷呈正相关,与其他指标呈负相关。由表4 可知,phoD基因是GJ 微生物与功能基因间的最大影响因子,解释率为70.3%(F=2.4,P=0.148),其次是Acidobacteria(F <0.1,P=1);nirS基因是FG 微生物与功能基因间的最大影响因子,解释率为81.9%(F=4.5,P=0.148),其次是phoD(F<0.1,P=1)。

图3 GJ 与FG 功能性微生物与理化指标的RDA 分析Fig.3 RDA analysis of functional microorganisms and physicochemical indexes in GJ and FG
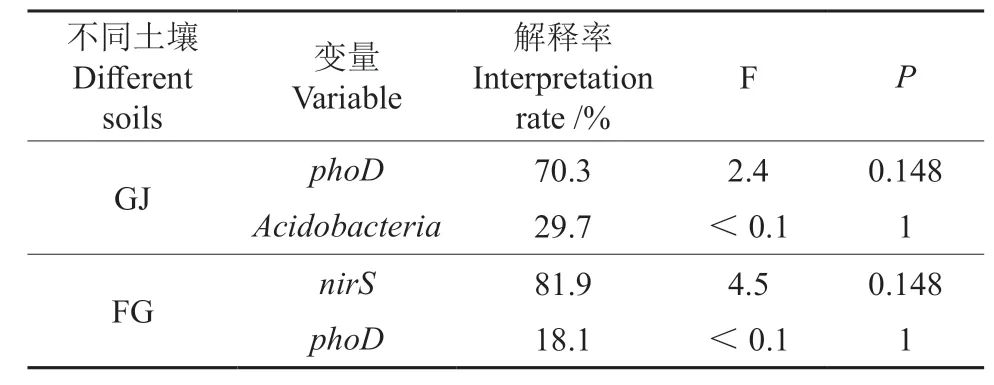
表4 土壤功能性基因微生物与理化指标冗余分析排序结果Table 4 Ranking results of soil functional genes and physical and chemical indexes by redundancy analysis
3 结论与讨论
有研究表明,草灌根际土壤全氮含量显著(P< 0.05)高于非根际土壤83.33%;同一植被根际土壤全磷含量低于非根际土壤[15-16]。不同种植模式下油茶林地根际土壤中有效磷含量显著高于非根际土壤[17]。红花在不同的浇灌方式下的根际土壤理化指标(全氮、全钾、全磷、有机质、碱解氮、速效钾、速效磷等含量,含水率)均高于或显著高于非根际土壤[18]。本研究中,杜仲根际土壤碳、氮、磷含量均高于非根际土壤,且杜仲根际与非根际土壤间全氮、碱解氮、硝态氮含量均差异显著 (P<0.05),与上述结果(表2)一致。
碳在调节土壤养分循环、保持土壤肥力和作物产量等方面发挥着重要作用。有研究表明,土壤有机碳显著影响微生物的活性和代谢,而微生物的丰度和结构对土壤有机碳的积累和固定极其重要[19]。平均颜色变化率(average well color development,AWCD)表示土壤微生物群落对31种碳源的利用能力和代谢活性的变化,体现了土壤微生物群落生理功能多样性[20]。AWCD 值越大,意味着土壤微生物密度越大,活性越高;反之,微生物密度越小,活性越低。有研究表明,在对双季水稻不同的处理条件下,均可发现其土壤中的不同部位,根际土壤微生物生物量碳含量和土壤微生物基础呼吸高于非根际土壤,而非根际土壤微生物生长速率和微生物线索均高于根际土壤[21]。 土壤微生物群落AWCD 以及各功能多样性指数与土壤含水量和有机碳显著正相关(P<0.05),与pH 显著负相关(P<0.01)[22],杜仲根际土壤pH 则显著高于非根际土壤(表2),与其根际土壤与非根际土壤的含盐量差异有关,土壤含盐量变化对土壤电导率的影响呈显著正相关[23],本研究中,杜仲根际土壤电导率显著低于非根际土壤,所以其根际土壤的含盐量显著低于非根际土壤。采用培养144 h 后的土壤微生物吸光值计算分析其McIntosh 指数(U)、Simpson 指数(D)和Shannon(H)指数,结果表明,杜仲根际的土壤微生物含量较高且能较早利用碳源,与多数结论相同[16-24],且由表3 可知,杜仲根际土壤包含的植物养分更多,且均匀度指数显著高于非根际土壤,为土壤微生物代谢活动提供营养元素和较好的生境,从而有利于微生物分解有机物和某些生物,加快了土壤有机物周转速度。
土壤微生物参与了土壤中发生的所有过程,是土壤生态系统中养分源和汇的一个巨大的原动力,它们可以影响腐殖质的形成,增加土壤肥力,通过分解有机物为植物提供养分,在植物凋落物分解、土壤能量转移、养分循环与平衡、土壤理化性质改善、林分发育及生态系统的长期稳定性中发挥着重要的作用。本研究针对10 种不同功能类型土壤微生物基因(表1),及采用上述功能基因来评价土壤微生物参与的养分循环过程。以往的研究显示,nifH、amoA-AOA、amoA-AOB、narG、nirS、nosZ基因丰度与氮储量具有显著线性关系,这表明含有这些基因的微生物量对于提高土壤氮储量具有重要作用。本研究中结果表明:根际土壤基因表达量均高于非根际土壤,且其中nifH、amoA-AOA、nosZ差异显著(P<0.05),可以看出杜仲微生物丰度受土地利用变化的影响很大。Acidobacteria及phoD基因非根际土壤表达量高于根际土壤(P<0.05),与杜仲分泌以及其土壤养分的差异有关,由表2 可知,杜仲根际土壤的pH 显著高于非根际土壤,非根际土壤的酸性程度高于根际土壤,这可能就是其根际土壤Acidobacteria基因表达量显著低于非根际土壤导致的。土壤全氮和速效磷含量是影响土壤氮循环基因的主要因素[25]。本研究中根际土壤与非根际土壤全氮的差异显著(P<0.05),速效磷有差异但不显著(表2),这可能也与氮循环相关基因nifH、amoA-AOB、nirS等的拷贝数较低(图2)有关。

图2 土壤功能性微生物表达量Fig.2 Expression of soil functional microorganisms
本文选择土壤电导率、pH,土壤碳氮磷,铵态氮、硝态氮以及C/N、C/P 等土壤理化指标与土壤功能性基因进行RDA 分析。RDA 分析表明,phoD基因是根际土壤微生物与功能基因间的最主要影响因子,nirS基因是非根际土壤微生物与功能基因间的最主要影响因子。有研究显示,土壤铵态氮和硝态氮含量变化是导致土壤反硝化菌群多样性和反硝化酶活性差异的关键因子[26],nirS基因是重要的起反硝化作用的基因之一,杜仲非根际土壤与铵态氮、硝态氮呈负相关,而根际与非根际间nirS基因表达量差异不显著,这可能是因为其表达量均较低导致的。有研究表明,phoD基因丰度和Shannon 指数与土壤pH 显著正相关,而与总磷、速效磷、硝态氮和铵态氮均显著负相关[27],特定phoD微生物的功能可能因土壤中植物的不同而不同[28],还有研究表明,大气氮沉降可导致土壤微生物生长处于碳限制的状态,从而使微生物量及其活性下降,其磷固持能力也随之下降[29]。本文中phoD基因对于杜仲根际与非根际的影响都很大。phoD基因在土壤循环中起到磷矿化的作用,杜仲根际土壤中的phoD基因表达量低于非根际土壤,可能就是导致其根际土壤与非根际土壤碳、磷含量差异不明显的原因,这也充分验证了phoD基因是杜仲土壤理化性质变化的主要因素之一(表4)。
杜仲GJ 营养元素含量高于FG,其中pH、电导率、全氮、碱解氮、硝态氮差异显著;杜仲GJ微生物含量比FG 高且能较早利用碳源、根际土壤的总碳源的利用能力(AWCD),物种McIntosh 指数(U)均显著高于FG;phoD和Acidobacteria基因及nirS和phoD基因分别与杜仲GJ 与FG 理化指标相关性最高,即phoD基因是杜仲土壤理化指标与功能基因间的主要影响因子。本研究仅对校园内栽种的杜仲进行实验分析,而不同的温度、环境、树龄和胸径[30]等均会影响根际与非根际土壤元素的含量。为了进一步研究杜仲土壤营养元素与其土壤微生物含量间的关系,后续可以采集大田或林地杜仲的土壤进行相关分析,为今后更深入的研究杜仲微生物影响机制、分析其栽培管理方式提供一定的理论依据与数据支撑。
