罗汉果黄素及其主要代谢物抗糖基化活性研究
2022-01-20童优芸李梦月高艺笑项颖芳刘合生
◎ 陈 杨,童优芸,李梦月,高艺笑,项颖芳,刘合生
(1.浙江万里学院 生物与环境学院,浙江 宁波 315100;2.诺安检测服务有限公司,浙江 宁波 315000)
随着经济发展水平的迅速提高及生活方式的改变,高糖、高脂肪的饮食结构及缺乏运动的生活方式使得糖尿病及其并发症的发病率、死亡率及医疗成本呈现快速上升趋势[1]。目前商品化的抗糖尿病药物根据其作用机制不同可以分为多种类型,如α-葡萄糖苷酶抑制剂、胰岛素增敏剂、二肽基肽酶抑制剂以及糖基化抑制剂等[2]。其中糖基化抑制剂可显著减轻糖尿病症状、延缓糖尿病进程及降低糖尿病并发症风险[3]。但是长期服用这类药物容易引发多种毒副作用,如胃肠道紊乱、肝脏疾病、流感样症状、罕见血管炎以及肾脏肿瘤等[4],因此天然来源、特别是膳食来源的AGEs抑制剂因其具有无或轻微毒副作用、来源广泛、食用方便及相对廉价等优点而受到广泛关注[5]。大量文献报道了天然来源提取物或其活性成分具有强烈抗AGEs或抗糖基化作用[6]。罗汉果黄素是罗汉果(Siraitia grosvenorii)果实中的一种特征性黄酮类化合物,其主要代谢物有山奈苷、α-rhamnoisorobin、阿福豆苷和山奈酚,均具有明显的抗氧化活性,且代谢物活性比原形物的更高[7]。而抗氧化与抗糖基化作用显著相关,因此罗汉果黄素是否具有显著的抗糖基化活性有待验证。经胃肠道消化、转化后,罗汉果黄素代谢产物是否也具有抗糖基化作用,以及代谢前后抗糖基化活性是否变化,目前尚无相关文献报道。因此,本项目拟利用牛血清白蛋白-果糖-葡萄糖(BSA-Fru-Glu)体外糖基化体系,探讨罗汉果黄素及3种胃肠道主要代谢物山奈苷、阿福豆苷和山奈酚对AGEs抑制活性,以期为罗汉果抗糖尿病功能性食品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
罗汉果黄素、阿福豆苷、山奈苷和山奈酚标准品购于成都普瑞法科技开发有限公司;牛血清白蛋白(BSA)购于北京索莱宝科技有限公司;5,5’-二硫代双(2-硝基苯甲酸)(DTNB)、葡萄糖以及果糖购于阿拉丁试剂有限公司;盐酸氨基胍(AG)、硫黄素T来源于Sigma公司;果糖胺试剂盒购买于南京建成生物工程研究所;其他试剂均为国产分析纯。
1.2 仪器与设备
F-380荧光分光光度计,天津港东科技股份有限公司;Infinite M200 Pro多功能酶标仪,瑞士Tecan公司。
1.3 试验方法
1.3.1 体外糖基化体系
参照文献[8]方法,略微修改。含10 mg·mL-1BSA的0.1 mol·L-1pH=7.4的磷酸钠缓冲液(PBS),加入终浓度0.2 mol·L-1的果糖和0.2 mol·L-1的葡萄糖,再加入一定量溶解于10%二甲亚砜(DMSO)水溶液的罗汉果黄素、山奈苷、阿福豆苷、山奈酚和AG储备溶液,使其终浓度分别为0.1 mmol L-1和1 mmol·L-1的罗汉果黄素、山奈苷、阿福豆苷和山奈酚的抑制剂组及阳性对照组,以含10 mg·L-1BSA、0.2 mol·L-1葡萄糖、0.2 mol·L-1果糖,不含抑制剂或阳性对照的 0.1 mol·L-1pH=7.4的PBS为模型组,以含10 mg·mL-1组,BSA的0.1 mol·L-1pH=7.4的PBS为 空 白 对 照组,同时做本底组(含相同浓度DMSO的抑制剂+PBS),所有组均加入终浓度为0.02%的叠氮化钠,以抑制微生物生长。每个组设置3个平行,37 ℃恒温水浴锅中避光孵育4周,每周取样测定下列指标。
1.3.2 晚期糖基化产物(AGEs)的检测
参照文献[8]方法并略做修改。移取150 μL糖基化样品,置于黑色96孔板中,酶标仪于激发波长 350 nm,发射波长450 nm测定荧光强度。按下式计算抑制率:
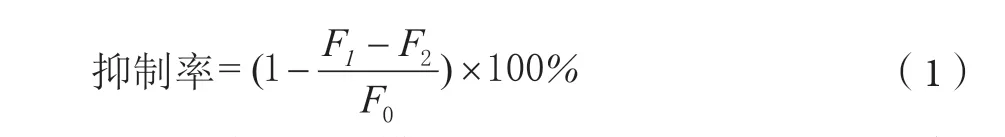
式(1)中:F0为模型组(BSA-Fru-Glu)荧光强度;F1为抑制剂组荧光强度;F2为本底组荧光强度。
1.3.3 果糖胺含量测定
参照文献[8]描述方法,略做修改。准确移取100 μL糖化样品置于96孔板中,加入0.25 mmol·L-1氮蓝四唑溶液(溶于0.1 mol·L-1pH=10.35的碳酸钠-碳酸氢钠缓冲液)100 μL,37 ℃孵育30 min,于530 nm处测定吸光度,按下式计算果糖胺含量:

式(2)中:A为530 nm测定的吸光度;L为光程(cm);ε为摩尔消光系数,为12640 L·mol-1·cm-1;V1为测量体系总体积(mL);10-3为mL与L的换算系数;109为mol与nmol的换算系数;c为BSA浓度(mg·mL-1);V2为取样体积(mL);结果表示为nmol果糖胺/mg蛋白质。
1.3.4 蛋白羰基含量测定
参照报道[8]的方法,稍做修改。准确移取糖化BSA溶液100 μL,加入10 mmol·L-12,4-二硝基苯肼溶液(溶于2.5 mol·L-1盐酸)400 μL,充分混合,黑暗中孵育1 h后,加入0.5 mL的20%(m/v)的三氯乙酸沉淀蛋白质,立即于冰上放置5 min,4 ℃,10000×g离心10 min,弃上清,沉淀用0.5 mL乙醇/乙酸乙酯(1∶1,v/v)混合液洗涤3次后,加入 6 mol·L-1的盐酸胍溶液0.25 mL,反复涡旋至溶解,准确移取200 μL旋至至96孔板,酶标仪于370 nm处测定吸光度,样品羰基含量按下式计算:

式(3)中:A为370 nm测定的吸光度;L为光程(cm),即96孔板液面高度;ε为2,4-二硝基苯肼的摩尔消光系数,为22000 L·mol-1·cm-1;V1为测定吸光度时样液总体积,mL;10-3为mL与L的转换系数;109为mol与nmol的转换系数;c为BSA浓度,本试验c=10 mg·mL-1;V2为取样体积,mL;结果表示为nmol羰基/mg蛋白质。
1.3.5 巯基含量测定
参照文献[8]方法,稍有修改。准确移取70 μL糖 化BSA溶液于96孔酶标板,加入130 μL的5 mmol·L-1DTNB溶 液(溶 于0.1 mol·L-1pH=7.4的PBS), 25 ℃孵育15 min,酶标仪于412 nm处测定吸光度,按照同样方法,以L-半胱氨酸(100-350 μmol·L-1)绘制标准曲线,以不加样品的DTNB溶液调零,按照下式计算巯基含量:

式(4)中:c1为L-半胱氨酸标准曲线方程计算的浓度(μmol·L-1);V1为取样体积,μL;10-6为μL与L的转换系数;c2为BSA浓度(mg·mL-1);10-3为μL与mL的转换系数;结果表示为μmol巯基/mg蛋白质。
1.3.6 类淀粉蛋白β交联结构的测定
参照文献[8]方法,略做修改。10 μL糖化BSA样品置于黑色96孔板中,加入64 μmol·L-1硫磺素T溶液(溶于0.1 mol·L-1pH=7.4的PBS)100 μL,25 ℃孵育60 min,采用酶标仪于激发波长435 nm,发射波长485 nm测定荧光强度。
2 结果与分析
2.1 罗汉果黄素与其主要代谢产物的抗糖基化效果
本研究首先比较了罗汉果黄素与其主要代谢物山奈苷、阿福豆苷和山奈酚在低浓度(0.1 mmol·L-1)和高浓度(1 mmol·L-1)下孵育4周对BSA-Fru-Glu体外 孵育体系荧光AGEs的影响。如图1所示,0.1 mmol·L-1处理4周,罗汉果黄素无明显AGEs抑制作用 (P>0.05),而山奈苷、阿福豆苷和山奈酚均显示出较低的抑制作用,抑制率分别为6.2%、8.6%和9.6%。当1.0 mmol·L-1处理4周时,罗汉果黄素处理组的荧光强度无明显变化(P>0.05),而阿福豆苷、山奈苷和山奈酚处理组的荧光AGEs显著减低(P<0.05),呈现剂量依赖性,山奈酚的抑制作用最强,抑制率达62.6%,显著高于罗汉果黄素和另外2种代谢物 (P<0.05),为此后续试验以山奈酚为研究对象。
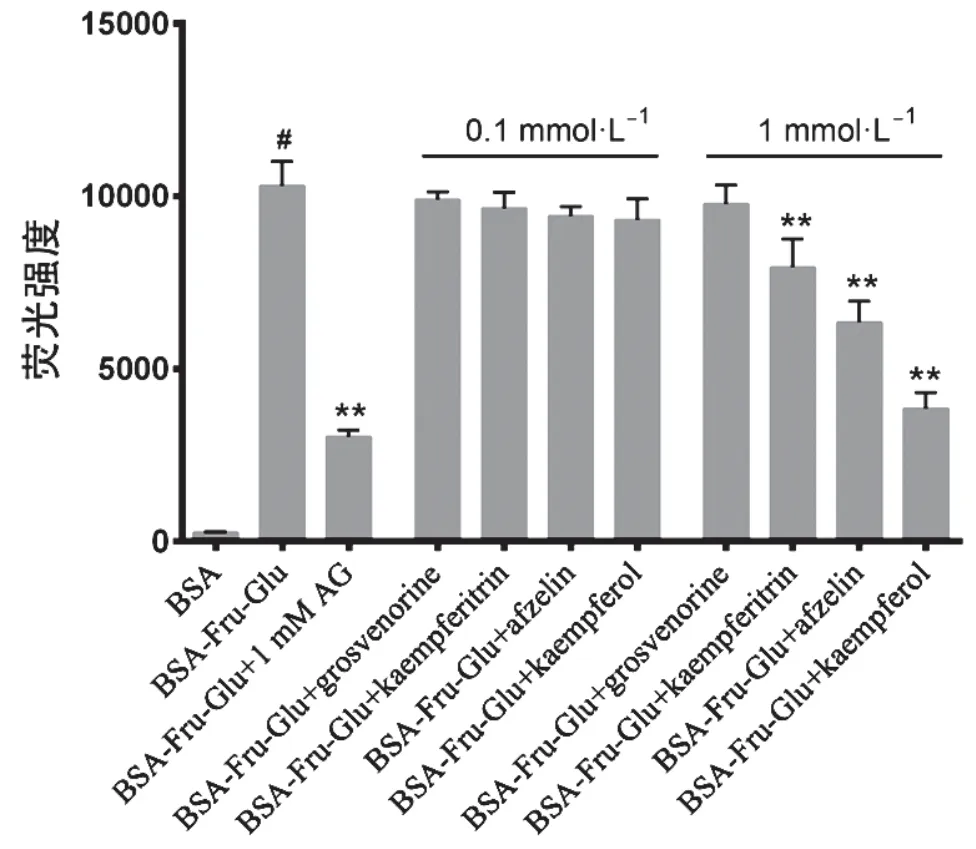
图1 罗汉果黄素及其主要代谢产物山奈苷、 阿福豆苷和山奈酚对糖基化的抑制作用图
2.2 山奈酚体外抗糖基化活性
2.2.1 山奈酚对果糖胺形成的影响
图2表明,低剂量(0.1 mmol·L-1)山奈酚对果糖胺形成无明显抑制作用(P>0.05),而高剂量 (1 mmol·L-1)尽管在第1和第4周对果糖胺含量无显著抑制作用(P>0.05),但第2、3周对其具有显著抑制作用(P<0.05),抑制效果与阳性对照(氨基胍,AG)相当,且该抑制作用呈现剂量依赖性。与Fru-Glu-BSA组比较,1 mmol·L-1山奈酚或AG孵育 3周,果糖胺含量分别降低了27.7%和33.1%。

图2 山奈酚对体外糖基化体系果糖胺形成的影响图
2.2.2 山奈酚对蛋白质氧化的影响
图3a表明低浓度(0.1 mmol·L-1)山奈酚处理 4周对糖基化体系羰基水平无明显影响(P>0.05),但高浓度(1 mmol·L-1)山奈酚在前期的抑制效果优于后期;类似地,0.1 mmol·L-1山奈酚在整个试验周期对体系的巯基水平无明显影响(P>0.05),但是与模型组比较,1 mmol·L-1山奈酚在前3周提升了巯基水平,但第4周与模型组无明显差异(P>0.05)。 与BSA-Fru-Glu组比较,1 mmol·L-1山奈酚孵育3周,羰基水平降低了19.4%,巯基水平上升了16.7%,提示山奈酚对糖基化诱导的蛋白质氧化有抑制 作用。

图3 山奈酚对体外糖基化体系蛋白质氧化的影响图
2.2.3 山奈酚对糖基化诱导的蛋白质交联的影响
蛋白质糖基化形成的活性二羰基化合物加速蛋白质-蛋白质之间形成交联结构,使其功能受损和缺失。图4表明高浓度(1 mmol·L-1)山奈酚作用4周,明显抑制β淀粉样蛋白交联结构的形成(P<0.05),与模型组比较,降低了49.2%;而低剂量(0.1 mmol·L-1)在糖基化初期,对β淀粉样蛋白交联结构形成具有较弱的抑制作用,而后期表现出一定的促进作用,这可能与山奈酚在低浓度有促氧化作用,而高浓度有抗氧化作用有关。
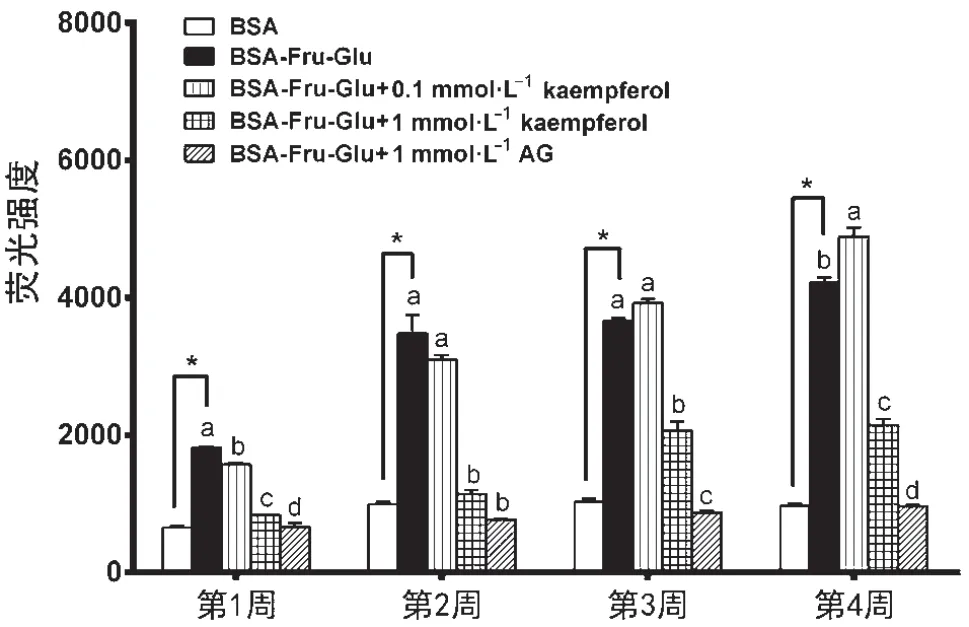
图4 山奈酚对体外糖基化体系β淀粉样蛋白交联结构 形成的影响图
3 结论
罗汉果黄素在体外无明显抗糖基化作用,但经胃肠道消化酶及肠道菌群作用后,形成的主要代谢产物山奈苷、阿福豆苷和山奈酚具有明显的体外抗糖基化活性,其活性次序为山奈苷<阿福豆苷<山奈酚,表明糖配基数量与罗汉果黄素主要代谢物的抗糖基化活性负相关。
