低蛋白饲料对杂交黄颡鱼幼鱼生长性能、体组成、转氨酶活性和抗氧化能力的影响
2022-01-20杨贺舒孙俊霄杨慧君樊启学袁勇超
杨贺舒 孙俊霄 杨慧君 樊启学 袁勇超
(华中农业大学水产学院, 农业农村部淡水生物繁育重点实验室, 湖北省水生动物病害防控工程技术研究中心, 武汉 430070)
水产饲料中蛋白质水平远高于畜禽等陆上动物[1]。饲料蛋白质水平过高, 容易导致饲料营养失衡, 降低鱼类对营养物质的消化利用效率, 增加养殖污染物的排放, 不仅增加了饲料成本, 还易造成水体环境的污染[2,3]。降低饲料中蛋白质含量可有效地降低通过动物粪便释放到水体中的氨氮, 但可能会降低动物的生长性能[4]。通过向低蛋白饲料中补充限制性氨基酸, 提高蛋白质利用率的同时也降低了养殖过程中的氮排放[5—7]。目前, 畜禽饲料中一般可以降低 2%—4% 的蛋白质含量再补充一种或几种限制性氨基酸可以保证动物生长过程中对氨基酸的需求, 避免蛋白代谢受到干扰[8—11]。随着合成氨基酸技术的进步及生产成本的降低, 提高了合成氨基酸在饲料中添加的可行性[12]。
杂交黄颡鱼“黄优 1 号”(Pelteobagrus fulvidraco ♀×Pelteobagrus vachelli ♂)是历时多年培育出的水产新品种, 具有生长快、成活率高、耐低氧能力强等优点[13], 逐渐成为黄颡鱼主要养殖品种之一。目前黄颡鱼蛋白质需求量的相关研究也已取得一定的研究成果, 商品饲料中的蛋白质含量约为40%—42%[14,15]。本实验以杂交黄颡鱼幼鱼为研究对象,探究低蛋白饲料中补充蛋氨酸和赖氨酸对杂交黄颡鱼幼鱼的生长性能、体组成、转氨酶活性及抗氧化能力的影响。
1 材料和方法
1.1 实验饲料
以进口白鱼粉、蝇蛆粉、发酵豆粕为主要蛋白源, 配置 5 组饲料, 配方如表 1 所示。以黄颡鱼商品饲料(大北农神爽黄颡鱼料)为参考, 对照组饲料粗蛋白含量为 42%, 降低饲料中的蛋白质含量分别为 37% 与 32%, 并记为 LP1 组与 LP2 组。同时,参照对照组饲料中赖氨酸与蛋氨酸含量, 向LP1 组与 LP2 组饲料中添加晶体赖氨酸与晶体蛋氨酸, 并记为 LP1+AA 组与 LP2+AA 组。饲料原料来自荣飞生态科技有限公司(安徽芜湖), 经过 60 目筛充分混匀后, 制成 2 mm 直径的饲料颗粒, 50℃ 烘干, 使用自封袋封口, 保存至-20℃ 冰箱。
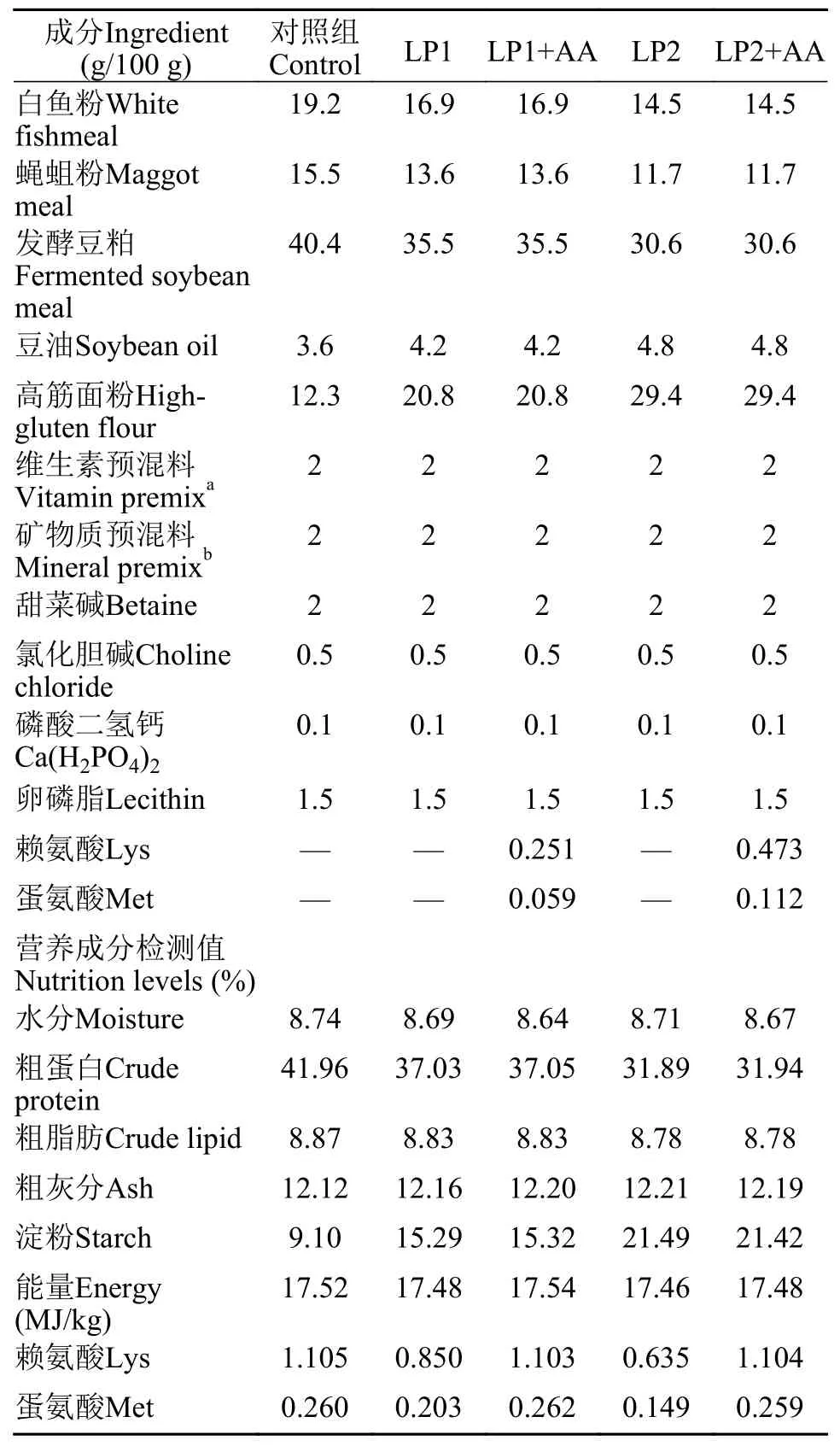
表 1 饲料配方及营养成分(干重)Tab. 1 Composition of diets (dry basis)
1.2 养殖实验和样品采集
杂交黄颡鱼“黄优 1 号”(Pelteobagrus fulvidraco, ♀×Pelteobagrus vachelli,♂)实验鱼来自湖北黄优源渔业发展有限公司鲁湖基地。养殖实验在华中农业大学水产基地的流水养殖系统中进行, 养殖缸容积为180 L。实验开始前, 所有实验鱼经过2周的暂养, 暂养期间投喂对照组饲料。随后将实验鱼随机分为5组, 每组设置3个重复, 每个重复有100尾实验鱼。分别等量投喂5组实验饲料(饲料配方见表 1), 投喂量为体重的 3%—5%, 每天分早晚2次投喂, 养殖时间为56d。养殖期间全程曝气, 水温23—29℃。
实验开始前, 测量实验鱼的初始体重与体长。实验结束时, 实验鱼禁食 24h 后以 MS-222 溶液麻醉, 计数并测量体重与体长。每个养殖缸随机捞取12 条鱼用于测定鱼体常规营养成分。其余实验鱼使用注射器尾静脉采血置于离心管中, 静置离心取上清液即为血清, 用于测定抗氧化酶指标, 之后解剖肝脏和内脏并称重。另取 6 条鱼(雌雄各 3 条)的下丘脑和垂体用于测定生长相关基因-生长激素(GH)、胰岛素样生长因子(IGF-1、IGF-2) mRNA的相对表达量, 肝脏用于测定抗氧化相关基因-超氧化物歧化酶(Cu/Zn-SOD和Mn-SOD)、过氧化氢酶(CAT)基因 mRNA 的相对表达量。
1.3 测定指标与计算方法
生长指标计算增重率(WGR, %)=100×(最终体重-初始体重)/初始体重
特定生长率(SGR, %/d)=100×(Ln最终体重-Ln初始体重)/时间
饲料系数(FCR)=饲料投喂量/(最终总体重-初始总体重)
存活率(SR, %)=100×最终尾数/初始尾数
脏体比(VSI)=100×内脏重/最终体重
肝体比(HSI)=100×肝脏重/最终体重
肥满度(CF, g/cm3)=100×体重/体长3
常规营养成分的测定常规营养成分测定分析方法: 105℃ 烘干法测定水分含量, 凯氏定氮法测定粗蛋白含量, 索氏抽提法测定粗脂质含量,马弗炉 550℃ 高温烧灼测定粗灰分含量。
转氨酶活性以及抗氧化酶活性的测定血清和肝脏中谷草转氨酶(AST)活性(C010-2-1)、谷丙转氨酶(ALT)活性(C009-2-1)、超氧化物歧化酶(SOD)活性(A001-3)、过氧化氢酶(CAT)活性(A007-1-1)、总抗氧化能力(T-AOC)(A015-2-1)、丙二醛(MDA)含量(A003-1)、活性氧(ROS)水平(E004-1)测定采用南京建成生物工程研究所的试剂盒, 具体测定方法见试剂盒说明书。
生长相关基因和抗氧化酶基因mRNA相对表达量变化下丘脑和垂体生长相关基因(GH、IGF-1、IGF-2)mRNA的相对表达量测定所需PCR引物参考马文阁[16]根据 NCBI公布的GH、IGF-2cDNA 序列及转录组测序测得的IGF-1cDNA 序列设计的相关荧光定量引物, 肝脏抗氧化酶基因(Cu/Zn-SOD、Mn-SOD、CAT)mRNA的相对表达量测定所需 PCR引物序列见下表 2。
1.4 统计分析
实验数据通过齐性检验后使用 SPSS Statistics 25 软件进行单因素方差分析, 通过 Duncan 检验分析实验结果的显著差异(P<0.05), 以平均值±标准差表示。
2 结果
2.1 低蛋白饲料添加赖氨酸与蛋氨酸对杂交黄颡鱼生长的影响
由表 3 可知: 与对照组相比, (1)LP1+AA 组与LP2+AA 组中, 杂交黄颡鱼的WGR与SGR均没有显著性差异(P>0.05); LP1 组杂交黄颡鱼WGR与SGR显著下降(P<0.05), 但与 LP1+AA 与 LP2+AA两组相比均没有显著性差异(P>0.05); LP2 组杂交黄颡鱼的WGR与SGR均显著低于其他4组(P<0.05); (2)LP1+AA 与 LP2+AA 两组的FCR均没有显著性差异(P>0.05), LP1 组的FCR显著高于对照组(P<0.05), 但与 LP1+AA 与 LP2+AA 两组均没有显著性差异(P>0.05), 而 LP2 组的FCR显著高于其他4组(P<0.05); (3)LP1、LP2 与 LP2+AA 三组的CF差异不显著(P>0.05), LP1+AA 组的CF显著高于其他4组(P<0.05); (4)LP1、LP1+AA、LP2、LP2+AA 四组HSI均无显著性差异(P>0.05), LP1、LP1+AA 两组HSI均显著低于 LP2 组与 LP2+AA组(P<0.05); (5)VSI差异均不显著(P>0.05)。
低蛋白饲料添加赖氨酸与蛋氨酸对杂交黄颡鱼生长相关基因表达变化的影响见图 1。由图 1 可知: 与对照组相比, (1)LP2 组与 LP2+AA 组下丘脑GH及垂体GH相对表达量均显著降低(P<0.05), 其余各组GH相对表达量均没有显著性差异(P>0.05);(2)LP2 组与 LP2+AA 组下丘脑IGF-1相对表达量显著降低(P<0.05), 其余各组以及垂体IGF-1相对表达量均没有显著性差异(P>0.05); (3)各组垂体IGF-2相对表达量均差异不显著(P>0.05)。

表 2 引物序列Tab. 2 Primer sequence

表 3 低蛋白饲料添加赖氨酸与蛋氨酸对杂交黄颡鱼生长性能的影响Tab. 3 Effect of supplementation of lysine and methionine in low-protein dietary on growth performance of juvenile yellow catfish hybrid
2.2 低蛋白饲料添加赖氨酸与蛋氨酸对杂交黄颡鱼体组成的影响
由表 4可知: 肌肉以及全鱼的水分、粗蛋白、粗脂肪、粗灰分等常规营养成分均差异不显著(P>0.05)。
2.3 低蛋白饲料添加赖氨酸与蛋氨酸对杂交黄颡鱼转氨酶活性的影响
由表 5 可知: (1)肝脏与血清中的 AST 活性均无显著性差异(P>0.05); (2)肝脏中 ALT 活性没有显著性差异(P>0.05); LP2 组血清中 ALT 活性显著高于对照组与 LP1+AA 组(P<0.05)。
2.4 低蛋白饲料添加赖氨酸与蛋氨酸对杂交黄颡鱼抗氧化能力的影响
由表 6 可知: (1)肝脏与血清 SOD 活性均无显著性差异(P>0.05)。(2)LP2 组肝脏 CAT 活性显著小于其他四组(P<0.05), LP1 组、 LP2 组及LP2+AA 组血清 CAT 活性显著小于对照组(P<0.05)。(3)LP1 组、LP2 组与 LP2+AA 组肝脏T-AOC 显著小于对照组和 LP1+AA 组(P<0.05)。(4)对照组与 LP1+AA 组肝脏 MDA 显著低于 LP2组(P<0.05), 与LP1 组、LP2+AA 两组相比均差异不显著(P>0.05); LP2 组血清 MDA 显著高于 LP1+AA 组(P<0.05), 但与对照组、 LP1 组、LP2+AA三组相比均没有显著性差异(P>0.05)。(5)LP1 组与LP2+AA 组肝脏和血清中ROS水平相对于对照组均没有显著性差异(P>0.05), 但显著低于 LP2 组与LP2+AA 组(P<0.05)。
低蛋白饲料添加赖氨酸与蛋氨酸对杂交黄颡鱼抗氧化酶相关基因表达变化的影响见图 2。由图 2可知: 与对照组相比, (1)LP1 组和LP1+AA 组肝脏中Cu/Zn-SOD、Mn-SOD、CATmRNA相对表达量均没有显著性差异(P>0.05); (2)LP2 组和LP2+AA组肝脏中Cu/Zn-SOD、CATmRNA相对表达量均显著降低(P<0.05)。

图 1 生长相关基因 GH、IGF-1、IGF-2 mRNA 的相对表达量Fig. 1 Relative expression of GH, IGF-1 and IGF-2 mRNA
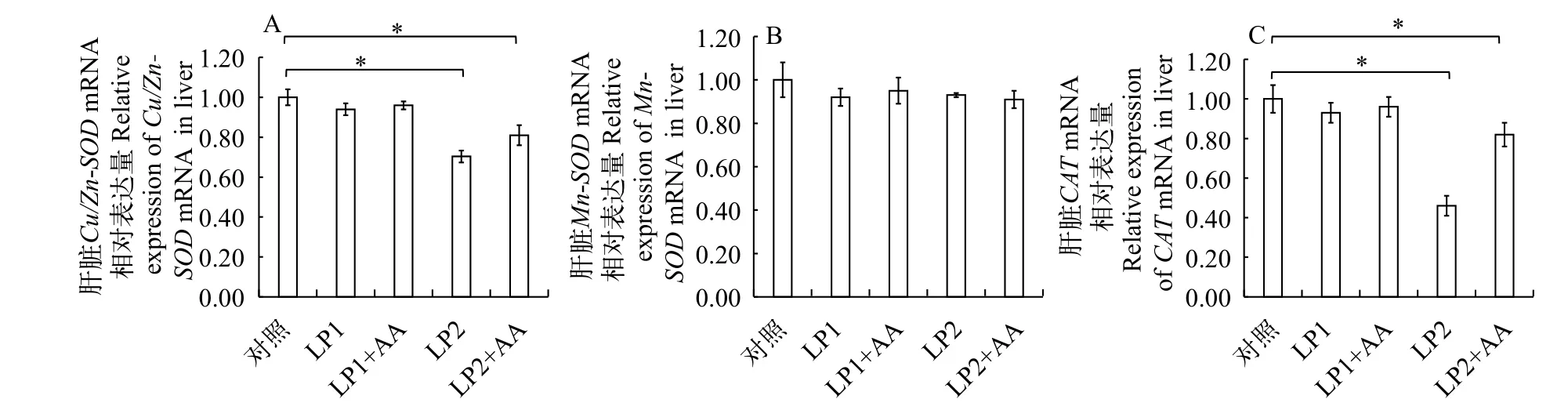
图 2 抗氧化酶相关基因 Cu/Zn-SOD、Mn-SOD、CAT mRNA 的相对表达量Fig. 2 Relative expression of Cu/Zn-SOD, Mn-SOD and CAT mRNA
3 讨论
3.1 低蛋白饲料添加赖氨酸与蛋氨酸对杂交黄颡鱼生长性能的影响
通过分析生长指标及生长相关基因(GH、IGF-1、IGF-2)相对表达量变化, 本实验结果表明:饲料中蛋白质含量的降低(LP1 组和LP2 组), 会降低杂交黄颡鱼的生长性能; 而在一定程度上低蛋白饲料补充赖氨酸与蛋氨酸(LP1+AA 组)后可以维持杂交黄颡鱼的生长性能。本实验结果与虹鳟(Oncorhynchus mykiss)、大口黑鲈(Micropterus salmoides)和军曹鱼(Rachycentron canadum)的研究结果较为相似, Gaylord和Barrows[17]的研究结果表明通过补充赖氨酸、蛋氨酸和苏氨酸的方式, 虹鳟鱼饲料粗蛋白含量可从 46% 降至 41.5%, 而不会影响虹鳟鱼的生长性能; 陈乃松等[2]和Li等[18]发现低蛋白饲料补足必需氨基酸, 不会导致大口黑鲈生长性能的下降; He等[19]也发现, 在低鱼粉饲料中补充蛋氨酸可以促进了军曹鱼的生长。研究者发现造成这一结果的原因主要是补充的赖氨酸和蛋氨酸等限制性氨基酸显著影响了鱼体内生长相关基因的表达及蛋白质代谢[17,19,20]。但在一项草鱼(Ctenopharyngodon idellus)中的研究发现, 通过对比草鱼的生长率, 粗蛋白含量 29% 未添加赖氨酸和蛋氨酸的饲料反优于粗蛋白含量 31% 的饲料以及粗蛋白含量 29% 并添加赖氨酸与蛋氨酸的饲料[21]。这可能是因为过度的提高饲料中蛋白质含量或者添加氨基酸导致鱼体代谢负荷增大, 反而降低了草鱼的生长性能。
在本实验中, 饲料粗蛋白含量为 42% 时, 杂交黄颡鱼幼鱼肝体比(HSI)为 1.77%; 饲料粗蛋白含量为 37% 时,HSI为 1.56%—1.57%; 饲料粗蛋白含量为 32% 时,HSI为 1.90%—2.02%。两种低蛋白水平的饲料(LP1 组与 LP2 组)与饲料粗蛋白含量为42%的对照组相比均没有显著性差异, 但是饲料粗蛋白含量 37% 的两个实验组(LP1 组与 LP1+AA组)杂交黄颡鱼幼鱼HSI显著低于饲料粗蛋白含量32% 的两个实验组(LP2 组与 LP2+AA 组), 这与其他研究者的结论有所不同。陈乃松等[2]的实验结果表明, 大口黑鲈的HSI与VSI受饲料蛋白质水平降低的影响呈现出先下降后上升的趋势, 但添加必需氨基酸并未使这两个指标呈现显著的不同。Gaylord和Barrows[17]发现添加氨基酸会导致虹鳟鱼HSI显著降低。而刘梦梅[21]的研究结果也表明, 低蛋白饲料添加氨基酸不会对影响草鱼的HSI, 与本实验结果较为一致。在本实验中,HSI在饲料粗蛋白含量37% 时(LP1 组和 LP1+AA 组)最低, 32% 时(LP2 组和 LP2+AA 组)最高, 可能粗蛋白含量为 37%的饲料不会对杂交黄颡鱼幼鱼的肝脏代谢产生负担。

表 4 低蛋白饲料添加赖氨酸与蛋氨酸对杂交黄颡鱼幼鱼肌肉与全鱼体组成的影响(干重)Tab. 4 Effect of supplementation of lysine and methionine in low-protein dietary on body composition in muscle and whole body of juvenile yellow catfish hybrid (dry basic)
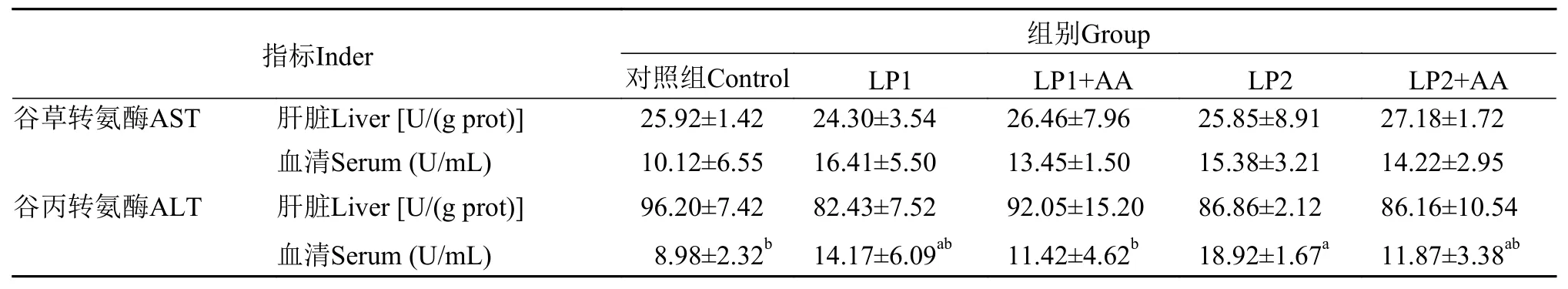
表 5 低蛋白饲料添加赖氨酸与蛋氨酸对杂交黄颡鱼幼鱼转氨酶活性的影响Tab. 5 Effect of supplementation of lysine and methionine in low-protein dietary on AST and ALT activity of juvenile yellow catfish hybrid
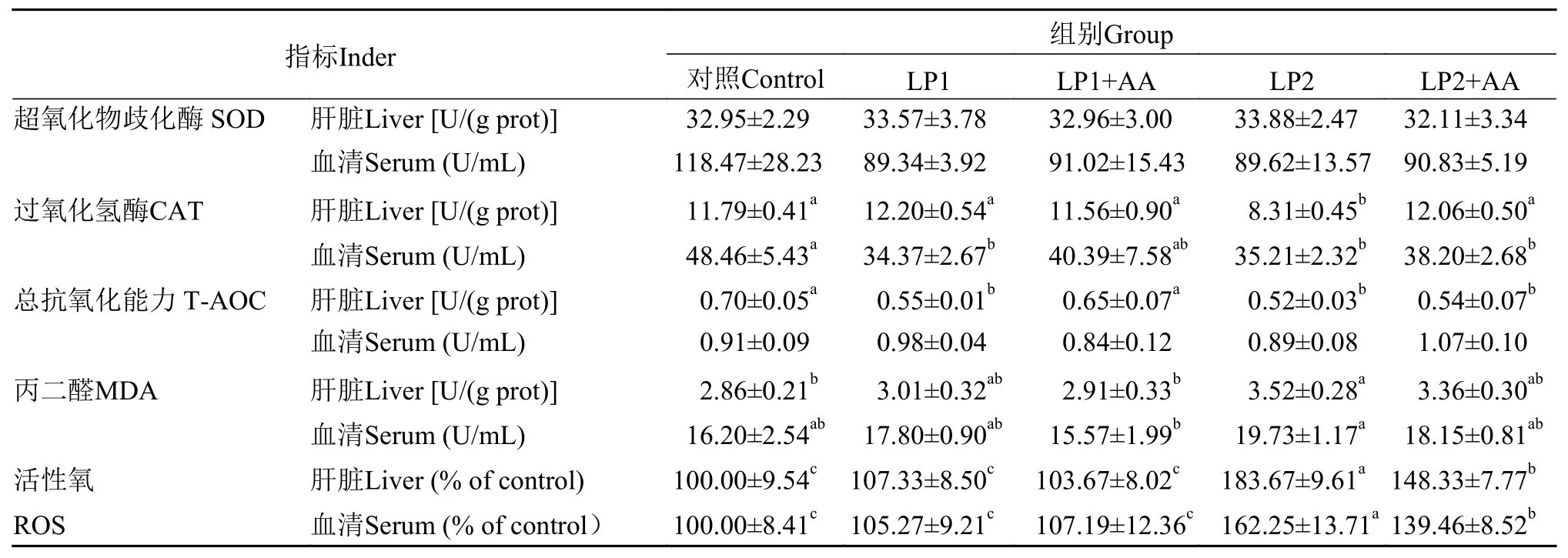
表 6 低蛋白饲料添加赖氨酸与蛋氨酸对杂交黄颡鱼幼鱼抗氧化能力的影响Tab. 6 Effect of supplementation of lysine and methionine in low-protein dietary on antioxidase ability of juvenile yellow catfish hybrid
3.2 低蛋白饲料添加赖氨酸与蛋氨酸对杂交黄颡鱼体组成的影响
在本实验中, 杂交黄颡鱼体组成的常规营养成分均没有显著性差异, 这与刘梦梅[21]在草鱼中的研究结果一致。但程小飞等[22]在湘华鲮(Sinilabeo decorus tungtingNichols)的研究中发现, 饲料蛋白水平不会对幼鱼全鱼粗蛋白造成显著性差异, 但是会显著影响肌肉中的粗蛋白含量。肌肉粗蛋白含量反映了鱼体的蛋白质沉积水平。本实验结果表明,低蛋白饲料添加赖氨酸与蛋氨酸没有对杂交黄颡鱼幼鱼的蛋白质沉积产生显著影响。
3.3 低蛋白饲料添加赖氨酸与蛋氨酸对杂交黄颡鱼转氨酶活性的影响
谷草转氨酶(AST)与谷丙转氨酶(ALT)是动物体内发挥氨基酸转运功能的两种重要的氨基酸转移酶, 在肝脏中含量较高, 当肝脏出现损伤时这两种酶会大量释放到血清中, 造成血清的转氨酶活性升高[23—25]。因此, 可以用其评价肝脏的健康状况[26]。在本实验中, 肝脏与血清中的 AST 活性均没有显著性差异, 降低饲料中 10% 蛋白质含量的实验组(LP2 组)幼鱼血清中 ALT 活性显著高于粗蛋白含量 42% 的对照组与降低饲料中 5% 蛋白质含量并添加蛋氨酸和赖氨酸的实验组(LP1+AA 组)。这一结果与郭凯等[27]在荷斯坦公牛(Holstein Friesian)的研究结果相似, 日粮中蛋白质含量的降低会导致荷斯坦公牛血清中 ALT 活性升高。但余含等[28]在鳙(Hypophthalmichthys nobilis)的研究中发现, 提高饲料中蛋白质含量, 血清 ALT 活性也会随之提高, 这可能是由于过高的蛋白质含量导致鱼体代谢负荷增大, 引起了肝脏损伤。同时, 在本实验中, 低蛋白饲料中补充蛋氨酸与赖氨酸会降低实验鱼血清中ALT 活性, 与张庆功等[29]在红鳍东方鲀(Takifugu rubripes)中的研究结果相似, 向低蛋白饲料中补充赖氨酸与蛋氨酸, 可以降低血清 ALT 的活性。本实验结果说明, 饲料中蛋白质含量过低时, 肝脏代谢发生异常, 可能影响肝脏功能; 降低饲料蛋白的同时补充蛋氨酸与赖氨酸可以避免鱼体肝脏代谢发生异常。
3.4 低蛋白饲料添加赖氨酸与蛋氨酸对杂交黄颡鱼幼鱼抗氧化能力的影响
在正常情况下, 生物体内一致维持着活性氧(ROS)的产生与清除, 并且两者处于动态平衡状态[30]。当抗氧化能力降低时可导致生理代谢功能紊乱, 生成大量的自由基, 发生脂质过氧化, 造成组织损伤。SOD 和 CAT 是生物体抗氧化防御系统重要的功能酶, 可以清除体内活性氧自由基, 减轻脂质过氧化损伤[31,32]。SOD与CAT活性的增加可视为生物体为减轻脂质过氧化损伤对新陈代谢所作出的适应反应[33]。MDA 是脂质过氧化的主要产物, 可反映生物体内脂质过氧化强弱, 间接反映氧化损伤的程度, 其含量越高表明损伤越严重[34,35]。T-AOC的大小反映了机体抗氧化酶系统和非酶系统对外来刺激的代偿能力及自由基代谢的状态。在本实验中, 与对照组饲料相比, 降低饲料蛋白质含量(LP1 组和LP2 组)均会导致肝脏和血清中的抗氧化酶(CAT和T-AOC)活性及肝脏中抗氧化酶相关基因Cu/Zn-SOD、CATmRNA的相对表达量降低, 肝脏和血清中MDA含量和ROS水平显著增高; 饲料中补充赖氨酸与蛋氨酸后可以使肝脏和血清中抗氧化酶活性(CAT和T-AOC)及肝脏中抗氧化酶相关基因(Cu/Zn-SOD、CATmRNA)的相对表达量升高,肝脏和血清中MDA 含量和ROS水平降低。本实验结果与鲤(Cyprinus carpio)[36]、鳙[28]和肉鸡(Gallus gallus domesticus)[37]中的研究结果相似。低蛋白饲料在补充氨基酸后(LP1+AA 组和 LP2+AA 组)杂交黄颡鱼幼鱼抗氧化能力增强, 降低了ROS的生成,从而可以减弱鱼体内的脂质过氧化损伤。但是, 降低饲料中 10% 蛋白质含量并补充赖氨酸和蛋氨酸(LP2+AA 组)仍然造成了肝脏中 T-AOC 以及血清中 CAT 活性的显著降低、肝脏和血清中 ROS 水平显著升高及肝脏中抗氧化酶相关基因(Cu/Zn-SOD、CAT)mRNA相对表达量的显著降低, 可见补充蛋氨酸和赖氨酸无法消除饲料蛋白质含量降低10% 带来的负面影响。
4 结论
饲料粗蛋白含量 37%(降低 5%)与 32% (降低10%)均会对杂交黄颡鱼的生长性能及抗氧化能力造成负面影响; 粗蛋白含量 37%(降低 5%)并补充赖氨酸和蛋氨酸不会对杂交黄颡鱼的生长性能及抗氧化能力造成显著性影响。因此, 我们建议在饲料生产中可以通过补充氨基酸适当降低饲料中的蛋白质含量。
