金沙江中下游圆口铜鱼遗传多样性与种群历史动态分析
2022-01-20何勇凤朱永久龚进玲朱挺兵吴兴兵李学梅孟子豪杨德国
何勇凤 朱永久 龚进玲 朱挺兵 吴兴兵 李学梅 孟子豪 杨德国
(中国水产科学研究院长江水产研究所, 农业农村部淡水生物多样性保护重点实验室, 武汉 430223)
金沙江是长江上游干流的一段, 起自青海省玉树巴塘河口, 至四川省宜宾岷江口止, 全长约2290 km,约占长江上游干流河长的2/3, 总落差3333 m, 平均比降1.45‰, 水量丰沛, 集水面积36.2×104km2, 约占长江上游流域面积的36%[1]。自青海省玉树巴塘河口至云南省丽江石鼓为金沙江上段, 河长约984 km,平均比降为1.75‰, 从石鼓至四川省攀枝花市为金沙江中段, 河长约546 km, 平均比降为1.48‰, 从攀枝花市至四川宜宾岷江口为金沙江下段, 河长约783 km, 平均比降为0.93‰[2]。金沙江由青藏高原边缘地区向四川盆地边缘地区进行过渡, 跨越中国地势的第一大阶梯和第二大阶梯, 河流情势多变,比降大, 生境异质性高, 孕育了丰富的鱼类资源, 据调查统计金沙江流域共分布有鱼类200种[2]。金沙江水能资源非常丰富, 理论蕴藏量占长江总量的45.25%, 是国家规划的13个重要能源基地之一, 在我国能源资源建设中具有重要的战略地位。金沙江上游江段规划有7个梯级水电站, 从上而下依次是岗托、波罗、叶巴滩、拉哇、巴塘、苏洼龙和昌波水电站, 其中苏洼龙水电站已建成蓄水, 叶巴滩水电站正在修建中, 其余电站均尚未开工建设;金沙江中游江段规划有10个梯级水电站, 从上而下依次是龙盘、两家人、梨园、阿海、金安桥、龙开口、鲁地拉、观音岩、金沙和银江水电站, 其中梨园、阿海、金安桥、龙开口、鲁地拉和观音岩等6个水电站已建成蓄水发电, 金沙水电站已实现三期截流, 银江水电站正在修建中, 龙盘和两家人2个水电站尚未开工建设; 金沙江下游江段规划有4个梯级水电站, 从上而下依次是乌东德、白鹤滩、溪洛渡和向家坝水电站, 其中乌东德、溪洛渡和向家坝水电站已建成蓄水发电, 白鹤滩水电站正在修建中。金沙江大规模的水电建设显著影响了水生生态环境, 大坝阻隔使原本急流险滩的河流环境变成了静水缓流的河道型水库环境, 水文条件发生巨大改变, 这无疑都使原有的鱼类区系及分布格局发生明显改变, 尤其对适合急流生活、产漂流性卵的鱼类如圆口铜鱼[Coreius guichenoti(SauvageetDabry)]等产生巨大影响。
圆口铜鱼隶属于鲤形目(Cypriniformes)、鲤科(Cyprinidae)、鮈亚科(Gobioninae)、铜鱼属(Coreius), 主要分布于长江上游干流及雅砻江、乌江等大型支流中, 是典型的河道洄游性鱼类和产漂流性卵鱼类, 也是长江上游特有鱼类和重要的经济鱼类[3—5],其产卵场仅发现于金沙江中下游以及雅砻江干流下游[6—8]。但近些年来, 由于长期的过度捕捞、无节制的资源掠夺和长江上游梯级水电开发的逐步实施, 圆口铜鱼完成生活史的通道因筑坝截流而被阻, 其产卵场环境遭受毁灭性破坏, 其种群资源已呈现明显的下降趋势[9—11], 其物种生存与延续面临巨大的威胁,2007年已被列入农业部《国家重点保护经济水生动植物资源名录(第一批)》中, 2015年更是被环境保护部和中国科学院联合发布的《中国生物多样性红色名录——脊椎动物卷》评估为极度濒危物种。目前关于圆口铜鱼的研究主要涉及生物学、资源量、栖息地、驯养繁殖与性腺发育、营养与疾病防治、应激、能量代谢、亲子鉴定和遗传多样性等方面[7,12—26],其中关于圆口铜鱼遗传多样性的研究, 内容包括微卫星标记筛选、部分江段(如雅砻江金河江段、金沙江观音岩江段、攀枝花江段、巧家江段、永善江段、屏山江段、宜宾江段、长江上游重庆江段、三峡库区江段和长江中游宜昌江段)群体的遗传多样性评估等[20—26]。然而, 针对金沙江中游江段的圆口铜鱼群体尚未有任何研究报道。
因此, 在金沙江中下游已修建十二级水电工程的背景下, 本研究以圆口铜鱼野生样本为实验材料,重点针对金沙江中下游江段尚有分布的4个群体进行线粒体Cytb基因和COⅠ基因测序, 分析圆口铜鱼金沙江中下游不同地理群体的遗传多样性、群体分化以及种群历史动态等, 以期为金沙江圆口铜鱼的种群遗传管理和资源保护提供科学依据。
1 材料与方法
1.1 实验材料
于2017—2019年对金沙江中下游干流江段圆口铜鱼的分布进行野外调查, 共采集到393尾样本,其中金安桥群体153尾、龙开口群体124尾、巧家群体101尾和屏山群体15尾。样本经现场测量全长、体长和体重等基础生物学信息后(表 1), 剪取鳍条, 采用无水乙醇进行固定保存。样本分布图见图 1。
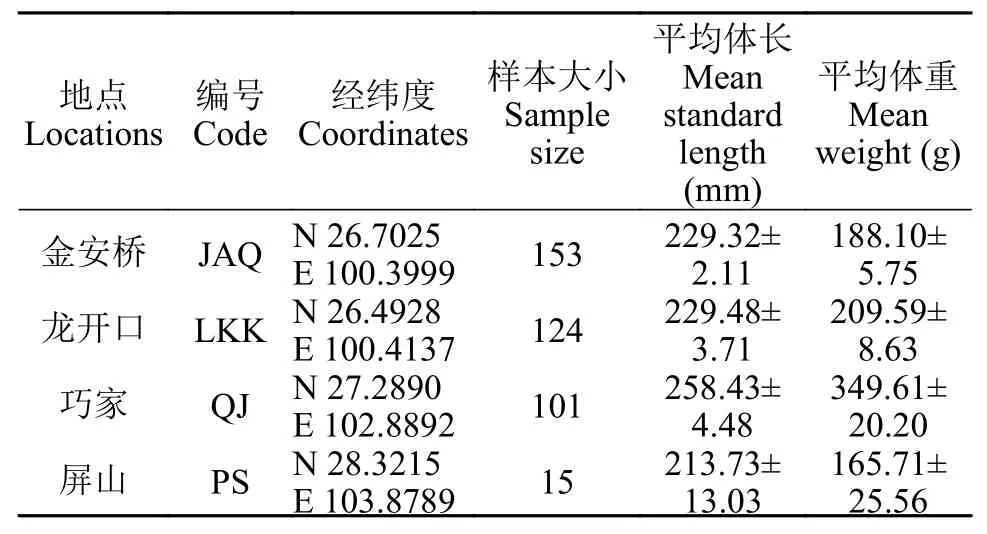
表 1 金沙江中下游圆口铜鱼样本采集信息Tab. 1 Sampling information of Coreius guichenoti in the middle and lower reaches of the Jinsha River
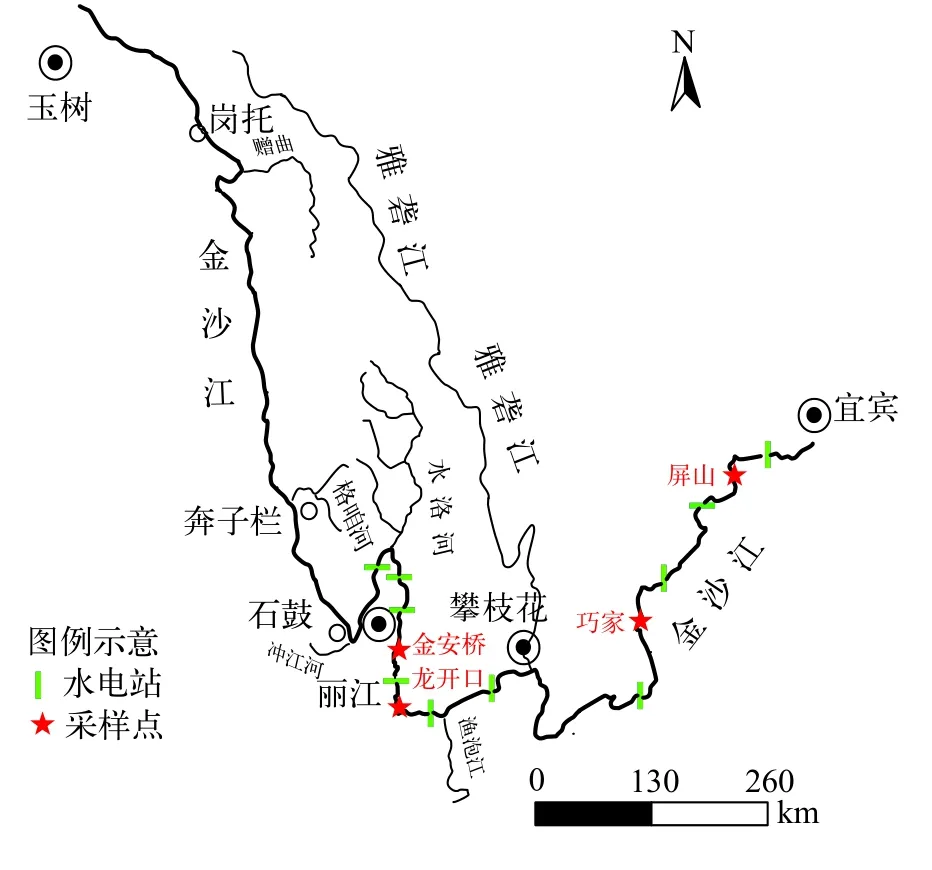
图 1 金沙江中下游圆口铜鱼样本采集地点Fig. 1 Map of sample locations for Coreius guichenoti in the middle and lower reaches of the Jinsha River
1.2 基因组DNA提取、PCR扩增及测序
采用Omega Bio-Tek公司的Tissue DNA Kit(D3396)试剂盒提取圆口铜鱼样本基因组DNA, 采用2%琼脂糖凝胶电泳检测其浓度和完整性, 于-20℃保存。Cytb基因扩增和测序引物为L14724(5′-gACTTgAAAAACCACCgTTg-3′)和H15915(5′-CTCCgATCTCCggATTACAAgAC-3′)[27],COⅠ基因扩增和测序引物为COⅠ-F(5′-TCAACCAACCA CAAAgACATTggCAC-3′)和COⅠ-R(5′-TAgAC TTCTgggTggCCAAAgAATCA-3′)[28]。PCR反应总体积为30 μL, 反应体系包括: 2×PowerTaqPCRMasterMix 15 μL, 基因组DNA 1 μL, 引物各1 μL (10 mmol/L), 灭菌ddH2O 12 μL。PCR反应条件为: 95℃预变性5min; 95℃变性30s, 58℃退火30s, 72℃延伸1min,共35个循环; 最后72℃延伸5min。PCR产物采用1%琼脂糖凝胶拍照检测目的片段, 成功后将PCR产物送武汉天一辉远有限公司完成纯化、测序与拼接。
1.3 数据分析
测序所得序列使用DNASTAR软件包中的Seq-Man编辑首尾两端噪音序列至同样长度。同时, 为了获得更多的变异信息, 合并了两个线粒体基因Cytb和COⅠ的串联序列用于后续分析。采用MEGA 6.0[29]进行序列比对和校正, 统计碱基组成, 并采用Kimura双参数模型进行谱系分支内部与分支之间遗传距离的计算。采用DnaSP v6软件计算群体变异位点(Variable sites)、单一突变位点(Singleton variable sites)、简约信息位点(Parsimony-informative sites)、单倍型多样性(Haplotype diversity)和核苷酸多样性(Nucleotide diversity)等[30]。
利用PopART软件(http://popart/otago.ac.nz)以中接法(Median-joining)构建单倍型网络关系图[31],分析单倍型之间的进化关系。采用PhyloSuite软件[32]中最大似然法(Maximum likelihood, ML)和贝叶斯法(Bayesian inferences, BI)构建圆口铜鱼分子系统发育树, 其中ML法建树时运行10000次bootstrap,BI法建树时运行200万代。
使用Arlequin 3.5软件[33]中的分子方差分析(Analysis of Molecular Variance, AMOVA)估算群体遗传距离和遗传变异的分布, 计算群体遗传分化指数Fst。同时, 采用贝叶斯聚类分析(Bayesian Analysis of Population Structure)BAPS 6.0软件[34]中“Clustering with linked loci”对圆口铜鱼393个个体的线粒体串联基因序列进行聚类分析, 设置潜在种群K值为2—10的整数值, 并且分别重复计算10次,迭代次数1000次, 确定聚类关系。
使用Arlequin3.5软件计算错配分布(mismatch distribution)[35]、Tajima’sD[36]和Fu’sFs值[37]来检验群体历史上是否经历扩张, 通过偏差平方和(Sum of Squared deviation, SSD)和粗糙指数(Harpending’s Raggedness index,Hri)来检测核苷酸不配对分布与种群扩张模型下期望分布之间的拟合优度。采用BEAST v1.10.4软件[38]对串联基因序列进行种群历史动态的Bayesian skyline plot(BSP)分析, 利用Tracer v1.7.1软件进行构图[39], 最佳碱基替换模型为HKY+I+G模型, 分子钟模型采用strict clock, 鱼类线粒体DNA基因序列的突变率采用1%/百万年[40,41],估算圆口铜鱼不同谱系分支的分化时间。
2 结果
2.1 基因序列变异分析
本研究共获得393尾圆口铜鱼的线粒体Cytb基因(GenBank登录号: MW045220—MW045310)和COⅠ基因序列(GenBank登录号: MW094040—MW094130)。在序列两端截齐后, 共获得: (1)1140 bp的Cytb序列, 变异位点56个, 其中单一突变位点19个, 简约信息位点37个, 平均碱基组成: A=29.3%、T=29.7%、C=27.0%、G=14.0%, A+T的含量(59.0%)高于G+C的含量(41.0%), 平均转换/颠换值为9.44, 界定了60个单倍型; (2)680 bp的COⅠ序列,变异位点20个, 其中单一突变位点5个, 简约信息位点15个, 平均碱基组成: A=26.1%、T=29.9%、C=25.8%、G=18.1%, A+T的含量(56.0%)高于G+C的含量(43.9%), 平均转换/颠换值为4.81, 界定了27个单倍型; (3)两个基因序列中碱基G的含量均最低, 尤其在密码子第三位的含量最低, 碱基组成表现出了明显的AT偏好和反G偏倚, 符合脊椎动物线粒体DNA基因的共同特性; (4)串联后的线粒体基因序列, 界定了91个单倍型。
2.2 单倍型多样性和核苷酸多样性
基于2个基因的串联序列(表 2), 估算金沙江中下游野生圆口铜鱼的单倍型数目介于6—55, 单倍型多态性介于0.838 (±0.061)—0.960 (±0.005), 核苷酸多态性介于0.00426 (±0.00023)—0.00519 (±0.00009)。从不同地理群体来看, 金安桥群体的单倍型数目、单倍型多样性和核苷酸多样性均是最高的, 屏山群体的单倍型多样性和巧家群体的核苷酸多样性均是最低的。
从单倍型分布来看, 全部群体的共享单倍型为4个, 如单倍型Hap4、Hap5、Hap12和Hap40, 而其中2—3个群体的共享单倍型数目为21个。从独有单倍型来看, 4个野生群体均分布有独有单倍型, 如金安桥群体和龙开口群体分布的独有单倍型数目分别为32个和17个, 巧家群体分布有16个独有单倍型, 屏山群体仅分布有1个独有单倍型(表 2)。
2.3 系统发育关系
以铜鱼(Coreius heterodon, GenBank登录号:NC_020042.1)为外类群, 应用最大似然法(ML)和贝叶斯法(BI)构建圆口铜鱼91个线粒体Cytb和COⅠ串联基因序列单倍型之间的系统发育树。结果显示, 2种方法分析得到的系统发育树拓扑结构基本一致, 所有单倍型聚为一个单系, 但在系统树上并不按照地理分布聚类, 存在多岐分支(图 2)。串联基因序列单倍型进化网络关系图显示, 圆口铜鱼线粒体DNA单倍型的网络进化关系呈星状分布,Hap12属于较原始单倍型和进化中心, 不存在显著的地理分布格局, 但呈现出3个较明显的单倍型谱系分支(Clade 1、Clade 2和Clade 3; 图 3), 每个谱系分支均涉及4个不同地理群体, 系统发育树上也得到相应的支持。Clade 1包括36个单倍型172个个体(占所有样本的43.7%), 其中金安桥JAQ群体、龙开口LKK群体、巧家QJ群体和屏山PS群体分别占该分支所有个体的比例为29.1%、40.1%、27.3%和3.5%; Clade 2包括27个单倍型106个个体(占所有样本的27.0%), 其中金安桥JAQ群体、龙开口LKK群体、巧家QJ群体和屏山PS群体分别占该分支所有个体的比例为41.5%、23.6%、32.1%和2.8%; Clade 3包括28个单倍型115个个体(占所有样本的29.3%),其中金安桥JAQ群体、龙开口LKK群体、巧家QJ群体和屏山PS群体分别占该分支所有个体的比例为51.3%、26.1%、17.4%和5.2%。其中分支Clade 1、Clade 2和Clade 3的内部遗传距离均为0.002, 分支Clade 1与Clade 2、Clade 3之间的遗传距离分别为0.006和0.009, Clade 2 和Clade 3之间的遗传距离为0.008。经估算, 出现Clade 1谱系分支的时间大约在3.66 Ma, 出现Clade 2和Clade 3谱系分支的时间大约在2.93 Ma。
2.4 群体遗传结构
基于串联基因序列, BAPS分析结果显示圆口铜鱼所有个体聚为3支更为合适(图 4), 此时log(marginal likelihood, ML)值为-2213.8949。
AMOVA分析结果显示, 在不分组的情况下圆口铜鱼线粒体DNA的遗传变异主要来自地理群体内的遗传变异(占96.62%), 地理群体间的遗传变异较小, 仅占3.38%; 在分成3个单倍型谱系分支的组别情况下, 圆口铜鱼线粒体DNA的遗传变异主要来自谱系分支之间(占81.29%), 谱系分支内部的遗传变异仅为18.71%(表 3)。圆口铜鱼不同地理群体两两之间的遗传分化指数(Fst)范围为-0.008—0.045(表 4), 所有群体间Fst值均小于0.05, 而且除屏山群体与其他群体间Fst值未达到显著水平外, 其余两两群体间Fst值均达到显著水平(P<0.05)。针对3个不同谱系分支, 两两之间的Fst值均大于0.25, 其中谱系Clade 1与Clade 2、Clade 1与Clade 3、Clade 2与Clade 3之间的Fst值分别为0.759、0.847和0.805, 均达到显著水平(P<0.001)。
2.5 种群历史动态分析
核苷酸错配分析发现, 所有地理群体均呈现多峰分布(表 5)。除圆口铜鱼屏山群体外,SSD和Hri检验结果显示其他地理群体均未显著偏离群体扩张模型(P>0.05)。中性检验结果显示, 所有地理群体的Tajima’sD值均未达到显著水平(P>0.05);Fu’sFs检验结果显示, 圆口铜鱼混合群体和金安桥群体均呈现显著负值(P<0.02), 龙开口群体和巧家群体均呈现不显著负值(P>0.02)。
BSP分析了有效种群大小随溯祖时间的动态变化曲线, 结果显示除屏山群体未检测到明显的种群扩张现象外, 其他群体均在0.0004—0.0007 Ma期间存在扩张现象(图 5)。
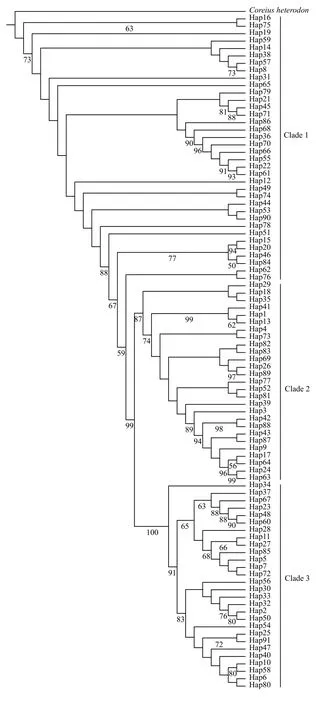
图 2 基于串联基因序列的圆口铜鱼单倍型间的ML系统发育树Fig. 2 Maximum likelihood (ML) phylogenetic tree of Coreius guichenoti based on concatenated haplotype sequences of gene Cyt b and COⅠ
3 讨论
3.1 金沙江中下游圆口铜鱼的遗传多样性和种群分化
单倍型多样性和核苷酸多样性是衡量一个物种群体DNA变异程度的重要指标, 也是评价种群遗传多样性的重要指标。在本研究中, 金沙江中下游江段圆口铜鱼的单倍型多样性和核苷酸多样性分别为0.936和0.00489, 不同地理群体之间差异不明显, 这2个多样性指标分别处于≥0.5、<0.5%的水平[42], 即高单倍型多样性和低核苷酸多样性水平,表明金沙江中下游江段圆口铜鱼历史上可能受瓶颈效应影响后种群数量发生了迅速扩张。与袁希平等[22]针对长江干流川江段圆口铜鱼开展了线粒体控制区序列研究结果相比, 在本研究中金沙江中下游江段圆口铜鱼单倍型多样性处于与长江干流川江段相似水平, 而核苷酸多样性则比宜宾江段(0.0083)要低, 与其他江段相比则处于相似水平; 与Cheng等[25]金沙江屏山江段圆口铜鱼COⅠ基因序列研究结果相比, 本研究中圆口铜鱼屏山群体的单倍型多样性和核苷酸多样性都要高。与同属的铜鱼(Coreius heterodon)[22]相比, 本研究中金沙江中下游江段圆口铜鱼核苷酸多样性和单倍型多样性稍高; 与同亚科的鱼类相比, 圆口铜鱼的单倍型多样性与蛇鮈(Saurogobio dabryi)类似, 比银鮈(Squalidus argentatus)、花䱻(Hemibarbus maculatus)和棒花鱼(Abbottina rivularis)要高, 圆口铜鱼的核苷酸多样性与银鮈类似, 比蛇鮈和花䱻要低, 比棒花鱼要高得多[43]; 而与同为鲤科非同一个亚科的鱼类相比, 圆口铜鱼与赤水河半䱗(Hemiculterella sauvagei)[44]的核苷酸多样性和单倍型多样性水平相似, 比嘉陵裸裂尻鱼(Schizopygopsis kialingensis)[45]的核苷酸多样性稍低, 单倍型多样性则稍高。总体而言, 金沙江中下游的圆口铜鱼处于高单倍型多样性和低核苷酸多样性的模式。

表 2 金沙江中下游圆口铜鱼不同群体的遗传多样性信息Tab. 2 Genetic diversity of Coreius guichenoti at different locations of the middle and lower reaches of the Jinsha River based on the concatenated sequences of gene Cyt b and CO I
Balloux和Lugon-Moulin认为当Fst值在 0—0.05时, 表示低等水平的遗传分化; 当在 0.05—0.15时, 表示中等水平的遗传分化; 当在 0.15—0.25时,表示高度的遗传分化; 当大于0.25时, 表示极大的遗传分化[46]。本研究中金沙江中下游圆口铜鱼不同地理群体间的遗传分化指数均小于0.05, 处于低等分化水平。这表明, 金沙江中下游水域的圆口铜鱼尚未出现明显的地理分布格局, 这可能与圆口铜鱼产漂流性卵等生活史特征有关, 尽管目前金沙江中下游已被梯级水电站的大坝阻隔形成多个小生境, 但由于阻隔年限尚短, 尚不足以引起圆口铜鱼不同地理群体的遗传分化。金沙江中下游水域的圆口铜鱼虽未出现明显的地理分布格局, 但不同地理群体内部均分布有自己独有的单倍型, 如基于串联基因序列分析时, 金安桥群体、龙开口群体、巧家群体和屏山群体的独有单倍型数占各自群体内总单倍型数的比例分别为58.2%、43.6%、47.1%和16.7%。因此, 需要注意的是, 目前圆口铜鱼金沙江中下游不同地理群体间的遗传分化低并不意味着分化程度可以被忽视, 由于大坝阻隔带来的长期效应在进化史上将会对金沙江中下游圆口铜鱼造成巨大的影响, 必须时刻关注。

表 3 金沙江中下游圆口铜鱼的分子方差分析Tab. 3 Analysis of molecular variance analysis among locations of Coreius guichenoti from the middle and lower reaches of the Jinsha River based on the concatenated sequences of gene Cyt b and CO Ⅰ

表 4 基于串联序列金沙江中下游圆口铜鱼不同地理群体的遗传分化系数(Fst)Tab. 4 Pairwise Fst values among different locations of Coreius guichenoti from the middle and lower reaches of the Jinsha River based on the concatenated sequences of gene Cyt b and COⅠgenes

表 5 金沙江中下游圆口铜鱼不同地理群体的中性检验和错配分析Tab. 5 Neutrality tests and mismatch distribution values for all locations of Coreius guichenoti from the middle and lower reaches of the Jinsha River based on the concatenated sequences of gene Cyt b and COⅠgenes
另一方面, 从BAPS分析、分子系统发育树和单倍型网络关系图等均可以看出, 金沙江中下游江段圆口铜鱼呈现出3个明显的线粒体DNA单倍型谱系分支, 这也得到了AMOVA和Fst分析结果的支持。而且不管样本量的多少, 各个不同地理群体内部均同时存在3个谱系分支, 只是各分支在不同群体内所占比例稍有差异。其中, 金安桥群体中3个谱系分支所占比例相差不多, Clade 1、Clade 2和Clade 3分别占32.7%、28.7%和38.6%; 龙开口群体和屏山群体中均是谱系分支Clade 1和Clade 3占大多数, 分别占79.8%和80%; 而巧家群体则是谱系分支Clade 1和Clade 2占大多数, 为80.2%。总的来说,在圆口铜鱼进化过程中, Clade 1为较原始谱系, 由Clade 1逐渐衍射出两个谱系分支Clade 2和Clade 3,且3个谱系分支之间已呈现极大的遗传分化水平。

图 3 基于串联基因序列的圆口铜鱼单倍型进化网络关系图Fig. 3 The haplotype network of Coreius guichenoti based on the concatenated haplotype sequences of gene Cyt b and COⅠ

图 4 基于联合基因Cyt b和COⅠ序列的圆口铜鱼BAPS聚类分析结果图Fig. 4 Bayesian analysis of population structure of Coreius guichenoti based on clustering with linked loci for both Cyt b and COⅠ gene.Each color represents a separate genetic cluster, and each bar represents an individual
事实上, 关于圆口铜鱼野生群体的遗传多样性和遗传分化水平已开展诸多研究, 但大部分研究均基于微卫星标记开展[20,21,23,24,26], 仅有袁希平等[22]针对长江干流川江段圆口铜鱼开展了线粒体控制区序列和微卫星标记双重分析, 以及Cheng等[25]针对金沙江屏山江段圆口铜鱼开展了COⅠ基因序列分析。这些研究涉及的样本来源江段主要包括金沙江观音岩江段、攀枝花江段、巧家江段、永善江段和屏山江段、长江干流川江段、长江中游宜昌江段、雅砻江金河江段等, 均不涉及本研究中的金安桥群体和龙开口群体。这些研究结果显示出不同江段圆口铜鱼野生群体的遗传多样性水平均较高, 但均未出现明显的地理种群分化, 这也和本研究的结果是基本一致的。
3.2 金沙江中下游圆口铜鱼的种群历史动态
在种群历史动态分析中涉及诸多方法, 如Tajima’sD值和Fu’sFs值等中性检验方法、核苷酸错配分布情况、SSD和Hri检验、BSP图等。在一般情况下, 核苷酸错配分布呈现光滑单峰, 且SSD和Hri检验未显著偏离种群扩张模型, Tajima’sD值和Fu’sFs值呈显著负值时, 被认为种群在历史上有扩张迹象[35—37,47,48]。尽管从不同地理群体来看, 在本研究中种群历史动态分析各方法的结果稍有差异。但总体来说, 除屏山群体外, 圆口铜鱼金沙江中下游金安桥群体、龙开口群体、巧家群体和混合群体在近期均可能发生过扩张迹象。因此, 圆口铜鱼金沙江中下游群体在近期是可能发生过种群扩张的。
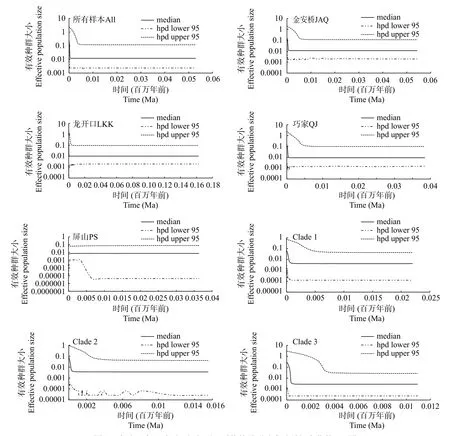
图 5 金沙江中下游圆口铜鱼不同群体的种群动态随时间变化的BSP图Fig. 5 Bayesian skyline plots (BSP) for population dynamics with time of Coreius guichenoti in the middle and lower reaches of the Jinsha River实线表示平均值, 虚线表示95%置信区间上限, 双点划线表示95%置信区间下限Solid lines indicate median values, dotted lines indicate 95% upper confidence interval, and long dash double dotted lines indicate 95%lower confidence interval
研究表明, 冰川演化在金沙江河谷形成中发挥了重要作用, 其中经历了最重要的4次冰期分别为中更新世早期的玉龙冰期(0.7—0.6 Ma)、中更新世中期的干海子冰期(0.53—0.45 Ma)、中更新世晚期的丽江冰期(0.31—0.13 Ma)和晚更新世中晚期的大理冰期(0.12—0.01 Ma)[49], 还经历了全新世的现代小冰川时期(0.01—0 Ma)[50]。通过估算获得圆口铜鱼不同群体发生扩张的时间约在0.0004—0.0007 Ma左右, 即14—17世纪左右, 处于全新世的现代小冰川时期, 是距今最近一次冰川频繁波动的时期[50]。圆口铜鱼3个不同线粒体DNA谱系分支的分化时间大约在3.66—2.93 Ma, 处于青藏高原隆起, 鹤庆等盆地下陷时期。晚更新世以来, 受气候冷暖变化和冰川作用等影响, 金沙江河谷发育经历了“下切-滑坡-堰塞-堆积-下切”等复杂过程, 冰川退缩, 河流逐渐发育成不同阶地[51], 从而对河流中的生物种群的进化产生影响。因此, 结合本研究圆口铜鱼金沙江中下游群体发生扩张的估算时间等信息, 说明全新世小冰川时期冰川的演化和青藏高原隆升在金沙江圆口铜鱼种群历史动态方面发挥了重要影响作用。
3.3 金沙江圆口铜鱼的保护
鱼类种群遗传结构和谱系系统地理格局的研究可为物种保护和管理措施的制定提供科学依据。本研究结果表明, 金沙江中下游圆口铜鱼的单倍型多样性水平总体较为丰富, 但核苷酸多样性水平较低。近些年来, 由于受人类活动的影响, 圆口铜鱼的野生资源量衰退严重, 而且随着金沙江中下游梯级水利工程的修建完成, 其栖息地被片段化,栖息环境被破坏, 洄游通道被阻断, 其受威胁程度将会持续加剧。目前, 已有多个水电工程将圆口铜鱼列为增殖放流对象, 多家科研单位对圆口铜鱼人工驯养与繁殖技术开展攻关研究, 并取得了突破性进展。增殖放流工作一旦开展, 势必会对自然种群的遗传管理产生影响。因此, 为了更好地保护圆口铜鱼资源, 应给予金沙江中下游圆口铜鱼3个线粒体DNA谱系分支特别关注, 后续可在增加该物种的生物学特征和核基因多样性等数据的基础上, 综合分析后确立金沙江中下游圆口铜鱼的进化显著单元(Evolutionarily Significant Units, ESUs)和管理单元(Management Units, MUs)等保护单元。目前, 在进行增殖放流时, 应提前做好亲鱼和放流仔鱼个体的遗传背景档案的建立, 有助于更好的管理圆口铜鱼自然种群的遗传多样性。同时, 还应加强对养殖圆口铜鱼线粒体DNA序列的检测, 建立亲鱼和子代线粒体DNA基因库, 便于采用来自不同谱系分支的亲鱼进行繁殖以确保养殖圆口铜鱼遗传多样性不降低, 充分保存不同谱系分支的圆口铜鱼资源。
