饲料脂肪水平对长养殖周期异育银鲫“中科3号”生长和脂代谢的影响
2022-01-20费树站巫丽云伟2刘昊昆金俊琰杨云霞朱晓鸣解绶启
费树站 巫丽云 郭 伟2 刘昊昆 韩 冬 金俊琰 杨云霞 朱晓鸣 解绶启
(1. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
脂肪作为一种重要的宏量营养素, 维持鱼类生命活动和提供必需脂肪酸, 为某些维生素和激素的合成提供前体物质及在维持细胞膜的结构和功能方面起着重要作用[1,2]。在饲料中适宜的脂肪水平可促进鱼类生长, 降低饵料系数, 提高蛋白质效率,减少氮的排放, 改善鱼类的健康状况[3—5]。当脂肪水平过高会引起蛋白质和消化能比例失衡, 造成脂肪在肝脏和肠道的积累, 从而导致摄食减少, 生长减缓, 危害鱼体健康[6—8]。同样, 脂肪缺乏或者过低也会导致生长缓慢、抗病能力减弱和对免疫造成直接影响[9,10]。随着鱼类生长发育, 鱼体组织器官功能不断完善, 对营养需求也不断变化, 多种鱼类被报道其生长发育过程中食性发生改变[11,12]。目前, 对于长养殖周期中异育银鲫不同生长阶段饲料脂肪水平的需求还未做系统评估, 因此对其正常生长及生理代谢需求的研究意义重大。
不同鱼对脂肪的需求不一致, 同种鱼的不同规格对脂肪需求水平亦有差异。研究结果表明, 体重为17 g的异育银鲫脂肪需求为4.08%—6.92%[13];小规格(约3.5 g)、中规格(约54 g)和大规格(约189 g)的异育银鲫饲料脂肪最适水平分别为74.1、124.6和121.2 g/kg[14]。本实验以异育银鲫“中科3号”为研究对象, 设计脂肪水平为4%、8%、12%、16%和20%五个梯度的饲料, 进行为期340d的养殖实验,比较探究异育银鲫长养殖周期不同阶段对脂肪需求、消化酶和脂代谢的差异。
1 材料与方法
1.1 实验饲料与制作
本实验制备了5种等氮饲料(蛋白质含量34%),以秘鲁鱼粉、豆粕和菜粕为主要蛋白源, 以次粉和玉米淀粉为碳水化合物, 鱼油和豆油等量混合作为主要脂肪源, 分别配制脂肪水平为4.22%(L4)、8.11%(L8)、12.11%(L12)、16.23%(L16)和20.30%(L20)5组饲料。所有原料进行粉碎, 按配方比例充分混匀, 将混合后的原料过40目筛, 加水搅拌调制后用制粒机(SLP系列制粒机, 型号: SLP-45, 中国水产科学研究院渔业机械设备研究所, 上海)分批制备成不同粒径的饲料颗粒(幼鱼期饲料粒径1.5 mm,养成前期和越冬后期饲料粒径2.0 mm, 养成中后期饲料粒径2.5 mm)。于60℃恒温烘箱烘干至水分接近10%后于4℃冰箱中密封保存备用。实验饲料配方如表 1所示。
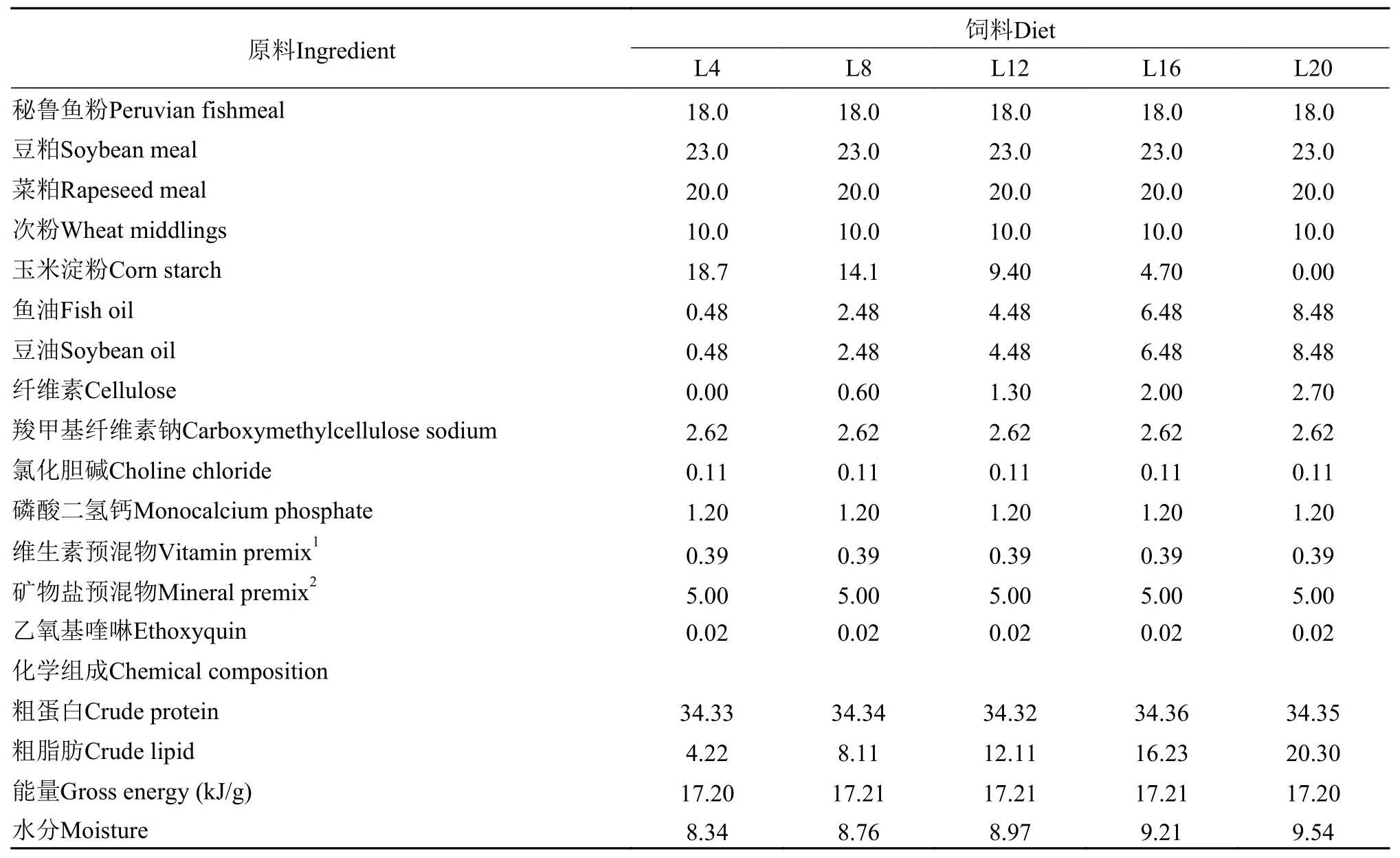
表 1 饲料配方及化学组成(%干物质)Tab. 1 Formulation and chemical composition of the experimental diets (% dry matter)
1.2 实验鱼及饲养管理
本实验采用的异育银鲫“中科3号” 雌幼鱼来自中国科学院水生生物研究所官桥养殖基地(湖北武汉)。在湖北省石首市老河渔场长江故道江段网箱进行, 在养殖实验开始前, 将鱼放置在江段网箱实验系统(网箱规格: 2 m×2 m×2 m)中暂养2周进行驯化以适应环境, 暂养饲料为5种实验饲料的等量混合饲料。实验开始前使其饥饿24h, 随机挑选体格均匀、体质健壮的异育银鲫“中科3号”幼鱼(初重11.33±0.03) g称重后随机放入20个网箱(60尾/箱),每个处理组4个重复。共分5个连续养殖阶段: 第一阶段为幼鱼期(2016.8.7—2016.10.9, 63d取样,D63)、第二阶段为养成前期(2016.10.10—2016.11.28,110d取样, D110)、第三阶段越冬期(2016.11.29—2017.3.23, 223d取样, D223)、第四阶段越冬后(2017.3.24—2017.5.16, 275d取样, D275)及第五阶段养成中后期(2017.5.17—2017.7.20, 340d取样,D340)。越冬期间停止投喂, 整个生长实验持续340d(2016.8.7—2017.7.20), 每天饱食投喂3次(08:00、13:00和18:00)。在实验期间每天测水温,D63阶段水温为21.5—30.5℃, D110为17.0—21.5℃,D223为3.8—17.3℃, D275为17.3—23.5℃, D340为18.3—28.8℃。养殖期间溶氧维持在5.01—6.88 mg/L,氨氮小于0.43 mg/L。
1.3 样品采集
在每一阶段养殖结束后, 将鱼饥饿24h, 捞出后用麻醉剂MS-222 (50 mg/L, Sigma, 美国)麻醉, 抹干称总重。每个网箱2尾鱼抹干称重, 保存在-20℃冰箱中用于体组分分析。每网箱挑选3尾鱼, 用0.2%肝素钠抗凝剂浸润过的注射器进行尾部取血,在4℃下以转速3000×g离心15min(Eppendorf 5417R,Germany)得到血浆, 保存于-80℃用于后期分析。随后在冰盘上将肝脏和肠道解剖分离, 并迅速置于液氮中速冻后再转入-80℃冰箱中保存。
1.4 样品分析
实验饲料和全鱼基本组分的测定遵循AOAC(2003) 标准方法[15]。采用失重法测定干物质含量,置于烘箱(电热恒温干燥箱, 精宏, 中国上海)中105℃烘干至恒重; 粗脂肪测定采用索氏抽提仪(Soxtec System HT6, Tecator, Hoganas, Sweden)进行抽提; 粗蛋白采用凯氏定氮仪(Soxtec System HT6 Tecator, Haganas, Sweden)测定; 灰分使用马弗炉(湖北英山县建力电炉制造厂, 湖北英山)于550℃焚烧至恒重进行测定, 使用氧弹测热仪(Philipson microbomb calorimeter, Gentry Instruments Ins,Aiken, USA)测定能量值。
血浆葡萄糖和甘油三酯含量均采用全自动生化分析仪(迈瑞BS-460, 中国深圳)及其标准试剂盒(氧化酶法)测定, 具体方法参考仪器使用说明。后肠淀粉酶(C016-1)测定采用南京建成商品试剂盒检测(南京建成生物工程研究所, 中国南京)。脂肪酶活性根据南京建成生物工程研究所的试剂盒(A054-1-1)说明书进行, 原理是胶束中的甘油三酯在脂肪酶的作用下发生水解, 使胶束分裂, 散射光或浊度会因此降低, 速率降低和脂肪酶活性密切相关。胰蛋白酶活性测定方法参照Erlanger等[16]进行,将1min内吸光值下降0.01表示为1 U来表示定义胰蛋白酶活性。每个样品测定2个重复。
所有目标基因引物序列均见于表 2。用TRIzol试剂 (Invitrogen, USA)提取肝脏总RNA。以肝脏的总RNA为模板, 使用Invitrogen公司M-MLVFrist-Stand Synthesis System推荐的方法反转录为cDNA, 反应条件参考试剂盒的说明书。用Light Cycle 480 Ⅱ(Roche, Basel, Switzerlad)系统及Light Cycle®480 SYBR®GreenⅠ Master(Roche, Basel,Switzerlad)试剂进行RT-PCR实时荧光定量检测。选择β-actin为内参基因, 预实验确定扩增效率及使用内参和目的基因做标曲。基因定量参考体系:2 μL的cDNA稀释液(稀释60倍), 3 μL Light Cycle®480 SYBR®GreenⅠ Master, 0.24 μL 上下游引物及0.52 μL ddH2O, 反应总体积为6 μL。相对mRNA表达量参考文献[17], 各阶段基因的相对表达量以L4为对照组。

表 2 RT-qPCR所用引物Tab. 2 Primers used in RT-qPCR
1.5 数据统计分析
本实验所有数据均使用统计软件SPSS 18.0进行统计分析。实验结果以平均值±标准误的形式(mean±SE)表示, 进行单因素方差分析(One-way ANOVA), 以P<0.05表示统计学差异显著, 当差异显著时则进行Duncan’s多重比较。
2 结果
2.1 饲料脂肪水平对长养殖周期异育银鲫“中科3号”生长性能和鱼体成分的影响
由表 3可知, 在幼鱼期(D63), 饲料脂肪水平对异育银鲫的生长性能有显著影响, 其增重率、特定生长率和饲料效率均随着脂水平的升高呈现先升高后下降的趋势, 且在水平脂肪为8%时显著高于其他各处理组(P<0.05), 摄食率在该养殖阶段无显著性差异(P>0.05)。在养成前期(D110), 随着饲料脂肪水平的升高, 增重率呈现先升高后下降的趋势,且在脂肪水平为12%时达到最大, 而特定生长率、摄食率和饲料效率在该阶段无显著差异(P>0.05)。在越冬期(D223), 异育银鲫的生长性能在各处理组中无显著性差异(P>0.05)。在越冬后期(D275)和养成中后期(D340), 不同脂肪水平饲料对鱼体生长性能和饲料利用均无显著影响(P>0.05)。
由表 4可知, 在幼鱼期(D63), 饲料脂肪水平对异育银鲫的粗蛋白、粗脂肪、灰分和水分含量均无显著影响(P>0.05)。在养成前期(D110), 鱼体粗蛋白、粗脂肪和灰分含量受到饲料脂肪水平的显著影响, 其中粗蛋白含量在L8和L16组显著低于其他各组, 鱼体粗脂肪含量随着饲料脂肪水平的提高呈升高的趋势, 且在L16组显著高于其他各处理组,水分含量随着脂肪水平的升高而下降, 且低脂肪水平L4组异育银鲫的水分含量显著高于其他各处理组(P<0.05)。在越冬期(D223), 各处理组鱼体组分均无显著差异。在养成中后期(D340), 饲料脂肪水平对各处理组异育银鲫鱼体粗蛋白、水分和灰分含量均无显著影响(P>0.05), 但随着饲料脂肪水平的提高, 鱼体粗脂肪含量显著升高(P<0.05)。
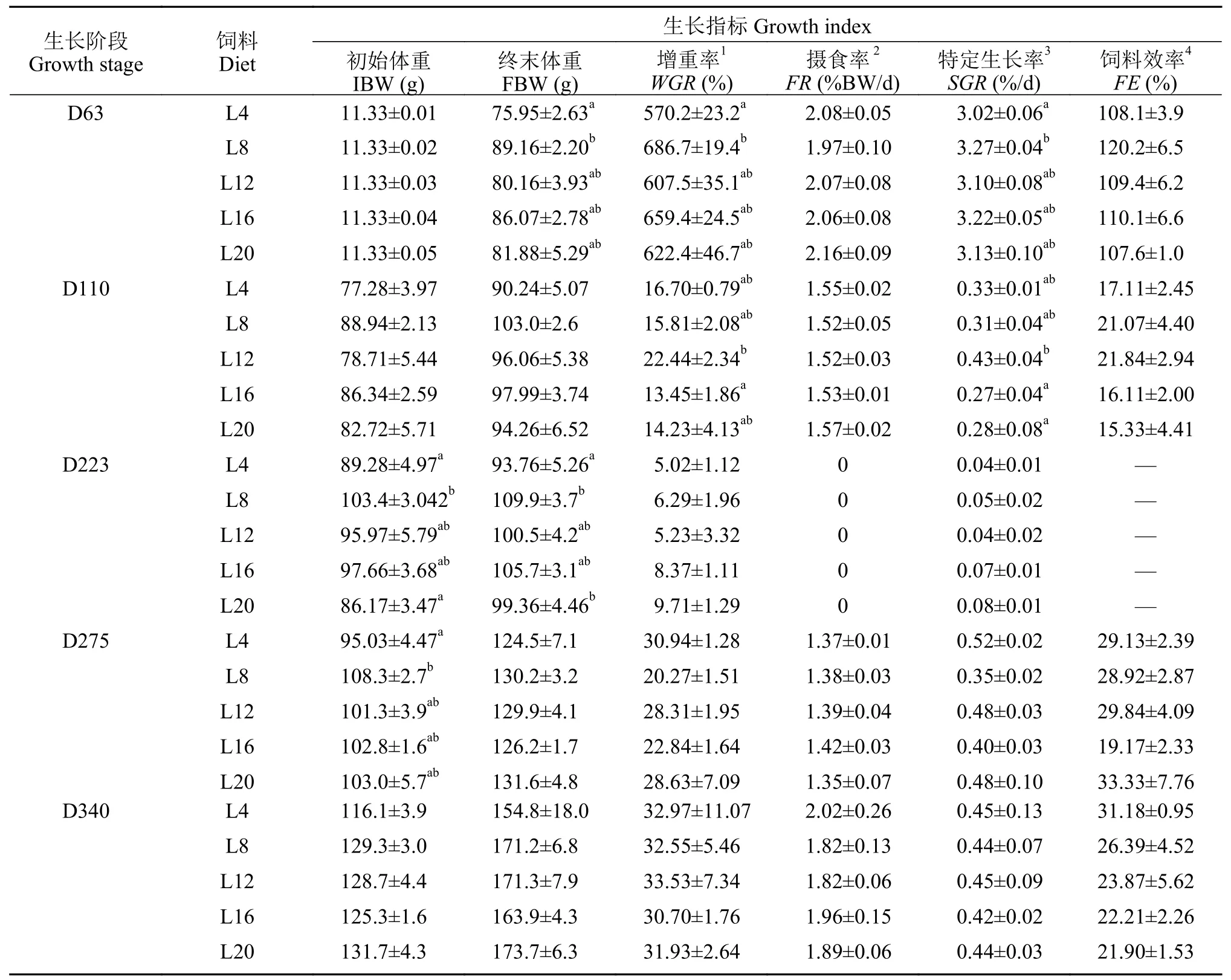
表 3 饲料脂肪水平对异育银鲫“中科3号”生长性能的影响Tab. 3 Effects of dietary lipid on growth performance of gibel carp
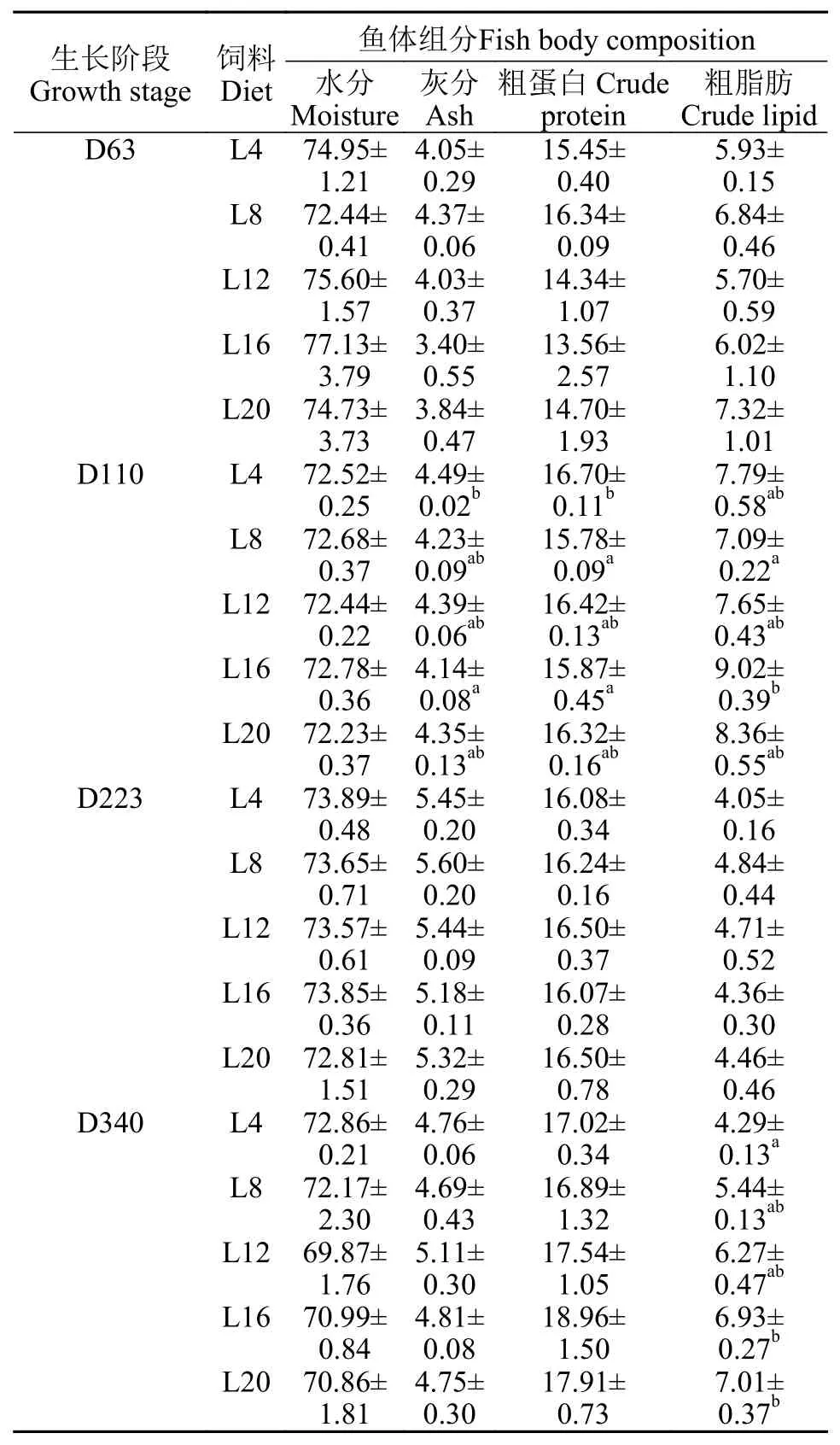
表 4 饲料脂肪水平对异育银鲫鱼体基本组分的影响(% 湿重)Tab. 4 Effects of dietary lipid on body composition (% wet weight) of gibel carp
2.2 饲料脂肪水平对长养殖周期异育银鲫“中科3号”血浆生化指标的影响
如图 1所示, 在幼鱼期(D63), 异育银鲫血浆葡萄糖水平随着饲料脂肪水平的升高呈现下降趋势,并在脂肪水平为20%时最低(P<0.05), 甘油三酯含量随饲料脂肪水平的升高呈先上升后下降的趋势,在脂肪水平为12%时甘油三酯含量最高。在养成前期(D110), 异育银鲫血糖水平随饲料脂肪水平的升高呈现先上升后下降, 在L20组显著降低(P<0.05),异育银鲫血浆甘油三酯含量在各组间均无显著差异。在越冬期(D223), 不同饲料脂肪水平对越冬期异育银鲫血糖和甘油三酯含量无显著影响(P>0.05)。在越冬后(D275), 异育银鲫血糖水平随饲料脂肪水平的升高而升高, 且在L20组显著升高(P<0.05), 甘油三酯呈相同趋势, 但差异不显著(P>0.05)。在养成后期(D340), 异育银鲫血糖水平随饲料脂肪水平的升高呈先上升后下降的趋势, 并在L16组中达到最高(P<0.05), 而各处理组甘油三酯含量无显著差异(P>0.05)。
2.3 饲料脂肪水平对长养殖周期异育银鲫“中科3号”肠道消化酶活性的影响
如图 2所示, 在幼鱼期(D63), 异育银鲫肠道胰蛋白酶和脂肪酶活性随饲料脂肪水平的升高呈现先下降后升高的趋势, 而淀粉酶活性随脂肪水平的升高呈现上升趋势, 且三者酶活性均在L20组最高(P<0.05)。在越冬期(D223), 异育银鲫肠道胰蛋白酶活性随饲料脂肪水平的上升呈现先上升后下降的趋势, 且在L16组显著高于其他处理组(P<0.05)。在养成中后期(D340), 异育银鲫肠道胰蛋白酶、脂肪酶和淀粉酶活性在各个处理组无显著差异(P>0.05)。
2.4 饲料脂肪水平对长养殖周期异育银鲫“中科3号”脂代谢相关基因的影响
如图 3所示, 脂肪转运相关基因:在幼鱼期(D63)和越冬后期(D275), 异育银鲫肝fatpmRNA相对表达量随饲料脂肪水平的升高呈现先上升后下降, 且均在L8组达到最高(P<0.05)。
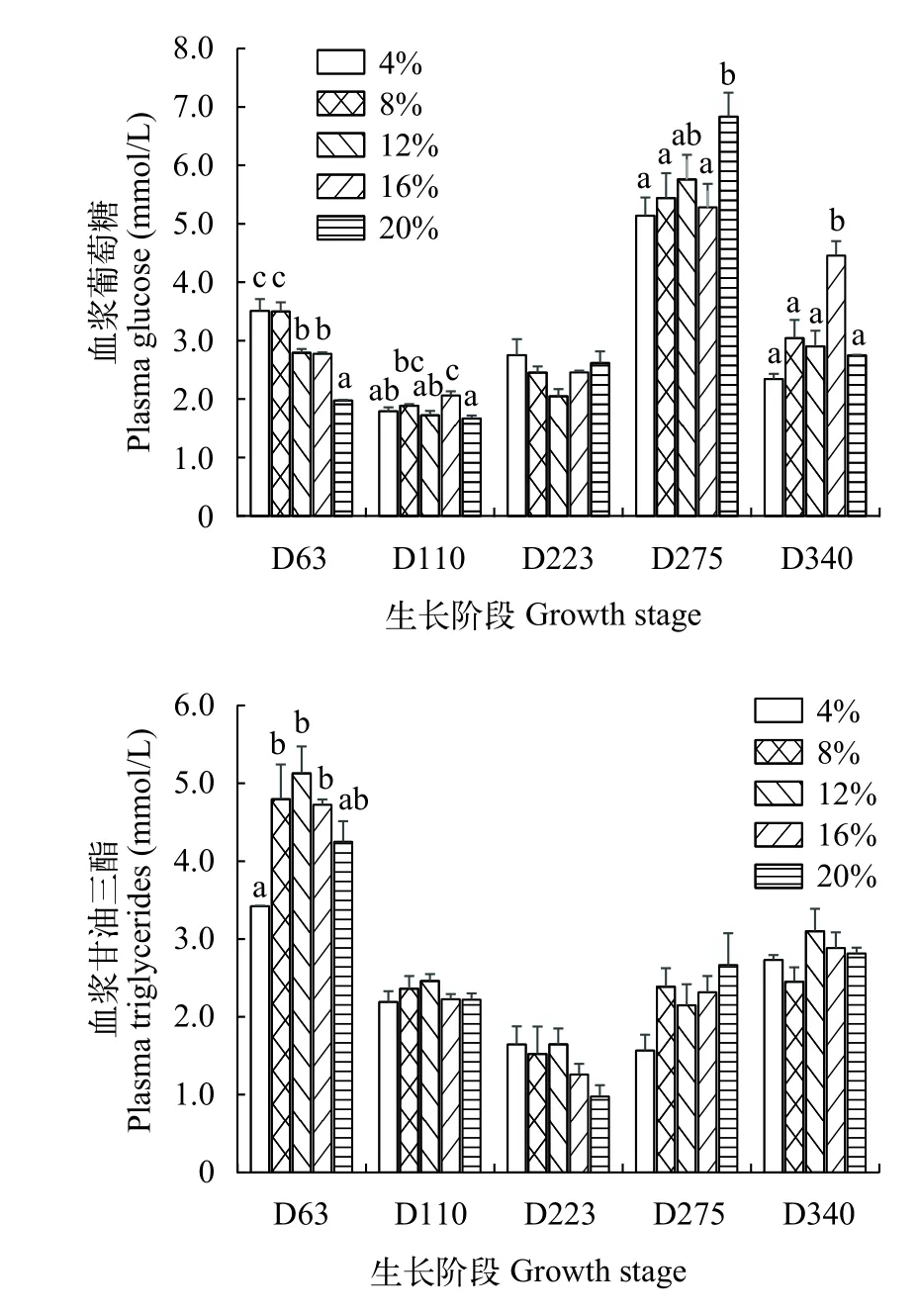
图 1 饲喂不同脂肪水平饲料异育银鲫血糖浓度和血浆甘油三酯水平Fig. 1 Plasma glucose and triglycerides of gibel carp fed with different lipid diets
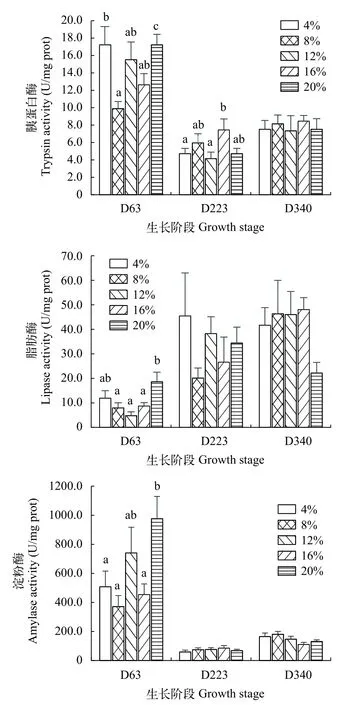
图 2 不同生长阶段异育银鲫肠道胰蛋白酶、脂肪酶和淀粉酶活性Fig. 2 The activities of trypsin, lipase and amylase in intestinal tract of gibal carp at different growth stages, respectively (n=8)
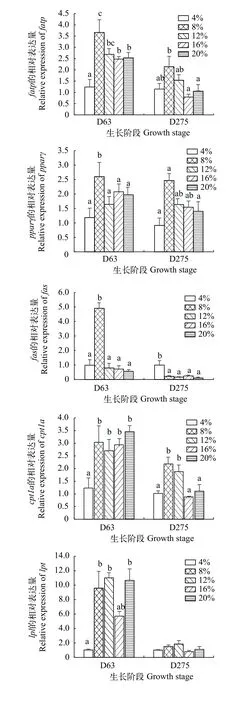
图 3 饲料脂肪水平对异育银鲫肝脏脂代谢相关基因mRNA相对表达量的影响Fig. 3 Effect of dietary lipid levels on hepatic lipid metabolism related genes expression of gibel carp
脂肪合成相关基因:在幼鱼期(D63), 异育银鲫肝脏转录因子pparγ和脂肪酸合成酶fasmRNA相对表达量随着饲料脂肪水平的上升呈先上升后下降的趋势, 且均在L8组达到最大(P<0.05)。越冬后期(D275), 异育银鲫肝脏转录因子pparγmRNA相对表达量随着脂肪水平的上升呈先升高后下降的趋势, 且在L8组达到最大, 脂肪酸合成酶fasmRNA相对表达量随脂肪水平增加而下降, 且在L20组最低(P<0.05)。
脂肪分解相关基因:在幼鱼期(D63), L4组异育银鲫肝脏cpt1a和lplmRNA相对表达量显著低于其他各处理组(P<0.05), 而脂肪水平为8%、12%、16%和20%处理组之间无显著差异。越冬后期(D275), 异育银鲫cpt1amRNA相对表达量随着饲料脂肪水平的升高呈先升高后下降的趋势, 且L8和L12组显著高于其他各处理组(P<0.05), 异育银鲫肝脏lplmRNA相对表达量在各处理组无显著差异(P>0.05)。
3 讨论
3.1 长养殖周期异育银鲫“中科3号”的脂肪需求
本研究表明, 饲料脂肪水平对异育银鲫幼鱼期和养成前期生长性能有显著影响, 分别在饲料脂肪水平为8%和12%时的增重率达到最优, 而饲料脂肪水平对越冬期、越冬后期和养成后期异育银鲫的生长性能和饲料利用均无显著影响, 表明异育银鲫不同生长阶段对脂需求有差异, 且饲料脂肪水平的变化对大规格异育银鲫的生长和饲料利用影响较小。本实验在自然水域条件下养殖, 在D110—D223阶段, 由于水温逐渐降低, 异育银鲫的摄食率降低,故其生长减缓, 在长达113d的D275越冬阶段, 停止投喂异育银鲫, 其生长几乎停滞, 而后在越冬后期,水温逐渐回暖, 摄食率又逐渐上升。有研究表明,“越冬综合征”是水产养殖业面临的潜在威胁, 越冬鱼类面临低温和饥饿的双重胁迫, 使机体免疫力降低从而导致大量死亡[18]。在本实验中, 饲料脂肪水平的变化对鱼体水分和灰分的影响较小, 除越冬期外, 饲料脂肪水平的提高导致鱼体脂肪含量的沉积增多。膳食脂肪是重要的能量来源, 为机体提供必需脂肪酸和磷脂, 在鱼类营养中发挥重要作用[19]。适宜的脂肪添加量对维持鱼类生命活动十分关键,过高或者过低的添加量都会对鱼体造成负面影响[20]。大量的研究表明, 鱼类摄入过量的饲料脂肪会导致脂肪在内脏、肝脏和肌肉大量沉积, 从而引发机体代谢负担和氧化损伤, 故抑制生长[1,5,21,22]。基于本研究不同生长阶段异育银鲫的生长性能和饲料利用, 根据异育银鲫不同生长阶段对饲料脂肪的添加水平应做适当调整, 且最适脂肪添加水平在8%—12%。
3.2 饲料脂肪对长养殖周期异育银鲫“中科3号”血浆生化活性的影响
鱼类血浆生化指标反映了其生理代谢的变化,并与鱼的种类、营养状况和生长环境相关。脂类在鱼类血液中以甘油三酯的形式存在和运输, 其含量代表脂肪在体内的代谢状况; 血浆葡萄糖水平的变化反映鱼体对糖的吸收、转运和代谢情况, 其含量是机体维持稳态的重要指标之一[23]。在本研究中, 在幼鱼期, 鱼体血浆葡萄糖水平随着饲料脂肪水平的升高而显著降低, 甘油三酯含量随饲料脂肪水平的升高呈先上升后下降的趋势, 表明过高的饲料脂肪水平, 葡萄糖代谢和脂质运转的反应受到抑制。其原因可能是消化脂肪的胆汁分泌异常或者肝功能受损, 阻碍了甘油三酯从肝脏转运到血液,导致血液甘油三酯含量降低。这说明高水平的饲料可能造成肝功能受损, 致使鱼体代谢抑制, 这与叶坤等[24]和甘辉等[25]的研究结果相似。而饲料脂肪水平对养成前期、越冬期、越冬后期和养成后期异育银鲫的血浆甘油三酯均无显著影响, 但是对血浆葡萄糖水平在高脂肪水平饲料中有显著上升的趋势, 表明不同生长阶段的异育银鲫对脂肪的利用能力有差异。
3.3 饲料脂肪对长养殖周期异育银鲫“中科3号”消化酶活性的影响
肠道是鱼类消化吸收的主要场所, 鱼类肠道消化酶的活性高低直接决定了鱼类对营养物质的消化吸收能力, 不同食性鱼类研究中发现饲料脂肪水平对鱼类肠道脂肪酶、蛋白酶和淀粉酶活性均有一定程度的影响, 且各研究结果差异较大[26,27]。在本研究中, 幼鱼期鱼体肠道脂肪酶受到饲料脂肪水平的显著影响, 随脂肪水平的升高呈现先降低后升高的趋势。有研究表明, 消化酶活力与鱼类摄食状态、消化道结构和饵料中底物的量有关[28]。本实验中幼鱼期的异育银鲫脂肪酶在最高饲料脂肪水平组其活力最大, 这可能与饲料中脂肪含量较高有关, 鱼体需要合成更多的脂肪酶以消化吸收高脂。而在越冬后和养成中后期, 脂肪水平对肠道脂肪酶活性的影响不显著, 且脂肪酶活性要高于幼鱼期脂肪酶的活性, 表明幼鱼期异育银鲫对脂肪的需求量较低, 本实验幼鱼期的生长性能也证实了该观点。周建成[14]的研究结果与本实验结果相似, 异育银鲫通过提高自身消化酶活性以响应饲料脂肪水平的提高。在本实验中, 幼鱼期异育银鲫肠道胰蛋白酶和淀粉酶活性要高于越冬期和养成中后期的异育银鲫, 表明幼鱼期的异育银鲫对蛋白和能量依赖性更强, 这可能与该阶段处于生长旺盛期有关。
3.4 饲料脂肪对长养殖周期异育银鲫“中科3号”脂代谢相关基因表达的影响
肝脏是鱼类脂质代谢最为活跃的器官, 且肝脏的脂质稳态是一个复杂的过程, 包括脂质的摄取、转运和代谢等[29]。本实验对D63和D275两个生长阶段的异育银鲫肝脏脂肪代谢相关基因进行定量分析, 通过比较幼鱼期和恢复摄食后越冬后期的异育银鲫生理代谢差异, 比较研究异育银鲫生长过程中较长时间跨度里对脂肪利用的差异。血浆生化参数的变化可作为机体代谢和生理状态的指标, 其变化与鱼类的营养状况和新陈代谢密切相关[30]。在本实验中, 幼鱼期的异育银鲫血浆甘油三酯含量也随着饲料脂肪水平的升高呈先升高后下降的趋势, 表明适宜的脂肪水平能够增强幼鱼期异育银鲫的脂代谢水平, 而过高或过低均导致脂肪代谢减弱,除幼鱼期外, 异育银鲫在其他生长阶段对脂肪水平的变化不敏感。幼鱼期的异育银鲫血糖水平随着饲料脂肪的提高而显著降低, 这可能与饲料淀粉含量降低有关; 而养成前期、越冬后期及养成中后期的异育银鲫血糖水平在较高脂肪水平组有显著提高, 这可能与较大规格的异育银鲫对脂肪的耐受性较高有关, 过多的脂肪摄入导致脂肪的在体内沉积,多余的脂向糖转化, 导致血糖升高, 本实验的全鱼脂肪含量结果证实了该观点。脂肪酸转运蛋白1(fatp1) 是整合的跨膜蛋白, 通过调控脂肪酸的摄入和酯化, 促进脂肪酸跨膜运输, 参与脂质分布与沉积, 且受过氧化物酶体增殖物激活受体(ppar)、激素和细胞因子等物质的调控[31]。在本研究中, 幼鱼期和越冬后期的异育银鲫肝脏fatp1的转录水平随脂肪水平的上升呈现先上升后下降, 且均在L8组mRNA表达水平显著上调。pparγ是一类由配体激活的转录因子, 对调节脂肪生成和促进脂质储存至关重要, 在脂质稳态中发挥中介作用[32]。fas作为脂肪合成的关键酶, 在幼鱼期和越冬后期异育银鲫肝脏的转录水平均随着饲料脂肪水平的升高呈先升高后下降, 且在脂肪水平为8%时显著上调, 表明异育银鲫摄入过低或者过高的饲料脂肪均会显著抑制脂肪合成。脂蛋白酯酶(lpl)是脂蛋白代谢的关键酶, 在脂肪分解代谢中起关键作用, 直接调控机体脂代谢和脂质的沉积[33]。在本研究中,lpl的转录水平在幼鱼期显著受到饲料脂肪水平的影响, 且在L4组其表达水平最低, 与本研究结果相似, 在黄颡鱼(Pelteobagrus vachelli)、尼罗罗非鱼(Oreochromis niloticus)和大菱鲆(Scophthalmus maximusL.)的研究中发现, 脂肪水平的升高会显著提高肝脏lpl的表达量[30,34,35], 表明幼鱼期异育银鲫通过抑制脂肪分解来响应脂肪摄入不足以满足生理需求。cpt1是调控线粒体脂肪酸氧化的关键基因, 其异构体之一cpt1a主要在肝脏中表达[36,37]。在本实验中, 幼鱼期的异育银鲫肝脏cpt1a的转录水平在L4组显著低于其他各组, 而在越冬后期随饲料脂肪水平的升高其转录水平先升高后下降。有研究表明, 草鱼幼鱼对低脂摄入的适应策略是通过诱导糖酵解来提供乙酰辅酶A, 增加脂质合成(pparγ和fas)和抑制脂质分解(cpt1a和lpl)来维持脂质稳态[38]。
综上所述, 不同生长阶段的异育银鲫对脂肪的需求量略有差异, 幼鱼期的需求水平较低, 而养成前期其需求量较高, 最适脂肪水平在8%—12%。幼鱼期异育银鲫对脂肪的变化更为敏感, 脂肪摄入过低或过高均会导致脂代谢紊乱, 而较大规格的异育银鲫对应脂肪的摄入有更完善的适应策略。
