miR-29b通过靶向调节特异性蛋白1调控糖尿病性白内障晶状体上皮细胞间质转化的作用△
2022-01-18岳娅婷
牟 琳 刘 苹 李 来 岳娅婷
糖尿病性白内障是糖尿病患者中发生较早且具有致盲性的眼部并发症之一[1],其发生机制复杂。晶状体上皮细胞全程参与晶状体纤维的分化过程,其中上皮细胞间质转化(EMT)是关键环节,对于开发新的治疗方法具有重要意义[2]。然而,EMT调节糖尿病性白内障的分子机制仍有待进一步探讨。有证据表明,EMT过程受到多种因素的调控,如microRNAs (miRNAs)[3-5]。曾凯宏等[6]发现高糖可诱导视网膜Müller细胞miR-29b表达降低,说明miR-29b在糖尿病早期视损伤中属于保护性因子。郭小雷[5]证实miR-29b在高糖诱导的足细胞中表达量降低,而黄连素可以通过上调miR-29b表达延缓高糖诱导的足细胞EMT进程,因此,我们推断miR-29b是一类与EMT密切相关的miRNAs,这种靶向EMT的生物学分子有望成为预防或治疗糖尿病性白内障的重要靶标。因此,本研究拟分析miR-29b对糖尿病性白内障晶状体上皮细胞EMT的调控作用,并进一步研究其可能的分子机制,以期为糖尿病性白内障的机制研究及临床治疗提供新的可行性靶点。
1 材料与方法
1.1 细胞人晶状体上皮细胞HLE-B3(ATCC CRL-11421TM)购自美国典型菌种保藏中心。
1.2 主要试剂及仪器DMEM培养基购自美国Gibco公司;胎牛血清购自美国Sigma公司;Lipofectamine RNAiMAX转染试剂和LipofectamineTM2000转染试剂均购自美国Invitrogen公司;RIPA细胞裂解液和蛋白定量试剂盒购自上海碧云天有限公司;反转录试剂盒与SYBR Premix Ex Taq 试剂盒均购自日本TaKaRa公司;双荧光素酶报告试剂盒购自美国Promega公司;Western blot一抗:兔抗人N-钙黏蛋白(N-Cadherin)多克隆抗体(11000)、兔抗人E-钙黏蛋白(E-Cadherin)多克隆抗体(11000)、兔抗人波形蛋白(Vimentin)多克隆抗体(11000)均购自美国CST公司,兔抗人特异性蛋白1(SP-1)单克隆抗体(150)购自美国Abcam公司;免疫荧光一抗:兔抗人N-Cadherin多克隆抗体(1100)、兔抗人E-Cadherin多克隆抗体(11000)、兔抗人Vimentin多克隆抗体(11000)均购自美国Abcam公司。
1.3 方法
1.3.1 细胞培养及高糖处理HLE-B3细胞用含有体积分数10%胎牛血清、100 U·mL-1青霉素和100 mg·L-1链霉素的DMEM培养基于37 ℃、体积分数5%CO2饱和湿度的环境中培养。取对数生长期细胞分组处理,各组细胞分别用含有5.5 mmol·L-1D-葡萄糖 (正常组)、10.5 mmol·L-1D-葡萄糖 、15.5 mmol·L-1D-葡萄糖 、25.5 mmol·L-1D-葡萄糖、35.5 mmol·L-1D-葡萄糖的培养基分别培养24 h;或用含有35.5 mmol·L-1D-葡萄糖的培养基分别培养6 h、12 h、24 h、48 h,实时荧光定量PCR检测各组细胞miR-29b和SP-1 mRNA相对表达量,Western blot检测各组细胞SP-1蛋白表达水平。
1.3.2 细胞转染与分组取对数生长期HLE-B3细胞分为:正常组(用含有5.5 mmol·L-1D-葡萄糖的培养基培养24 h)、高糖组(用含有35.5 mmol·L-1D-葡萄糖的培养基培养24 h)、阴性组(转染miRNA模拟物scramble和阴性siRNA序列)、miR-29b mimics组(转染miR-29b模拟物)、miR-29b mimics+SP-1组(转染miR-29b模拟物和SP-1基因序列),除正常组外其余各组细胞均用含有35.5 mmol·L-1D-葡萄糖的培养基培养24 h。由上海GenePharma公司化学合成了人miR-29b模拟物和模拟物阴性对照序列。miR-29b模拟物基因序列为:正向: 5’-UAGCAUCACAGAAAUAUUGGC-3’,反向: 5’-CAAUAUUUCUGUGCUGCUAUU-3’。细胞在6孔板中的融合率为70%~80%时,用Lipofectamine RNAiMAX质粒转染miR-29b模拟物和模拟物阴性对照序列48 h后,实时荧光定量PCR检测各组细胞miR-29b相对表达量。此外委托上海Sangon Biotech公司以化学方法合成了人SP-1基因特异性序列和阴性对照序列。用LipofectamineTM2000质粒转染细胞6 h,然后更换培养基。继续转染48 h后进行后续实验。SP-1基因序列为:正向:5’-CCGCTCGAGTTGAUUTGAGGAGACATCTA-3’;反向:5’-ATAAGAATGCGGCCGCAGCATTTACCCACAGCC-3’(该引物序列含有与miR-29b互补的靶序列);阴性对照序列为:正向:5’-UUGUACUACACAAAAGUACUG-3’;反向:5’-GUACUUUUGUGUAGUACAGUU-3’,作为阴性对照。
1.3.3 实时荧光定量PCR检测细胞miR-29b和SP-1的mRNA表达使用总RNA提取试剂盒提取总RNA并用反转录试剂盒反转录成cDNA后,用SYBR Green PCR Master Mix试剂盒进行PCR,PCR扩增条件为:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 30 s,共40个循环。以小分子U6 mRNA或GAPDH为内参,结果分析采用2-ΔΔCt法。
1.3.4 Transwell实验检测细胞垂直迁移活性将细胞按10×103个·mL-1接种至Transwell上层小室(孔径8 μm)中,用200 μL无血清DMEM(5.5 mmol·L-1D-葡萄糖)培养基培养,同时在下层小室中加入600 μL含体积分数10%胎牛血清的DMEM(35.5 mmol·L-1D-葡萄糖)培养基。培养24 h后,用棉签仔细擦拭上层小室的细胞。然后将滤纸固定在40 g·L-1多聚甲醛中30 min,用1 g·L-1结晶紫染色20 min。在倒置显微镜下对5个随机视野的染色细胞进行计数。每个实验均重复3次。
1.3.5 细胞划痕实验检测细胞迁移活性将细胞按20×103个·mL-1接种于6孔板中,培养过夜达到80%以上融合。用200 mL移液管尖端划伤单层细胞,制作人工伤口。分别用含5.5 mmol·L-1或35.5 mmol·L-1D-葡萄糖的培养基培养细胞24 h。倒置显微镜下拍照。划痕愈合率=(划痕宽度0 h-划痕宽度24 h)/划痕宽度0 h×100%。
1.3.6 免疫荧光染色法检测细胞中EMT相关蛋白表达和定位将细胞培养于12孔平板中,放置一盖玻片进行细胞爬片。经过不同处理后,用40 g·L-1多聚甲醛固定玻片上的细胞30 min。PBS洗涤3次×5 min,然后用体积分数1% Triton X-100在PBS中处理30 min,以提高细胞膜的通透性。为了减少非特异性免疫反应,在室温下将10 g·L-1牛血清白蛋白滴于细胞上30 min,然后将细胞与初级抗体(抗N-Cadherin、抗E-Cadherin、抗Vimentin、抗SP-1)在4 ℃下孵育过夜。用荧光标记的山羊抗兔IgG二抗孵育 1 h 后,用DAPI染色细胞核。采用共聚焦激光扫描显微镜观察染色细胞并获得图像。
1.3.7 Western blot检测细胞蛋白表达各组细胞用RIPA裂解液裂解后提取细胞总蛋白,用蛋白定量试剂盒对蛋白定量后,将蛋白在100 g·L-1十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)中电泳分离,然后转移到聚偏氟乙烯膜上。50 g·L-1脱脂奶粉封闭1 h后,分别加入N-Cadherin、E-Cadherin、Vimentin、SP-1一抗孵育过夜,然后经山羊抗兔IgG二抗孵育后用ECL化学发光法显影,蛋白表达水平根据β-微管蛋白(β-Tubulin)进行标化。
1.3.8 双荧光素酶报告基因检测使用重叠PCR法扩增得到miR-29b及SP-1基因野生型和突变型序列,先用XhoI与Xbal双酶切pmirGIO载体,再将miR-29b及SP-1目的片段与pmirGIO双黏载体构建成pmirGIO-miR-29b及pmirGIO-SP-1重组载体,最后将细胞接种于24孔板,待细胞长至70%~80%时,用LipofectamineTM2000将重组报告载体转染入细胞中。对照组转染miR-NC质粒。转染后24 h,通过双荧光素酶报告系统检测荧光素酶活性。
1.4 统计学分析采用SPSS 19.0统计分析软件分析数据,数据分析结果以均数±标准差表示。两组间数据比较采用t检验,多组间数据比较采用单因素方差分析(ANOVA)。检验水准为:α=0.05。
2 结果
2.1 高糖对HLE-B3细胞形态的影响光学显微镜下观察发现,正常组HLE-B3细胞排列紧密,呈鹅卵石样贴壁生长;10.5 mmol·L-1D-葡萄糖组、15.5 mmol·L-1D-葡萄糖组、25.5 mmol·L-1D-葡萄糖组、35.5 mmol·L-1D-葡萄糖组培养细胞24 h后,部分细胞表现出一定的纤维样细胞特性,尤其是用25.5 mmol·L-1D-葡萄糖、35.5 mmol·L-1D-葡萄糖处理的细胞出现变长趋势且数量减少(图1)。
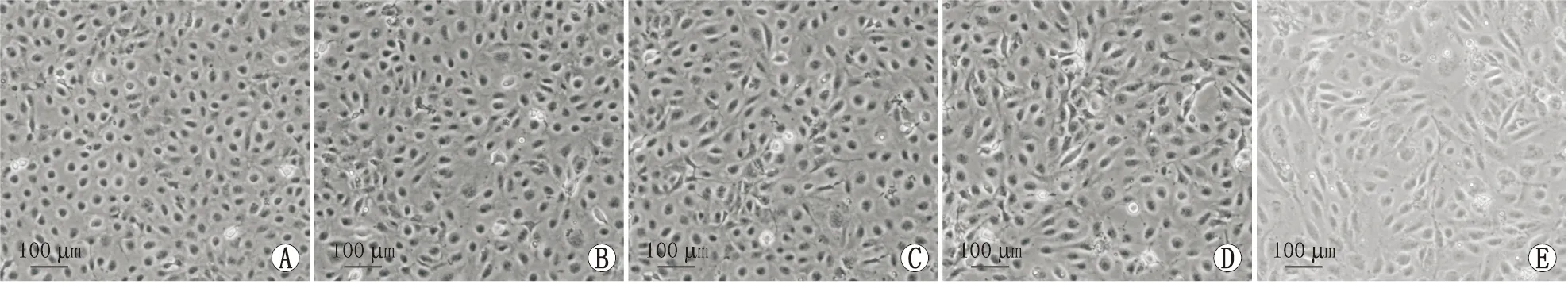
图1 不同浓度D-葡萄糖培养下HLE-B3细胞形态特征(×200) A:正常组;B:10.5 mmol·L-1 D-葡萄糖组;C:15.5 mmol·L-1 D-葡萄糖组;D:25.5 mmol·L-1 D-葡萄糖组;E:35.5 mmol·L-1 D-葡萄糖组。
2.2 高糖对HLE-B3细胞miR-29b、SP-1 mRNA表达的影响25.5 mmol·L-1D-葡萄糖组 、35.5 mmol·L-1D-葡萄糖组处理HLE-B3细胞24 h,细胞中miR-29b相对表达量较正常组、10.5 mmol·L-1D-葡萄糖组、15.5 mmol·L-1D-葡萄糖组均显著降低,且35.5 mmol·L-1D-葡萄糖组HLE-B3细胞miR-29b相对表达量低于25.5 mmol·L-1D-葡萄糖组(均为P<0.05);同时35.5 mmol·L-1D-葡萄糖组处理HLE-B3细胞24 h,细胞中SP-1 mRNA和蛋白相对表达量较正常组,10.5 mmol·L-1、15.5 mmol·L-1D-葡萄糖组均显著升高(均为P<0.05)(图2)。故选择35.5 mmol·L-1D-葡萄糖作为实验用最佳高糖浓度。此外,用35.5 mmol·L-1D-葡萄糖处理HLE-B3细胞24 h、48 h时,细胞中miR-29b相对表达量较0 h、6 h、12 h时均显著降低,同时SP-1 mRNA和蛋白相对表达量均升高(均为P<0.05);但是处理24 h和48 h时,HLE-B3细胞miR-29b、SP-1 mRNA和蛋白相对表达量差异均无统计学意义(均为P>0.05,图3)。
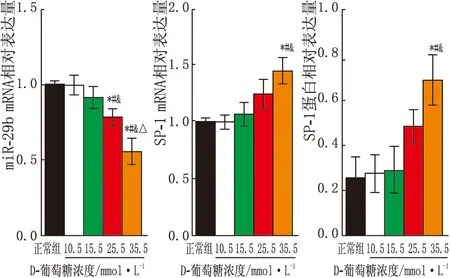
图2 不同浓度D-葡萄糖对HLE-B3细胞miR-29b、SP-1 mRNA和蛋白表达的影响 与正常组相比,*P<0.05;与10.5 mmol·L-1D-葡萄糖组相比,#P<0.05;与15.5 mmol·L-1D-葡萄糖组相比,&P<0.05;与25.5 mmol·L-1D-葡萄糖组相比,ΔP<0.05。
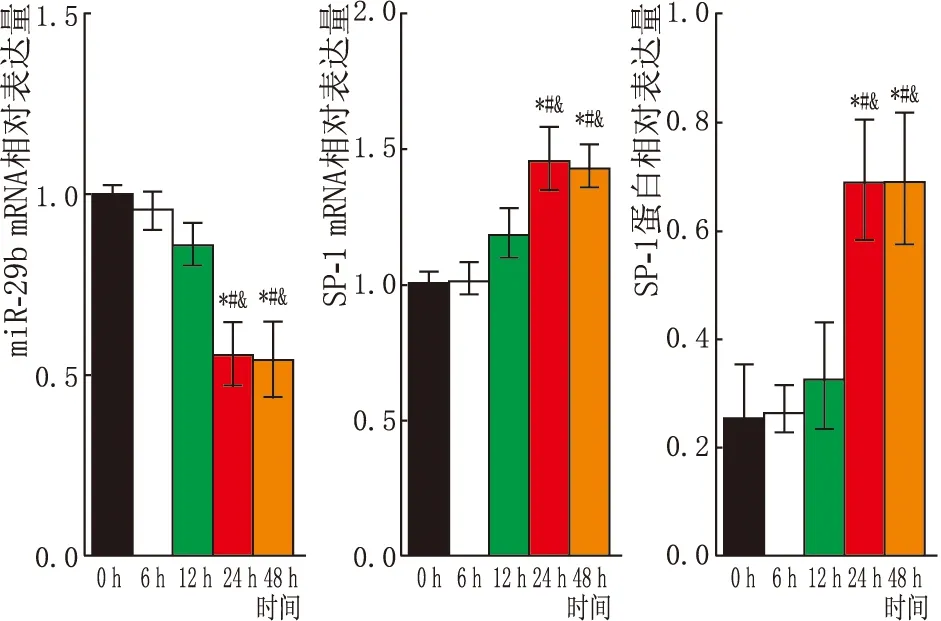
图3 35.5 mmol·L-1 D-葡萄糖处理不同时间对HLE-B3细胞miR-29b、SP-1 mRNA和蛋白表达的影响 与处理0 h相比,*P<0.05;与处理6 h 相比,#P<0.05;与处理12 h相比,&P<0.05。
2.3 转染效果验证正常组HLE-B3细胞miR-29b、SP-1 mRNA和蛋白相对表达量(1.002±0.023、1.010±0.038、0.257±0.091)和阴性组(0.998±0.030、1.004±0.033、0.251±0.049)比较差异均无统计学意义(均为P>0.05)。miR-29b mimics组HLE-B3细胞miR-29b相对表达量(2.162±0.103)较正常组和阴性组均升高(均为P<0.05),同时miR-29b mimics组HLE-B3细胞SP-1 mRNA(0.756±0.048)和蛋白(0.159±0.021)相对表达量较正常组和阴性组均降低(均为P<0.05)。miR-29b mimics+SP-1组HLE-B3细胞miR-29b相对表达量(2.089±0.095)与miR-29b mimics组基本一致(P>0.05);SP-1 mRNA和蛋白相对表达量(2.895±0.177、0.890±0.118)较正常组、阴性组和miR-29b mimics组均升高(均为P<0.05),以上结果表明转染成功。
2.4 上调miR-29b表达对高糖诱导的HLE-B3细胞迁移活性的影响高糖组HLE-B3细胞Transwell小室迁移数量和划痕愈合率[(786±95)个、(81.73±5.39)%]较正常组[(431±61)个、(54.85±7.08)%]均增加(均为P<0.05)。阴性组HLE-B3细胞Transwell小室迁移数量和划痕愈合率[(760±116)个、(80.53±6.75)%]与高糖组相比差异均无统计学意义(均为P>0.05)。miR-29b mimics组HLE-B3细胞Transwell小室迁移数量和划痕愈合率[(479±86)个、(61.49±8.62)%]较高糖组和阴性组均明显减少(均为P<0.05)。此外miR-29b mimics+SP-1组HLE-B3细胞Transwell小室迁移数量和划痕愈合率[(651±102)个、(76.54±7.75)%]均高于miR-29b mimics组(均为P<0.05)。
2.5 上调miR-29b表达对HLE-B3细胞EMT相关蛋白表达的影响免疫荧光染色和Western blot检测结果显示,与正常组相比,高糖组细胞中E-Cadherin蛋白表达降低,同时N-Cadherin和Vimentin蛋白表达增强。而与高糖组和阴性组相比,miR-29b mimics组细胞中E-Cadherin蛋白表达增强,同时N-Cadherin 和Vimentin蛋白表达减弱。转染SP-1后,miR-29b mimics+SP-1组细胞中E-Cadherin蛋白表达较miR-29b mimics组降低,同时N-Cadherin和Vimentin蛋白表达较miR-29b mimics组均升高(均为P<0.05)(图4、图5)。
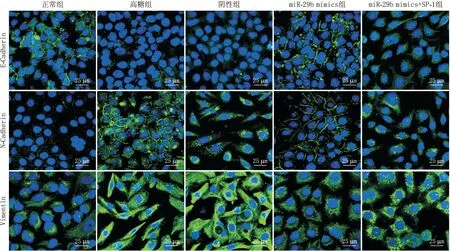
图4 免疫荧光染色检测各组HLE-B3细胞EMT相关蛋白的表达情况(×800)

图5 Western blot检测各组HLE-B3细胞EMT相关蛋白的表达情况 A:正常组;B:高糖组;C:阴性组;D:miR-29b mimics组;E:miR-29b mimics+SP-1组。
2.6 生物信息学分析及双荧光素酶报告基因验证经TargetScan、 miRanda及miRDB数据库预测miR-29b的靶基因包含SP-1。经双荧光素酶报告基因分析结果显示,与转染miR-NC质粒的对照组相比,转染miR-29b mimics质粒可降低SP-1-3’UTR-WT荧光素酶活性约57.5%(1.00±0.09vs0.48±0.05,P<0.05),但不降低SP-1-3’UTR-MUT荧光素酶活性(1.01±0.09vs0.98±0.07,P>0.05)。
3 讨论
糖尿病性白内障是糖尿病常见的眼部慢性并发症,其发病率正在逐年上升[7]。越来越多的miRNAs在白内障发展过程中的异常表达已经确定,而相关机制研究也引起了科研人员更多的关注[8]。本研究证实miR-29b在高糖处理的HLE-B3细胞中表达量降低。上调miR-29b可通过调节SP-1依赖性信号通路抑制高糖条件下HLE-B3细胞EMT进程,进而对晶状体上皮细胞产生一定的保护作用。
晶状体上皮细胞在晶状体的整个生命周期中负责晶状体纤维的分化[9]。正常的分化和形态可以维持晶状体的正常透明度,而晶状体上皮细胞的发育、增殖、分化和凋亡的病理改变可能导致白内障。EMT是一种广泛存在于真核生物体内自然发生的细胞生物学程序,可将上皮细胞转化为更多间充质细胞状态的细胞[10-11],并在各种病理过程中起着重要作用,包括伤口愈合、组织纤维化和癌症进展[4,12-13]。在这个过程中,晶状体上皮细胞失去了正常的形态特征和转录程序,但是获得了间充质细胞的表型特征,包括更强的迁移能力、抗凋亡能力和侵袭性,增加了细胞外间质成分的产生等。然而,EMT调节糖尿病性白内障的分子机制仍有待于进一步探讨。其中miRNAs是机制研究的热点[14]。本研究发现,高糖条件下可诱导HLE-B3细胞中miR-29b表达降低,同时细胞形态向间充质特征转化。在EMT过程中,HLE-B3细胞失去了一些上皮特有的特征,包括E-Cadherin表达减少,典型的间充质细胞特性增强,如Vimentin和N-Cadherin表达增加。这说明高糖促进晶状体上皮细胞发生EMT,而EMT是参与糖尿病性白内障形成的关键环节。
研究表明,上皮细胞向间充质细胞转化受到miRNAs的调控[9,12],因此,miRNAs被认为是参与眼睛发育和疾病发生的重要功能性分子。Liu等[15]证实miR-199a在糖尿病性白内障囊膜组织和高糖条件下的晶状体上皮细胞中表达下调,而且miR-199a被证实可以直接靶向调控SP-1蛋白表达,进而抑制糖尿病性白内障患者晶状体上皮细胞发生EMT。Ye等[16]也发现高糖可抑制miR-144-3p表达,进而通过ROS/NRF2/Notch1/Snail途径影响晶状体上皮细胞EMT进程。本研究通过转染miR-29b mimics质粒上调HLE-B3细胞中miR-29b表达,进而抑制SP-1 mRNA转录和翻译, 从而阻止高糖诱导的HLE-B3细胞EMT进程。生物信息学工具预测,SP-1 mRNA是高度守恒的,是miR-29b的重要目标。SP-1是SP/Kruppel-like因子超家族成员,是许多管家基因转录所需的。其过度表达与细胞的异常分化有关,而SP-1的下调会加重内质网应激和未折叠蛋白反应[17]。SP-1亦可以通过相关基因来调节肿瘤细胞的增殖、EMT和侵袭过程[18]。本研究中,EMT被证实与高糖诱导作用有关,在经高糖处理的HLE-B3细胞中发现E-Cadherin蛋白表达降低,同时N-Cadherin和 Vimentin 蛋白表达增强。双荧光素酶报告基因分析证实SP-1直接受到miR-29b的调控。上调SP-1表达可逆转miR-29b对HLE-B3细胞EMT进程的抑制作用。这些结果都表明,上调miR-29b可能通过调节SP-1表达影响HLE-B3细胞EMT进程,进而延缓或阻止糖尿病性白内障的发生发展。说明miR-29b-SP-1-EMT网络在糖尿病性白内障的发展中起到一定作用,这为糖尿病性白内障发病机制的研究提供了新思路。
综上所述,本研究证实了miR-29b在糖尿病性白内障体外细胞模型中表达下调。上调miR-29b表达可通过靶向SP-1基因参与抑制高糖诱导晶状体上皮细胞EMT的进程。这些结果为研究糖尿病性白内障发生发展的分子机制提供了新的视角,同时,miR-29b、SP-1可能成为糖尿病性白内障治疗的新靶点。
