胃癌根治术后肺部并发症相关危险因素分析及预测模型构建
2022-01-18欧阳军程泽伟梁贻泽黄亚迪陈园园于文滨
钟 鑫,朱 薇,魏 猛,欧阳军,程泽伟,梁贻泽,黄亚迪,陈园园,于文滨
(1.山东大学齐鲁医院普通外科,山东 济南,250012;2.山东医学高等专科学校护理系;3.山东大学齐鲁医院后勤保障处)
胃癌是全球发病率与死亡率最高的癌症之一[1]。我国胃癌患者确诊时多已处于进展期[2-3],对于这部分患者,目前临床标准治疗方式为根治性胃切除联合D2淋巴结清扫术[4]。据统计,全世界每年进行的手术超过2.3亿次[5],大型手术后出现肺部并发症的发生率为1%~23%[6]。其中,腹部手术已被证明是术后肺部并发症的高风险手术之一[7],与下腹部手术相比,上腹部手术后发生肺部并发症的风险高达15倍[8]。肺部并发症一旦发生,可延长住院时间1~2周[9]。胃癌根治术作为手术难度与复杂程度最高的上腹部手术之一,术后肺部并发症发生风险较高,而并发症的出现亦严重影响胃癌患者的术后恢复。目前国内外研究发现[10-12],年龄、性别、体重指数、腹腔镜手术、手术时间等为术后肺部并发症发生的独立危险因素,但鲜有研究针对这些因素制定合理的风险评估策略。预测模型是预后研究中,采用单因素及多因素分析的方法确定所研究结局的危险因素,并依此建立预测模型列线图。其优势在于能更直观地量化与评估不同预测因子组合下结局出现的概率。本研究旨在通过回顾分析胃癌患者的临床资料,分析术后发生肺部并发症的危险因素,构建术前预测模型,评估手术后并发症的风险,以期指导临床对胃癌患者的围手术期管理,预防与减少术后肺部并发症的发生。
1 资料与方法
1.1 研究对象 本研究回顾性收集2017年1月至2018年12月山东大学齐鲁医院胃肠外科行胃癌根治术的临床资料及其肺部并发症情况(建模组),以相同方法收集2019年1月至2020年6月同一机构接受相同手术治疗的胃癌患者的临床资料并纳入验证组。入组标准:(1)术后病理证实为胃癌(包括腺癌、印戒细胞癌等),病理分期为T1b~T4a;(2)行R0胃癌根治术。排除标准:(1)合并其他恶性肿瘤;(2)术前接受新辅助化疗;(3)胃癌远处转移(M1)或联合多脏器切除;(4)术后出现其他严重并发症:吻合口漏、腹腔出血二次手术、死亡等;(5)临床资料不全。
1.2 研究终点 本研究的终点为胃癌根治术后出现肺部并发症。术后肺部并发症根据2015年欧洲联合工作组发布的围手术期临床结局的指南定义,将术后新出现的肺部炎症、呼吸道感染、呼吸衰竭、胸腔积液、肺不张、肺栓塞等归类为术后肺部并发症[13],且手术并发症严重程度Clavien-Dindo分级≥Ⅱ级,即术后出现需要药物、外科等治疗的并发症[14]。其中临床诊断为肺部并发症的标准具体包括:(1)出现任一肺部异常症状:异常呼吸频率、异常呼吸音、痰液增多伴或不伴颜色变化;(2)出现任一异常体征:低氧血症(血氧饱和度≤92%)、发热且体温大于38.0℃;(3)接受任一肺部特殊治疗:限制级抗生素、胸腔穿刺、气管插管等;(4)出现任一异常化验指标:血常规示白细胞计数>11×109/L、前降钙素原>0.5 ng/mL、痰液涂片或痰液培养中发现致病菌;(5)异常肺部影像学:胸部CT提示有新出现的肺部浸润、肺部实变、胸腔积液、肺不张或肺栓塞等影像学表现。确诊依据:当上述(1)、(2)、(3)同时出现,且(4)、(5)最少出现1项,则可确诊为术后肺部并发症。
1.3 统计学处理 采用R软件3.6.1、SPSS 25.0进行数据分析。连续变量的表达方式包括平均值、标准差。分类变量的表达方式包括百分比、最小值及最大值。单因素Logistic分析确定术后肺部并发症的相关高危险因素中,将P<0.1的变量纳入多因素Logistic分析中确定独立风险因素。最优子集回归分析将术前/术中的风险因素进行筛选,选出预测模型拟合度最优的模型变量,并由多因素Logistic回归分析得出模型变量与术后肺部并发症的关联强度比值比(odds ratio,OR),依此建立预测模型列线图。验证预测模型的可靠性及预测能力的方法包括协调指数、受试者工作特征(receiver operating characteristic,ROC)曲线、校准图。
2 结 果
2.1 患者的临床特征 建模组共纳入485例,验证组共纳入173例。建模组中男372例(76.7%),女113例(23.3%),男女比例接近3:1;24~86岁,BMI>27 kg/m2者约占五分之一(19.8%);约一半的患者有吸烟史(44.7%)。高血压(23.5%)为术前最常见基础疾病,其余为贫血(16.4%)、糖尿病(11.1%)、心脏病(8.9%)、低白蛋白血症(5.2%)等。术前检查及评估中,ASA评分Ⅲ级22例(4.5%)、中度通气功能障碍10例(2.1%)、重度通气功能障碍9例(1.9%)。
2.2 术后肺部并发症的危险因素分析 建模组485例中,101例(20.8%)出现肺部并发症,其中胸腔积液70例,肺部感染69例,肺不张46例,胸膜增厚11例,肺栓塞5例。术后出现肺部并发症的患者较无肺部并发症的患者住院时间延长[(16.1±8.0)d vs.(10.8±3.7)d,P<0.05]。
建模组单因素Logistic回归分析结果显示,年龄>50岁、男性、合并慢性基础病(心脏病、糖尿病、高血压)、中/重度肺通气功能障碍、ASA评分Ⅲ级、全腹腔镜手术、手术时间>5 h更容易发生肺部并发症(P<0.05),见表1。多因素Logistic回归分析结果显示,年龄>50岁、中/重度肺通气功能障碍、手术时间>4 h为术后肺部并发症的独立危险因素(P<0.05),见表2。验证组单因素Logistic回归分析结果显示,近端胃与全胃切除患者更容易发生肺部并发症(P<0.05),多因素分析显示近端胃与全胃手术是术后肺部并发症的独立危险因素(P<0.05)。
2.3 预测模型的建立 最优子集回归分析结果筛选出的14个模型风险因素分别为:性别、年龄、BMI、吸烟史、心脏病、糖尿病、高血压、低白蛋白血症、贫血、ASA麻醉评分、肺功能检查、胃切除范围、手式方式及手术时间,见图1,此时拟合系数R2指数为0.094,预测模型拟合度最佳。多因素Logistic回归分析了模型变量与术后肺部并发症的关联强度OR值,并成功建立了胃癌根治术后肺部并发症的预测模型列线图,见图2。
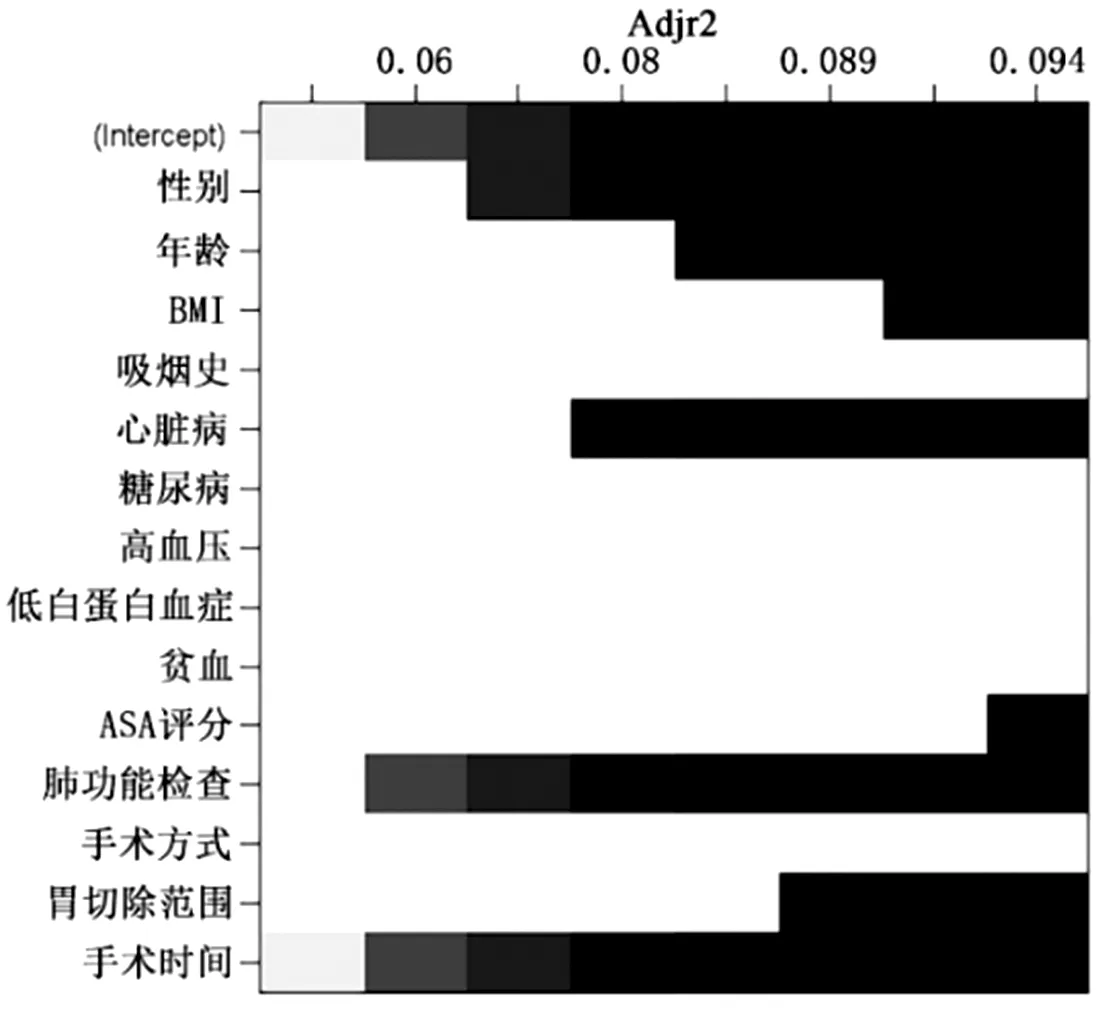
图1 最优子集回归分析(横坐标为Adjust R2指数,R2指数越大,越接近于1则说明回归模型拟合度越好。纵坐标为本研究的术前及术中相关临床变量,黑色方块代表预测模型选中的变量)
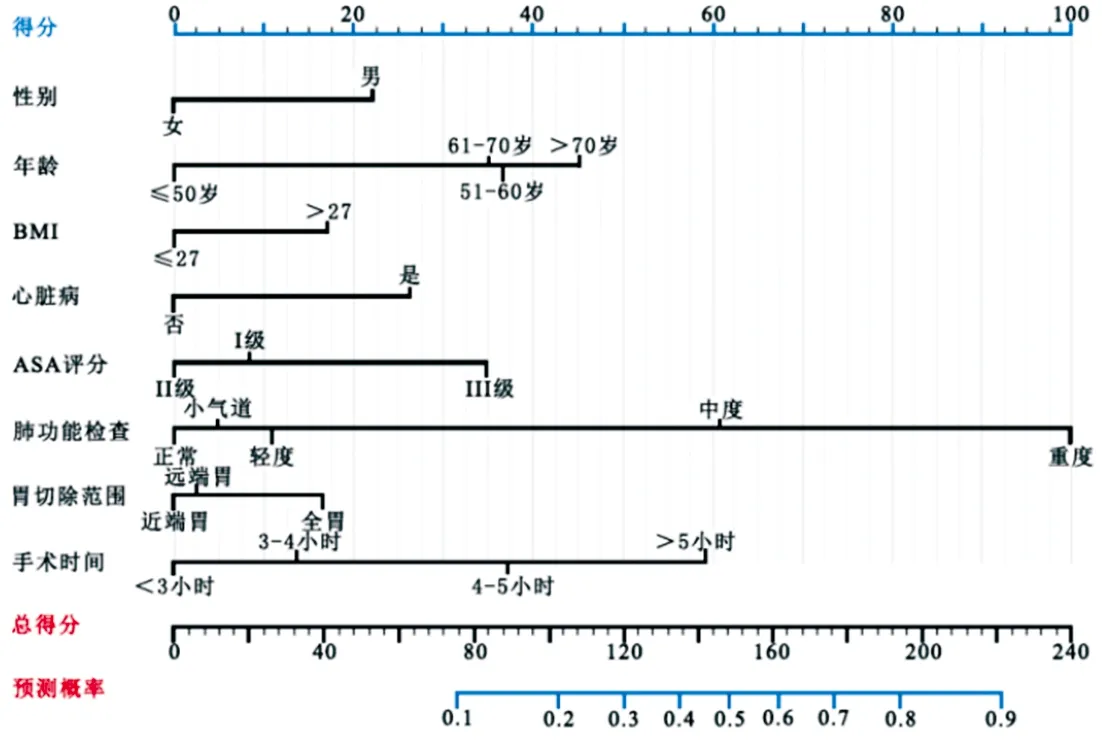
图2 术后肺部并发症的预测模型列线图(胃癌患者的一般临床特征得分分配在每个变量轴上,每个对应变量根据所处的位置均在蓝色得分轴上获得相应分数。将这些变量的总得分累加,并于总得分线轴上对应,最后向下画一条线定位于预测概率的蓝线上,即可确定胃癌根治术后发生肺部并发症的发生概率)
2.4 预测模型的验证 验证模型可靠性及预测能力的ROC曲线、校准图见图3、图4。在二分类Logistic多因素分析中,协调指数即为ROC曲线的曲线下面积。图3显示,模型组ROC曲线下面积=0.767,95%CI:0.716-0.817,验证组ROC曲线下面积=0.718,95%CI:0.631-0.805,均大于0.70,体现了模型具有较好的预测能力。图4校准图中,建模组(A)与验证组(B)的预测曲线与实际曲线匹配程度可,显示该模型在建模组与验证组的临床实际中具有较好的实用性。
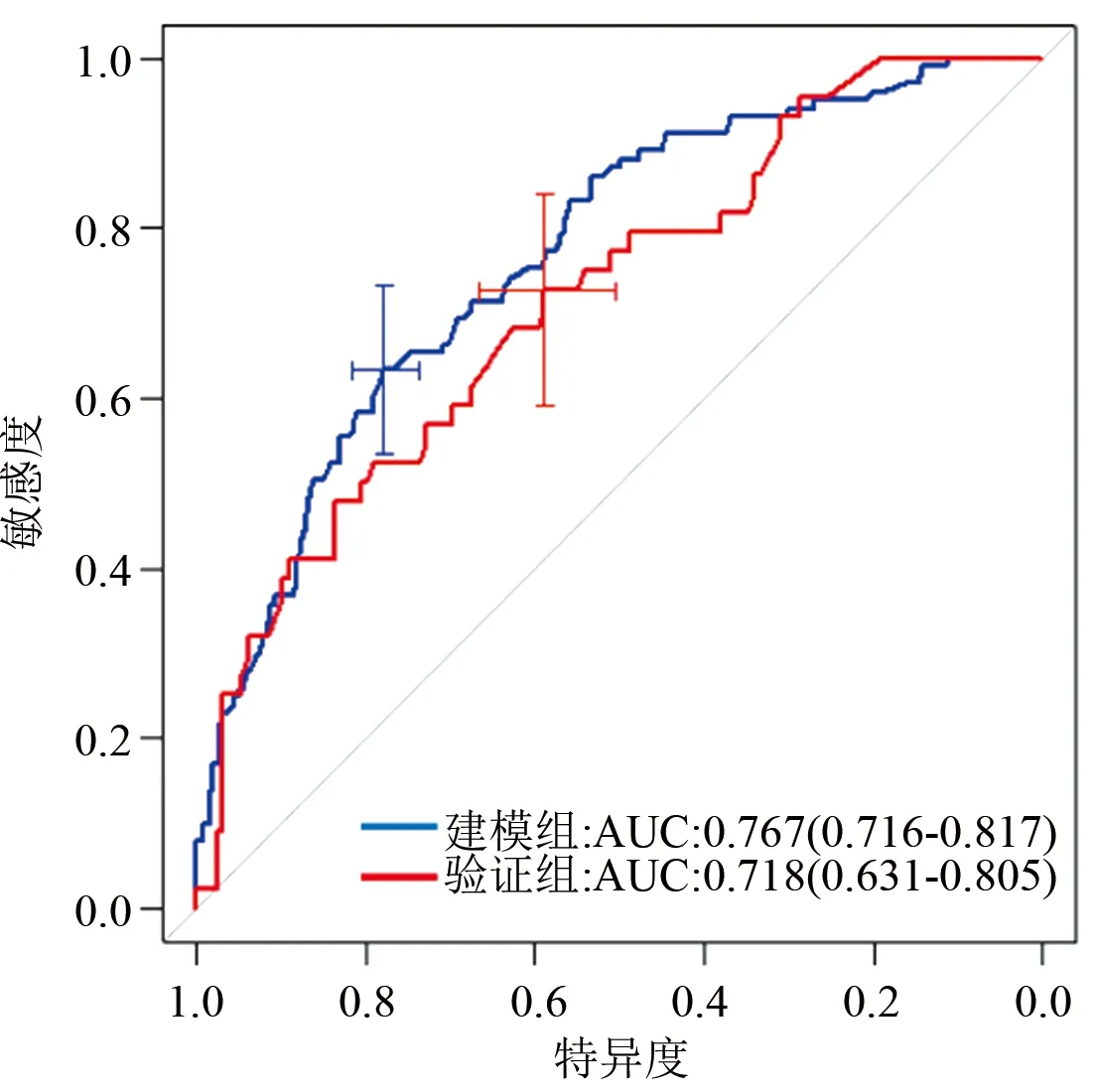
图3 ROC曲线图(纵轴是敏感度,横轴是特异度。AUC即曲线下面积,曲线下面积越大且越接近1,代表预测模型的准确度越高,黑色虚线为参考线)
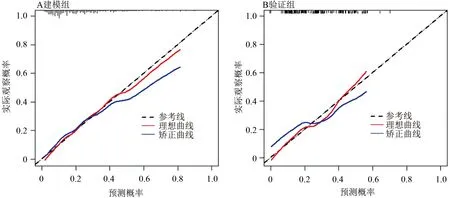
图4 预测模型的校准图(校准图显示红线为理想曲线,蓝线为矫正曲线,虚线为实际参考线;两条曲线越接近,且与参考线越接近,则显示与实际情况相比越具有较好的适用性与匹配性)
3 讨 论
本研究发现,胃癌根治术后肺部并发症发生率高达20.8%。Brooks-Brunn等[8]报道561例腹部手术,术后肺部并发症发生率为22.5%,这与我们的研究相近。本研究中,中/重度通气功能障碍患者发生肺部并发症的风险明显增高[OR=6.11(1.46-28.37),OR=21.05(4.19-163.75),P<0.05]。Yang等[15]的研究纳入了9 595例腹部手术患者,发现严重慢性阻塞性肺疾病是独立危险因素之一,这与我们的结论相似。肺功能检查是临床诊断患者呼吸系统疾病的重要方法之一[16-18]。严重慢性阻塞性肺疾病的肺功能往往表现为中/重度通气功能障碍。然而,肺功能检查结果并不能完全说明患者术后肺并发症的高风险[19]。在轻度/小气道通气功能障碍患者中却难以识别其差异与风险。因此,靠肺功能检查的单一变量并不能准确预测患者术后肺并发症发生概率[19]。对于已知或疑似肺部疾病的患者,术前行肺功能检查,如发现中/重度通气功能障碍,则提示术后肺部并发症风险较高;如仅提示轻度/小气道通气功能障碍,则需结合其他危险因素综合评估。
大量研究证实,手术时间与术后肺部并发症的发生高度相关。Kodra等[20]的研究发现,腹部手术中手术时间≥2.5 h与术后肺部并发症显著相关。本研究同样证实了这一点,手术时间延长是术后肺部并发症的独立危险因素,其中手术时间>5 h的患者肺部并发症风险是手术时间<3 h患者的6倍。全麻手术时间越长,即呼吸机机械通气时间越长,导致肺过度扩张与气道黏膜损伤,进而增加了肺部并发症的发生。对于经验丰富的外科医生,手术时间往往反映了手术的复杂性,如术中腹腔粘连程度、组织健康程度、肿瘤侵犯程度或其他意外,如大出血等。因此对于存在已知或疑似肺部疾病、或合并其他术后肺部并发症危险因素的患者而言,术中操作难度增加,如腹腔镜手术中发现腹腔严重粘连或组织严重水肿等,应中转开腹,选择更高效、熟练的手术方式尽快完成手术。
高龄也是术后肺部并发症的独立风险因素之一[21-24],本研究中年龄>70岁的胃癌患者术后肺部并发症发生风险约为50岁以下患者的4倍。分析该风险可能是老年患者术后恢复能力差,卧床时间较长,咳嗽咳痰能力较差,术后腹部切口疼痛抑制呼吸等多种因素联合作用增加了老年患者肺部并发症发生率。此外,老年患者往往合并许多慢性基础性疾病,如心、脑血管、内分泌疾病等,这也是高龄增加术后肺部并发症发生风险的一个重要原因。
高血压、心脏病、糖尿病等基础合并症是术后发生并发症的重要危险因素[25-28],本研究的单因素Logistic回归分析发现,心脏病(OR=2.22,P=0.020)、糖尿病(OR=1.90,P=0.043)、高血压(OR=1.68,P=0.032)可增加术后肺部并发症发生风险。多因素Logistic回归分析中,合并心脏病趋向于显著性差异(P=0.063)。因此,合并慢性基础病的患者围手术期建议常规应用预防性干预措施,如对血压、血糖的控制,冠心病患者应用营养心肌药物等,可在减少术后肺部并发症方面起到较好作用。
此外,部分研究表明[8,25-28],性别、BMI、胃切除范围等与术后肺部并发症的发生有关。本研究的预测模型中同样纳入了这些风险因素,其中男性(76.7%)约是女性(23.3%)的3倍,单因素与多因素分析显示,男性发生肺部并发症的概率约是女性的2倍,这可能与胃癌多发于男性有关[27],并且约半数的男性胃癌患者有吸烟史,尽管我们的研究发现,吸烟并非胃癌根治术后肺部并发症的危险因素,造成这一结果的原因可能与围手术期接受雾化治疗有关。单因素与多因素Logistic分析显示,高BMI的患者在术后肺部并发症中的差异并非十分显著(P=0.093/0.102)。但临床发现,高BMI患者不仅会增加术中视野的分辨难度,而且其自身容易合并糖代谢异常、肺顺应性低等情况,这可能导致肺部并发症的发生。本研究还发现,验证组的多因素分析结果显示,与远端胃根治术相比,近端胃与全胃根治术的风险几乎是前者的3倍。试分析其原因为近端胃与全胃切除术中需要裸化膈下食管,食管胃肠吻合口与胸腔关系密切,手术难度较高,手术时间相对较长,从而增加了术后肺部并发症的风险。
本研究通过单因素及多因素Logistic回归分析确定术后肺部并发症的相关危险因素,通过最优子集回归分析筛选的模型变量建立胃癌根治术后肺部并发症的预测模型。可以发现在建模组与验证组中,两组单因素与多因素分析结果得出的具有显著性差异的危险因素并不完全一致,这可能与验证组数量较少有关。然而,该预测模型在两组中均体现了较好的预测能力及可靠性。预测模型的风险因素包括患者的术前状况:性别、年龄、BMI、吸烟史、心脏病、糖尿病、高血压、低白蛋白血症、贫血、ASA评分、肺功能检查;术中治疗相关因素:胃切除范围、手术方式、手术时间。预测模型列线图将每例胃癌患者的一般临床特征得分分配在每个变量轴上,通过计算这些变量的总得分,即可获得术后肺部并发症的预测概率。本研究将预测术后肺部并发症发生概率≥50%的胃癌人群定义为高风险组,<50%的胃癌人群定义为低风险组。根据该预测模型风险分层,对于高风险组的胃癌患者,建议医生采取更为积极的干预措施,以减轻肺部并发症的发生风险,如手术前后的咳痰训练、雾化吸入、吸痰措施等;对于低风险组患者可适当减少相应药物的用量,以减轻患者负担。
本研究的优势为基于近3年的胃癌临床诊疗数据,探讨影响患者术后并发症的危险因素;通过综合各危险因素建立预测模型列线图,直观地预测胃癌根治术后短期肺部并发症的发生率。本研究也存在一定的局限性,部分临床数据缺失,如术中出血量、疼痛管理、镇痛药物的使用等。因此,我们尚需要大规模、前瞻性的多中心研究进一步分析。
综上所述,胃癌根治术后肺部并发症的预测模型与性别、年龄、BMI、吸烟史、心脏病、糖尿病、高血压、低白蛋白血症、贫血、ASA评分、肺功能检查、胃切除范围、手术方式、手术时间相关,年龄>50岁、中度/重度肺通气功能障碍、手术时间>4 h是胃癌患者术后肺部并发症的独立危险因素。建立术后肺部并发症的预测模型,可作为术前评估工具,以指导胃癌患者围手术期的治疗,更有效地预防术后肺部并发症的发生。
