2株牛源多杀性巴氏杆菌的分离鉴定及生物特性
2022-01-17徐高原周明光张华伟郝根喜向文杰
高 尚,徐高原,周明光,张华伟,郝根喜,陈 波,顾 强,向文杰
(武汉科前生物股份有限公司,湖北 武汉 430000)
多杀性巴氏杆菌(Pasteurellamultocida,Pm)属革兰阴性菌,可通过消化道和呼吸道等传播方式感染多种畜禽。Pm在世界范围内多呈急性流行,能够引起感染动物多种症状,包括食欲下降、体重减轻、水肿和腹泻,最终可能导致患病动物死亡[1]。预防多杀性巴氏杆菌主要采用疫苗手段,但Pm具有多种血清型,且不同血清型均能够引起不同性质的疾病[2],交叉保护能力弱,而抗生素的使用又容易产生耐药菌株,所以该病还未能得到有效控制。
研究数据表明,我国牛群多感染A、B型巴氏杆菌,引起严重的纤维素性肺炎及出血性败血症[3]。其中,A型巴氏杆菌主要能够引起犊牛的肺炎,而B型巴氏杆菌主要引起成年牛的出血性败血症[3]。本试验从广州一养殖场患有呼吸道疾病的病死犊牛中分离出2株荚膜A型多杀性巴氏杆菌,并对其分子生物学特点进行研究,旨在为临床诊治该病提供理论依据。
1 材料与方法
1.1 病料 广州一规模化养牛场病死犊牛,剖检发现肺脏严重出血,呼吸道伴有黏液渗出,肝脏出血淤血。采集肺脏及肝脏组织进行病原分离。
1.2 主要试剂 TSA(Tryptic soy agar)和TSB(Tryptic soy broth)培养基,均购自DB Biotech生物科技有限公司;新生牛血清,购自内蒙古金源康生物工程有限公司;药敏试纸片,购自杭州滨和微生物试剂有限公司;革兰染液和瑞士染液,均购自南京建成科技有限公司;引物合成及基因测序由擎科生物技术有限公司完成。
1.3 实验动物 SPF级雄性昆明小鼠55只,4~6周龄,体重(18±2)g,购自华中农业大学实验动物中心。
1.4 细菌分离 无菌挑取病死牛的肺脏及肝脏组织,均匀涂划在两组5%新生牛血清的TSA平板中。分别置于有氧及无氧条件下,37 ℃条件下培养24 h,观察结果。24 h后于无菌条件下挑取平板上的菌落三区划线接种于5%新生牛血清的TSA平板上,于37 ℃条件下培养24 h,再挑取单个菌落进行革兰染色和瑞士染色,观察细菌形态。
1.5 细菌鉴定 采用高温裂解法提取细菌DNA。以16S rRNA作为鉴定引物,进行PCR扩增,序列为F:5′-AGAGTTTGATCCTGGCTCAG-3′,R:5′-GGTTACCTTGTTACGACTT-3′,预期目的条带大小为1 475 bp。
切取目的条带,采用Hingene琼脂糖凝胶回收试剂盒回收DNA,将回收纯净的DNA连接至pMD 18-T载体上并转入至DH10B感受态细胞内,加入1 mL无抗LB摇菌30 min后,吸取100 μL菌液在Amp抗性的LB平板中培养过夜。挑取LB平板上5个不同的单菌落,分别置于5个装有LB的EP管中进行摇菌培养,6 h后吸取部分菌液进行16S rRNA PCR鉴定,将出现阳性条带的对应菌液送检测序。
通过16S rRNA测序结果可知2株分离菌均为多杀性巴氏杆菌,命名为KQ-Pm-A1和KQ-Pm-A2,设计分型引物进一步对菌株进行分型,见表1。

表1 多杀性巴氏杆菌分型引物Table 1 Typing primer of Pasteurella multocida
1.6 16S rRNA进化树分析 根据测序结果,在NCBI上进行BLAST比对,选取不同国家、不同地区的多杀性巴氏杆菌16S rRNA序列进行系统发育树分析。采用Clustal W多序列比对处理序列,并用MEGA 7软件以最大似然法(Maximum likelihod)构建进化树。
1.7 药敏试验 采用琼脂扩散方法进行药敏试验,将新霉素、美洛西林、多西环素等16种常规药敏纸片置于细菌平板上培养,24 h后量取抑菌圈直径。药敏结果判定按照杭州滨和微生物试剂有限公司发布的标准进行。
1.8 生长曲线的绘制 于无菌操作台内使用接种环挑取纯化后的单个菌落混入装有5 mL 5%新生牛血清的TSB培养液中,另做一组空白对照。37 ℃条件下,1 600 r/min培养18 h,作为种子液。取3瓶装有无菌100 mL 5%新生牛血清TSB培养液的锥形瓶,将种子液按照1%的量加入至2瓶锥形瓶中,另1瓶作为对照。37 ℃条件下,1 600 r/min 摇瓶培养32 h, 并在第2、4、6、8、10、12、24、32小时取少量菌液测定不同时间段菌液OD600 nm值及梯度检验活菌数。每个浓度均做3个重复,取平均值绘制曲线。
1.9 小鼠攻毒试验 采用半数致死量(LD50)评价2株分离菌的致病性。取50只雄性昆明小鼠,随机分为10组,每组5只。调整KQ-Pm-A1初始浓度为1.2×109CFU/mL,KQ-Pm-A2初始浓度为1.01×109CFU/mL。每株分离菌均10倍倍比稀释为10-5~10-9共5个 梯度,每个梯度攻毒一组小鼠,腹腔注射菌液0.2 mL,另取5只小鼠腹腔注射0.2 mL生理盐水作为对照。连续观察14 d、记录各组死亡情况,对死亡小鼠立即剖检,观察病理变化并对各脏器进行细菌分离、鉴定,根据Reed-Muench累加法计算分离菌株的半数致死量(LD50)。
2 结果
2.1 细菌的分离 两组平板中均长出散在的菌落,说明分离菌兼性厌氧。经过纯化培养后,可见平皿上长出圆润光滑、半透明、灰白色的菌落。通过革兰染色和瑞士染色,镜检可见菌株为革兰阴性短小杆菌,菌体呈现两端浓染的现象,见图1、2。
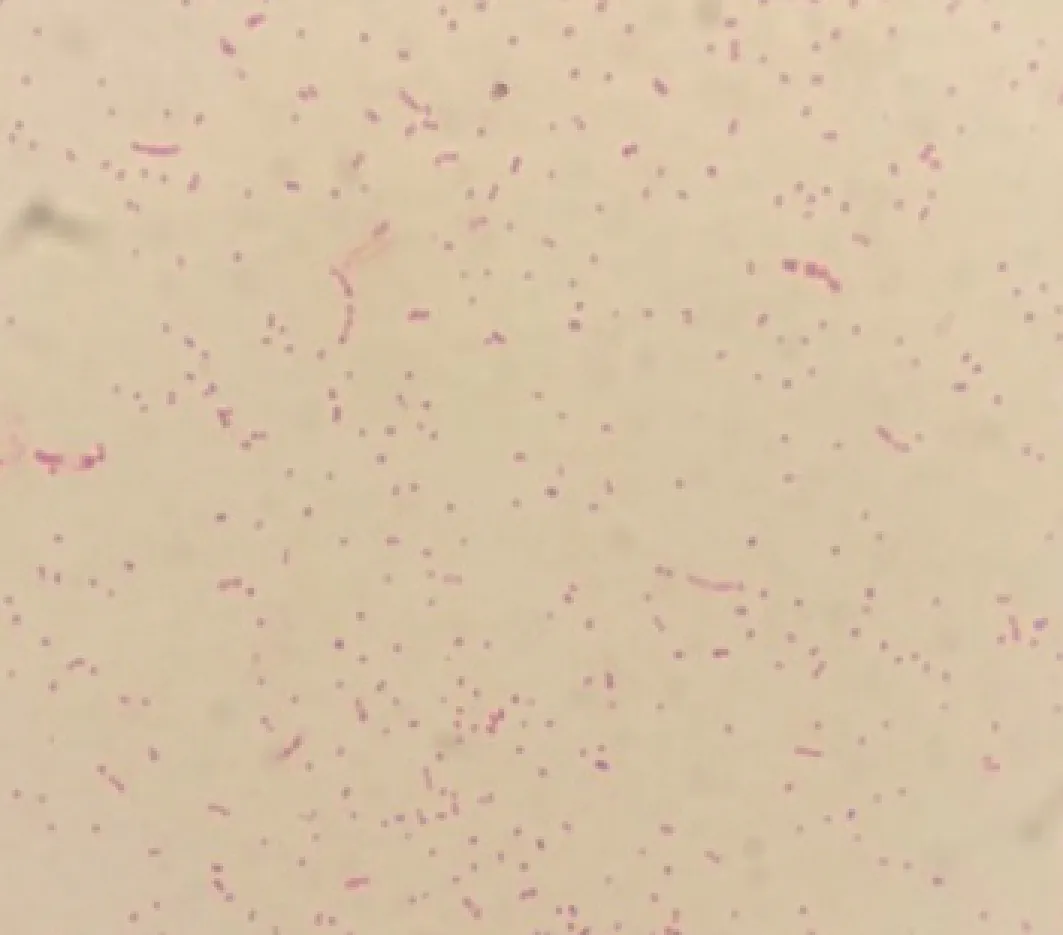
图1 革兰染色结果(1 000×)Fig.1 The result of Gram staining
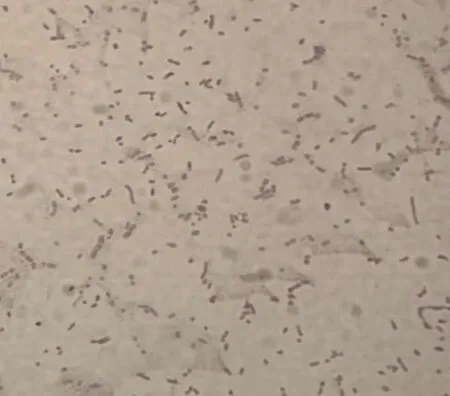
图2 瑞士染色结果(1 000×)Fig.2 The result of Wrightm staining
2.2 细菌的鉴定 对分离得到的2株分离菌进行16S rRNA PCR扩增,发现2株分离菌均在1 475 bp产生与阳性对照一致的条带,见图3。同时,进行多杀性巴氏杆菌分型PCR扩增,发现2株分离菌均在1 044 bp处产生与A型阳性对照相同的条带,证明2株分离株为A型多杀性巴氏杆菌,命名为KQ-Pm-A1及KQ-Pm-A2,见图4。通过对16S rRNA切胶回收测序发现,KQ-Pm-A1与GenBank上CP033597.1株同源性达99.80%;KQ-Pm-A2与GenBank上CP015573.1株同源性达99.93%。
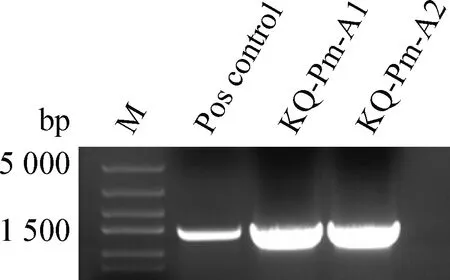
图3 16S rRNA PCR扩增结果Fig.3 Amplification of 16S rRNA gene by PCR
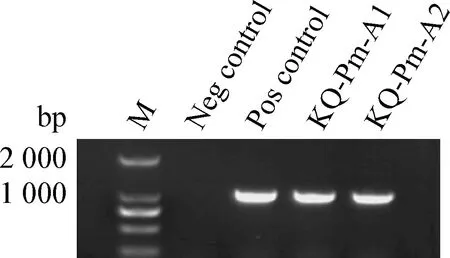
图4 荚膜A型PCR扩增结果Fig.4 Amplification of capsule type A gene by PCR
2.3 16S rRNA进化树分析 根据16S rRNA的序列,选取GenBank中已发表的国内外多地区多杀性巴氏杆菌16S rRNA序列,利用MEGA 7软件成功构建出有根,基于单个基因建立的系统进化树见图5。可见KQ-Pm-A1与KQ-Pm-A2同属一个分支,与国内菌株相比,分离株与海南株同源关系较近,与湖南株、湖北株、湘潭株同源关系较远。同国外菌株相比,2株分离菌与丹麦、德国、日本、美国、埃及、马来西亚分离株同源性关系较远。其中,荚膜A型多杀性巴氏杆菌长沙分离株与荚膜A型多杀性巴氏杆菌美国蒙哥马利分离株被归属同一支,英国分离株同埃及分离株同源关系较近、日本分离株与湖南分离株也有较近的同源性,这些结果提示菌株可能存在相近的遗传进化关系,表明了多杀性巴氏杆菌的全球流行趋势。
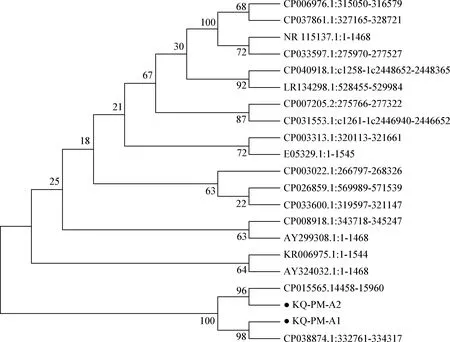
图5 多杀性巴氏杆菌16S rRNA遗传进化树Fig.5 Genetic tree of 16S rRNA gene in Pasteurella multocida•: 本试验分离菌•: Isolated bacteria in this experiment
2.4 生长曲线绘制 将KQ-Pm-A1与KQ-Pm-A2两株菌均以1∶100转接至5%新生牛血清TSB培养液中,定时取出菌液进行OD600 nm值测定及活菌计数,绘制曲线,见图6。结果显示,2株分离菌生长趋势大致相同,约在6 h进入平台期,12 h后进入衰退期。
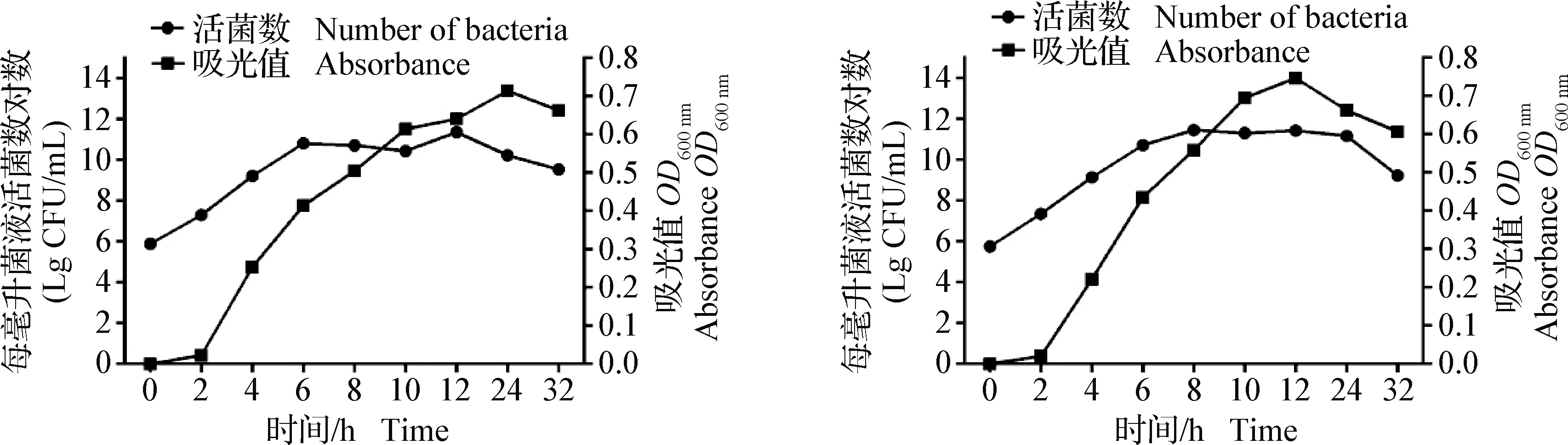
图6 2株多杀性巴氏杆菌生长曲线Fig.6 Growth curve of two strains of Pasteurella multocida

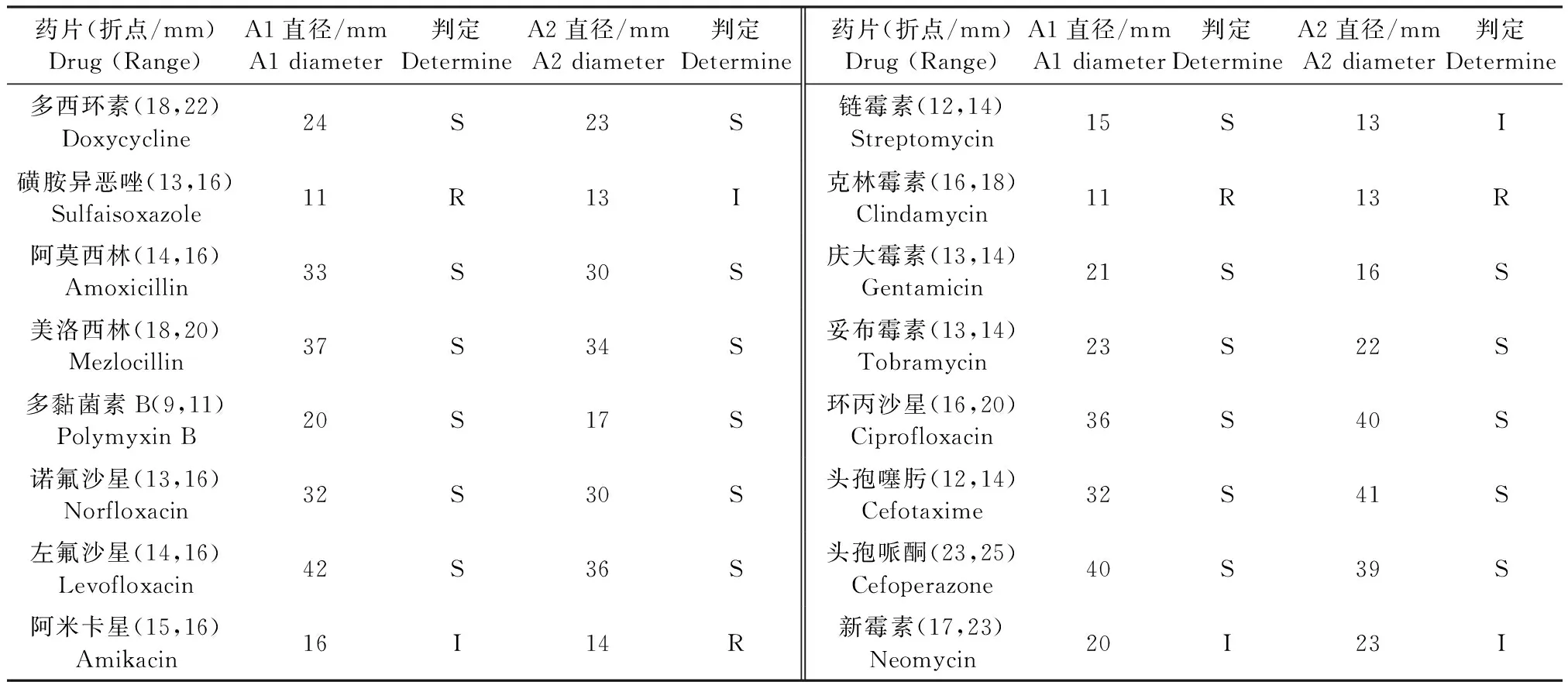
表2 2株多杀性巴氏杆菌的药敏结果Table 2 Results of drug sensitivity of two strains of Pasteurella multocida
2.6 小鼠攻毒试验 昆明小鼠腹腔注射不同浓度的KQ-Pm-A1及KQ-Pm-A2后,均表现出被毛逆乱、精神沉郁、食欲废绝、畏寒等症状,而对照组精神状态表现正常。
2.6.1 病理学观察 腹腔注射KQ-Pm-A1及KQ-Pm-A2后,高剂量急性死亡小鼠均表现出严重的出血症状,包括鼻腔、脚部、心脏、肝脏、脾脏、肺脏、肾脏,腹腔粘连,肠黏膜脱落并伴有出血斑,见图7。中、低剂量慢性死亡小鼠主要出现心脏及肺脏包裹炎症渗出物,肝脏大面积淤血,脾脏肿大等症状,见图8。低剂量攻毒后14 d未死亡小鼠及对照组小鼠,剖检未见病理变化。
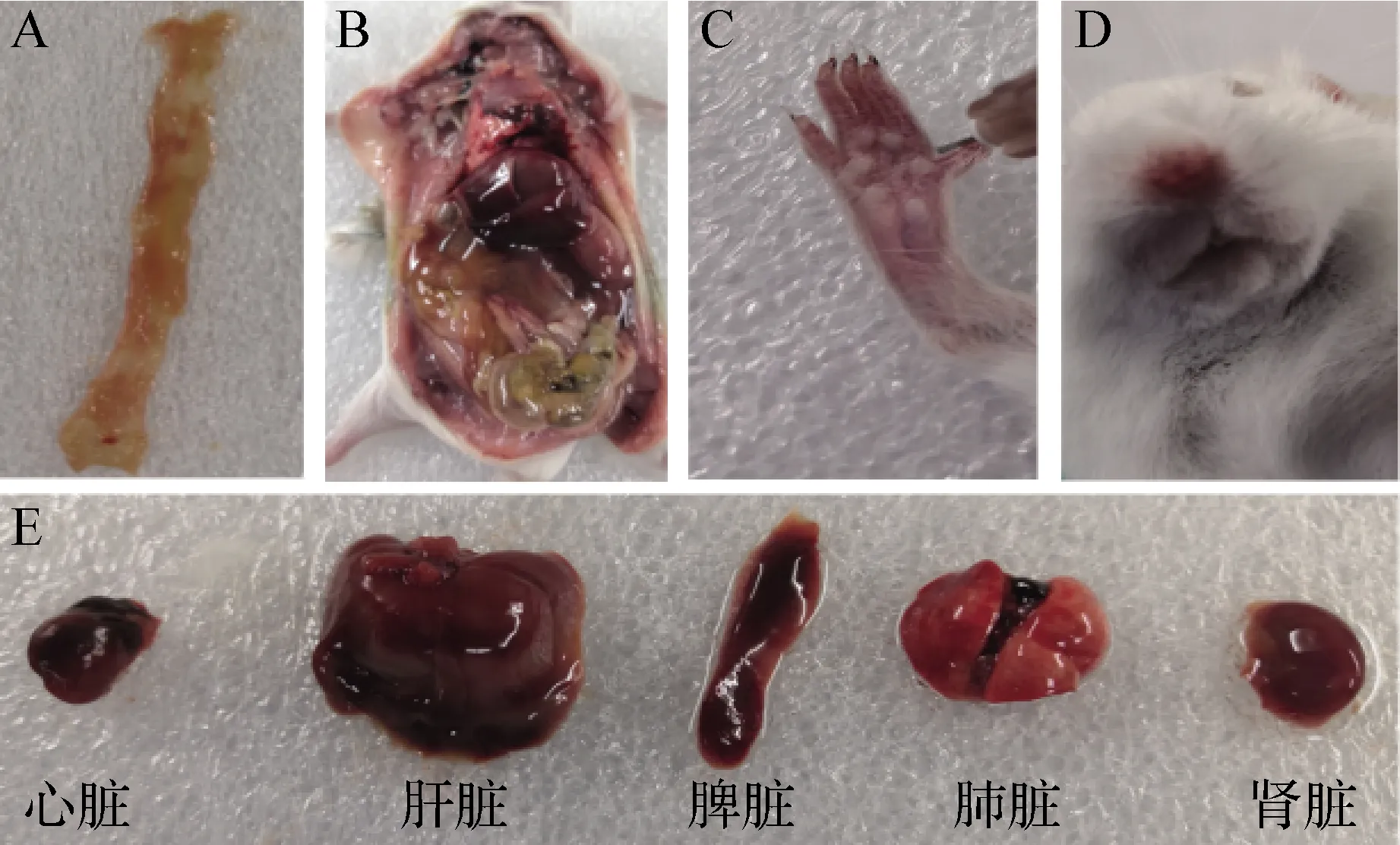
图7 急性死亡小鼠病理学观察Fig.7 Pathological observation of acute dead miceA:肠黏膜脱落、出血; B:腹腔积液; C:脚部出血; D:鼻腔出血; E:各脏器出血A:Intestinal mucosa shedding and bleeding; B:Abdominal effusion; C:Foot bleeding; D:Nasal bleeding; E:Bleeding from various organs
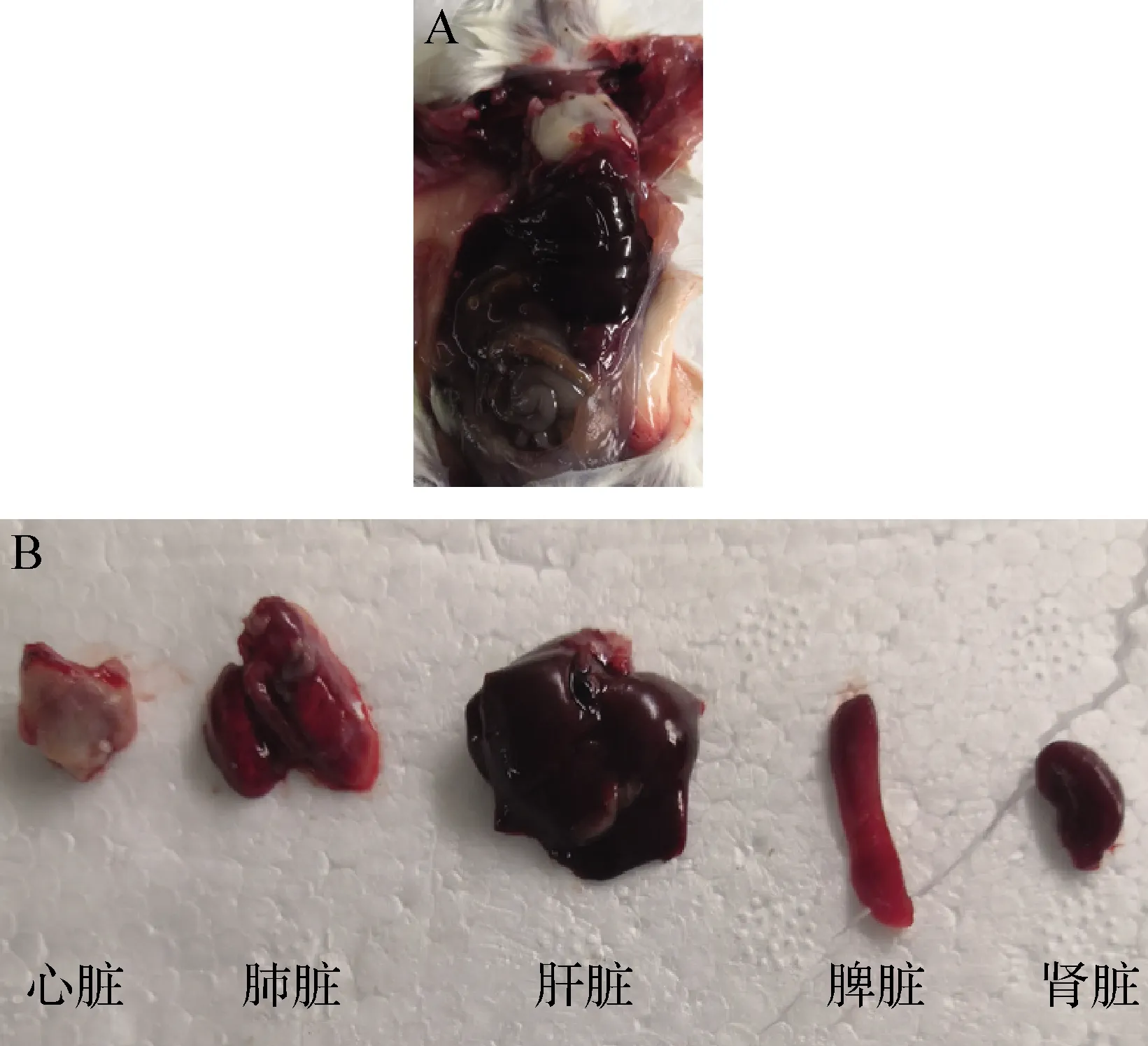
图8 慢性死亡小鼠病理学观察Fig.8 Pathological observation of chronic dead miceA:心包炎; B:各脏器充血病变A:Pericarditis; B:Congestive lesions of various organs
2.6.2 脏器细菌分离 剖检死亡小鼠,取各脏器在无菌操作台内进行细菌分离。结果显示,2株多杀性巴氏杆菌攻毒后,死亡小鼠各脏器均能分离出细菌。对各脏器分离出的细菌进行PCR鉴定,发现均为A型多杀性巴氏杆菌,见图9。
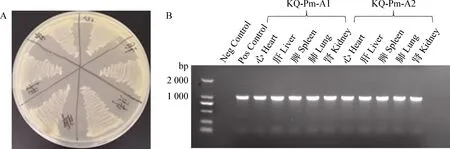
图9 攻毒小鼠各脏器细菌分离鉴定Fig.9 Isolation and identification of bacteria in various organs of challenged miceA:脏器细菌分离结果; B:分离菌PCR鉴定结果A:Separation results of viscera bacteria; B:PCR identification results of isolated bacteria
2.6.3 LD50的测定 4周龄小鼠腹腔注射不同浓度A型多杀性巴氏杆菌后,总体死亡趋势随着攻毒浓度的降低而降低,空白对照组无死亡。累计法计算KQ-Pm-A1的LD50≈2.4×101.16CFU/mL;KQ-Pm-A2的LD50≈2.02×101.84CFU/mL。
3 讨论
多杀性巴氏杆菌是引起牛呼吸道综合征(Bovine respiratory disease complex, BRDC)的主要病原菌,能够导致牛出现出血性败血症。据统计,美国有14.4%的牛在育肥期患有BRDC,而北美每年有14%~24%的牛死于BRDC[4]。国内报道自2006年起,多地养牛场出现牛出血性败血症,并分离出荚膜A型多杀性巴氏杆菌,此后陆续在多个省市分离出该血清型病原[5]。由于缺少有效的防疫手段,该病一直流行至今,每年由P.multocida引发的BRDC在全球范围内引起严重的经济损失。
本试验从犊牛体内分离出2株荚膜A型多杀性巴氏杆菌,病死牛以犊牛为主,且传播较快,临床表现为呼吸困难,这与国外报道一致[6-7]。近年来,越来越多的报道表明,A型多杀性巴氏杆菌正逐渐成为引起BRCD巴氏杆菌中的主要血清型。Dabo等[8]和Christa等[9]的研究显示,在引起BRCD的巴氏杆菌中,荚膜A型占比分别为80%及92%。

对KQ-Pm-A1及KQ-Pm-A2的16S rRNA进行测序,选取不同国家和地区已发表的序列进行进化树分析,发现本试验的分离菌与湖南、湖北等华中地区的分离株亲源性较低,与海南分离株亲源性较高。同时还发现,一些不同国家的分离株有较高的亲源性,这些结果表明,多杀性巴氏杆菌已经呈全球流行态势。但在曹瑞勇等[13]的研究中,国内各省间的分离株具有较高的亲源性,与国外分离株亲源性较低,与本试验结果有差异,可能的原因是选取比对的样本不同。因此,要加强对各地区牛源多杀性巴氏杆菌的流行病学调查,以期获得更加全面的样本。
采用活菌计数法对KQ-Pm-A1和KQ-Pm-A2进行生长曲线的绘制,结果显示,2株分离菌在相同的培养条件下,生长规律大致相同。0~6 h时2株菌均在生长期,6~12 h在平台期,随后进入衰退期。本试验绘制的生长曲线与一些已有报道存在差异,朱玲[14]的研究显示,分离株在8 h进入平台期,16 h进入衰退期;而谢倩茹等[15]的研究显示,分离株在2 h后进入平台期,16 h后开始衰退,这些结果的差异可能与培养细菌的环境有关。在Oslan等[16]的研究中发现,高活细胞数在很大程度上受到微量营养素成分和大量营养素供应的影响,其中组氨酸对于生长是必不可少的,而核黄素也对细菌活力有重要影响。
通过腹腔注射的方式攻毒小鼠,发现2株分离菌均能够引起小鼠死亡。高剂量攻毒小鼠死亡较快,剖检可见脏器出血、淤血,中、低剂量攻毒小鼠死亡较慢,剖检发现胸腹腔均有不同程度的炎性反应,结果符合预期。对攻毒死亡小鼠各脏器进行细菌分离,经鉴定与所攻毒株相同,表明小鼠死亡原因是由所攻菌株引起。测定半数致死量发现,KQ-Pm-A1为2.4×101.16CFU/mL,而KQ-Pm-A2为2.02×101.84CFU/mL,在菌株致病力方面,KQ-Pm-A1要强于KQ-Pm-A2。根据Liu等[17]对多杀性巴氏杆菌毒力的判定标准,小于100 CFU/mL为强毒菌株,可知KQ-Pm-A1为强毒菌株,KQ-Pm-A2为中强毒菌株。
综上所述,通过传统培养法及分子生物学法分离鉴定的荚膜A型多杀性巴氏杆菌是造成广东某养殖场犊牛死亡的主要原因。本试验可为临床治疗该病及牛源多杀性巴氏杆菌的流行病学调查提供理论依据。
