溶血性曼氏杆菌及其毒力因子研究进展
2022-01-17胡玉婷杨发龙刀筱芳
胡玉婷,杨发龙,刀筱芳
(西南民族大学生命科学与技术学院,四川 成都 610041)
溶血性曼氏杆菌(Mannheimiahaemolytica,MH)属于巴氏杆菌科,是一种革兰阴性球杆菌,其作为一种条件致病菌常存在于牛、羊等反刍动物上呼吸道的鼻腔和扁桃体隐窝等部位[1]。当动物因长途运输、饲养条件及天气环境变化而受到应激,或因支原体和病毒等病原感染而导致免疫功能下降时,其会迅速增殖并下行扩散至肺部,引起严重的肺炎。该病原是引起牛的呼吸道疾病综合征(Bovine respiratory disease complex,BRDC)(运输热)最为重要的病原之一[2]。同时,溶血性曼氏杆菌也能感染山羊及绵羊等小反刍动物和美洲野牛、大角羊、大耳羊、麋鹿、驼鹿、鹿和叉角羚等反刍野生动物。也有研究发现,其还能够感染某些非反刍动物,例如骡、兔、猪、鳄鱼、狗和猫等[3]。目前,溶血性曼氏杆菌在世界范围内广泛流行,给养殖业造成了巨大的经济损失[4]。由于溶血性曼氏杆菌对牛、羊养殖业带来的巨大威胁,因此,国内外学者对其致病机制,特别是对一些重要毒力因子的生物学特征以及在致病过程中发挥的作用进行了一系列研究,本文对近年来的相关研究进展进行了综述。
1 分类地位及命名
目前,溶血性曼氏杆菌被归为变形菌门(Proteobacteria)、γ-变形菌纲(Gammaproteob-acteria)、巴氏杆菌目(Pasteurellales)、巴氏杆菌科(Pasteurellaceae)、曼氏杆菌属(Pasteurella)[5]。溶血性曼氏杆菌自首次分离以来,其分类和命名经历了多次变化。起初,Kitt[6]于1885年将其命名为多杀性双极杆菌(Bacteriumbipolaremultocidum)。1932年,Newsom等[7]根据其在血平板表现弱溶血性的特点将其更名为溶血性巴氏杆菌(Pasteurellahaemolytica)。1959年,Smith[8]根据不同菌株发酵阿拉伯糖和海藻糖的能力将其分为2个生物型,即A型和T型。1960年,Biberstein等[9]根据荚膜表面抗原的不同将A型和T型的菌株分为17个血清型,其中A型包括A1、A2、A5~A9、A11~A14、A16和A17共13个血清型,而T型包括T3、T4、T10、T15血清型。随后,Angen等[10-11]根据DNA-DNA杂交和16S rRNA测序的研究,把其中A11血清型单独命名为葡萄糖苷曼氏杆菌(Mannheimiaglucosida),而把其他A血清型命名为溶血性曼氏杆菌,所有T型菌株则命名为海藻糖巴氏杆菌(Pasteurellatrehalosi)[12]。2007年,Blackall等[13]又将其正式命名为海藻糖比伯斯坦杆菌(Bibersteiniatrehalose)。
对溶血性曼氏杆菌分类及命名的主要过程如图1所示。
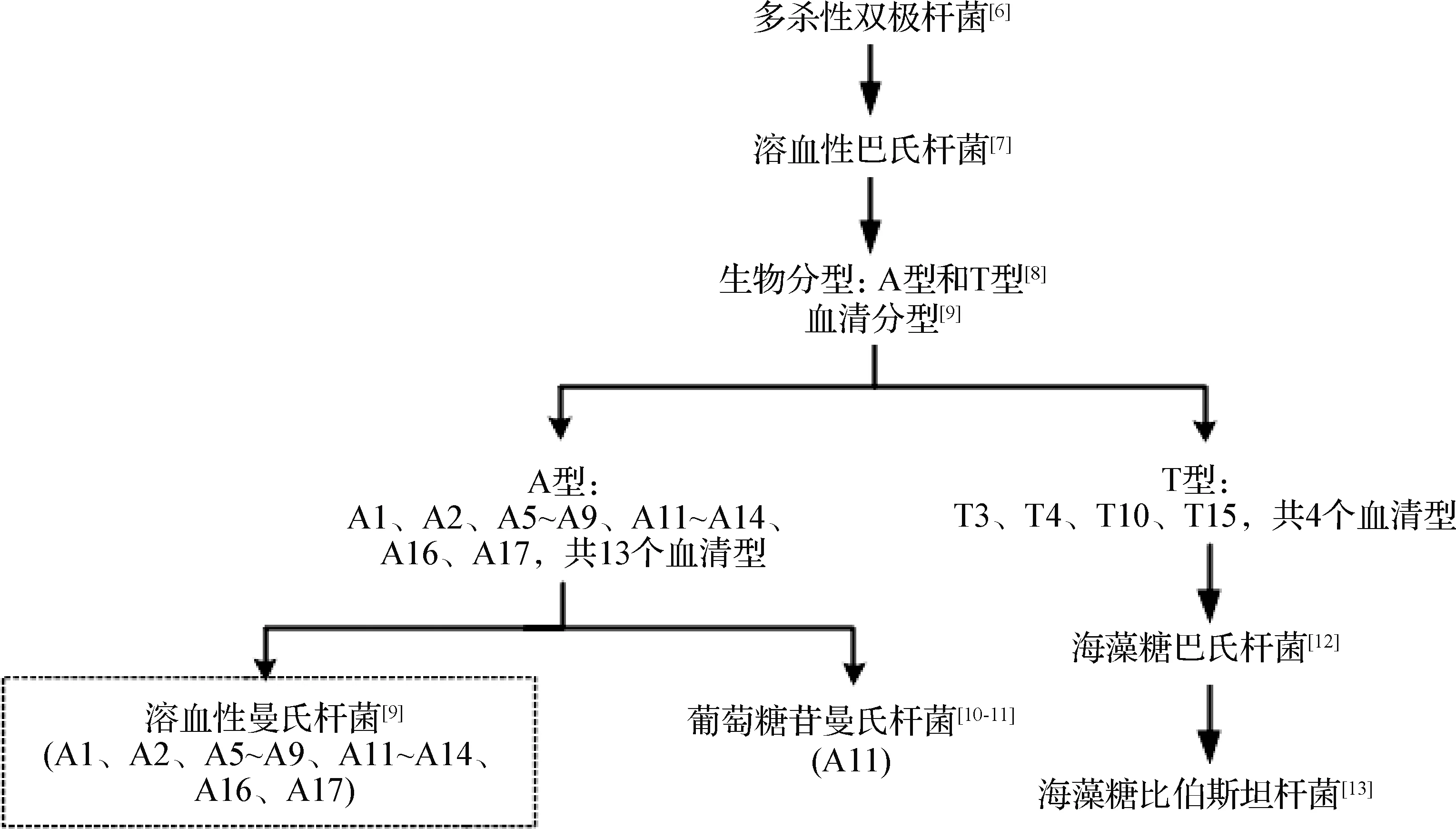
图1 溶血性曼氏杆菌的分类及命名过程
2 血清型
在最初将溶血性曼氏杆菌归为巴氏杆菌属时,根据其分别发酵阿拉伯糖和海藻糖的能力将其分为2个生物类型:A型和T型[8]。Biberstein等[9]利用间接血凝试验,根据荚膜表面抗原将A型和T型的菌株分为17个血清型,其中生物A型包括13种血清型,分别为A1、A2、A5~A9、A11~A14、A16和A17血清型,T型包括4种血清型,分别为T3、T4、T10、T15。随后,将A型中A1、A2、A5~A9、A12~A14、A16和A17血清型命名为溶血性曼氏杆菌,A11血清型命名为葡萄糖苷曼氏杆菌(Mannheimiaglucosida)[10-11]。因此,目前溶血性曼氏杆菌共有12个血清型,分别为A1、A2、A5~A9、A12~A14、A16和A17血清型。
在溶血性曼氏杆菌的12种血清型中,A1、A2及A6血清型是流行最为广泛的血清型,其次是A7、A9、A11和A12血清型[14]。虽然A1、A2和A6血清型都能感染牛、羊并定殖于上呼吸道,但表现为一定的宿主特异性,即感染不同宿主的血清型存在一定的差异。其中A1和A6血清型是引起牛肺炎的主要血清型。姜志刚等[15]对我国东北地区牛群感染溶血性曼氏杆菌的调查发现,引起我国牛肺炎的溶血性曼氏杆菌血清型主要为A1和A6,分别占分离菌株的66.7%和33.3%,与国外的相关报道一致。虽然A2血清型菌株也存在于健康牛的上呼吸道,但普遍认为A2血清型在牛上仅作为非致病性血清型,在应激或合并感染后,A1血清型很快取代A2血清型成为主要血清型,这种转变可能是由感染的A1血清型菌株的病畜其传播给感染A2血清型菌株的动物来完成的[16]。
关于感染山羊及绵羊的溶血性曼氏杆菌的优势血清型,相关报道并不一致。多数学者认为,A2血清型是感染羊的主要血清型,如:Fodor等[17]对从匈牙利山羊中分离得到的49株溶血性曼氏杆菌进行血清型分析,结果发现,A2血清型所占比例高达94.0%。但也有报道与上述结果并不相符,如:Abay等[18]对山羊源溶血性曼氏杆菌阳性血清样本进行检测,发现A1血清型为优势血清型,占43.5%,其次是A2和A7血清型。因此,不同血清型与感染宿主之间的相关性尚无明确的结论。特别是不同血清型对绵羊和山羊致病性并不了解,值得进一步研究。
3 毒力因子
与大多数致病性细菌一样,溶血性曼氏杆菌在其感染和进一步致病的过程中,是通过依靠各种毒力因子来完成的[14]。目前,已经对溶血性曼氏杆菌的一些重要毒力因子进行了鉴定,其中包括对反刍动物白细胞具有特异性毒性的白细胞毒素(Leukotoxins,LKT),能够诱导炎性细胞因子应答的脂多糖(Lipopolysaccharide,LPS),能够激发机体免疫应答的外膜蛋白(Outer membrane proteins,OMP),与细菌定植相关的黏附素以及在细菌黏附和侵入过程中起重要作用的荚膜等,均与疾病的发生密切相关[13]。因此,深入了解溶血性曼氏杆菌中的毒力因子,有助于阐明溶血性曼氏杆菌的致病机制,并为其疫苗研制和药物治疗提供重要的理论基础[1]。
3.1 白细胞毒素 白细胞毒素(Leukotoxin,LKT)属于细菌成孔毒素(Repeats in toxin,RTX)家族的成员,是溶血性曼氏杆菌最为重要的毒力因子[5]。Tatum等[19]通过基因敲除构建了溶血性曼氏杆菌LKT基因缺失株。发现与野生型溶血性曼氏杆菌相比,缺失株的LKT活性降低,甚至不会引起明显的肺部病变[19],说明LKT对于溶血性曼氏杆菌的致病性至关重要。
LKT作为RTX家族的成员,由4个基因簇lktC、lktA、lktB和lktD编码组成[19]。其中,lktA作为结构基因主要编码LKT原蛋白(LktA);基因lktC编码转酰酶,翻译后通过脂肪酸酰化修饰不活跃的LKT原蛋白,从而将其转化为具有生物活性的LKT(LktA)。在酰化过程中,脂肪酸基团被添加到位于lktA上的赖氨酸残基上,这是LktA去电荷、增加亲水性的关键步骤,使LktA能够插入宿主细胞,形成跨膜孔。最终由lktB和lktD基因产物将其由细菌胞浆运输到外环境中[20]。
Davies等[21]对31株绵羊和牛的溶血性曼氏杆菌的lktA基因序列进行分析,发现了8种lktA主要的等位基因亚型:lktA1~lktA3和lktA6~lktA10亚型。通过对比不同血清型的溶血性曼氏杆菌的lktA基因亚型,发现不同血清型之间lktA基因亚型不同。如:lktA2亚型仅出现在A2血清型之中;lktA6、lktA7和lktA9亚型分别只出现在A13、A16和A14血清型之中。同时发现,lktA基因亚型和宿主特异性相关,如:lktA1.1亚型仅出现在牛源溶血性曼氏杆菌分离株中,而lktA1.2和lktA1.3基因亚型主要存在于绵羊源溶血性曼氏杆菌中。此外,Davies等[22]研究发现,牛源溶血性曼氏杆菌分离株的lktA1.1亚型与绵羊源lktA1.2亚型和lktA1.3亚型对相同细胞类型(即对牛或绵羊中性粒细胞)的细胞毒性存在明显差异。
虽然LKT可以结合宿主的多种细胞,但细胞溶解需要与特定靶细胞上的特定受体发生特异性结合[20]。宿主特异性源于LKT与宿主细胞上面的β2整合素LFa-1(淋巴细胞功能相关抗原1)的相互作用[2]。目前发现LKT作用受体主要为β2整合素的LFa-1(CD11a/CD18)、Mac-1(CD11b/CD18)以及CR4(CD11c/CD18)3种[23-24]。
同时,LKT作为高度不稳定的细胞外分泌蛋白,常常在作用于反刍动物白细胞时表现出剂量依赖性[4]。在低浓度时,LKT通过与β2整合素受体的相互作用可以激活白细胞,引起白细胞呼吸暴发和脱颗粒,活化的中性粒细胞和肺泡巨噬细胞释放促炎细胞因子,肥大细胞释放组胺,导致炎症细胞在肺部积聚;在高浓度时,LKT通过外源性和内源性机制诱导宿主白细胞凋亡,使细菌通过破坏固有免疫反应(巨噬细胞和中性粒细胞)和增强炎症过程来逃避宿主免疫监视;在最高浓度时,LKT诱导白细胞跨膜孔的形成,引起靶细胞坏死,最终导致肺部损伤[15]。因此,上述LKT对反刍动物白细胞的损伤作用可能使溶血性曼氏杆菌逃避宿主的适应性免疫反应,削弱肺的主要免疫防御机制,并进一步引起肺部炎症和组织损伤[14]。
3.2 脂多糖 脂多糖(Lipopolysaccharide,LPS)是溶血性曼氏杆菌另一重要的毒力因子[2]。作为革兰阴性菌细胞壁的主要成分,LPS的脂质A具有内毒素活性。LPS可以使细菌逃避宿主的免疫屏障从而在肺部进行增殖,诱导炎性细胞因子应答,裂解中性粒细胞和肺泡巨噬细胞,最终加强对肺部的损伤。LPS的毒性可通过与肺表面活性物质中的磷脂结合而增强,从而使LPS在肺中持续存在并引发炎症。此外,LPS引起的全身效应包括发热和肝脏产生急性期蛋白,导致被感染动物出现低血压和败血症的临床症状[2]。
LPS对白细胞的作用也呈剂量依赖性。低浓度时,LPS降低了中性粒细胞的吞噬能力;而高浓度时,LPS则增强中性粒细胞的吞噬能力[2]。
LPS的病理效应是通过与LPS结合蛋白的结合完成的,进一步的相互作用很可能是通过CD14介导的[2]。当LPS被释放进入血液循环,就会被一种称为LPS结合蛋白(LBP)的血清蛋白所识别,并形成LBP-LPS复合物。LBP不仅可以识别LPS,还能将LPS转移到单核细胞或者是巨噬细胞的细胞表面受体CD14(mCD14)上,通过形成LPS-CD14复合物从而激活细胞。LPS-CD14复合物能够通过与另一膜蛋白Toll样受体4(TLR4)相互作用来启动细胞内信号。TLR4是一种跨膜蛋白,它可以识别特殊的配体LPS。信号通路又能诱导促炎细胞因子的释放,包括TNF-α、IL-1β、IL-6、IL-8、NO和活性氧(ROS)[25],这些炎性因子的过度表达会导致肺部的损伤,并最终导致严重的肺炎[26]。然而,LPS也可以在没有LBP的情况下激活单核吞噬细胞,从而猜测:CD14依赖通路可能不是LPS与巨噬细胞和单核细胞相互作用的唯一途径[2]。
综上所述,LPS通过多种复杂的机制导致肺部病变。此外,溶血性曼氏杆菌的LPS能够增强LKT对靶细胞的毒害作用。体外研究显示,与分别受到LKT和LPS攻击的细胞相比,同时受到LKT和LPS攻击的牛肺泡巨噬细胞能够产生更多的肿瘤坏死因子α(TNF-α)和白细胞介素8(IL-8)[2]。
3.3 外膜蛋白 溶血性曼氏杆菌具有多种外膜蛋白。研究表明,在溶血性曼氏杆菌中,其外膜蛋白和脂蛋白在一定程度上具有宿主和血清型特异性,并且是重要的保护性抗原,针对这些抗原的抗体能够诱导吞噬作用和补体介导的杀伤作用[27],因此作为潜在的疫苗候选物一直被研究。此外,Iovane等[28]证明,外膜蛋白对中性粒细胞具有趋化作用,并能够抑制其吞噬作用和细菌杀伤作用,因此有利于溶血性曼氏杆菌在肺部的定植。
在所有外膜蛋白中最主要的是外膜蛋白OmpA,其是高度保守的蛋白,该蛋白有助于细菌结合到宿主上呼吸道细胞的特异性受体上,在溶血性曼氏杆菌黏附、定植[2]和选择特异性宿主细胞中发挥重要作用[5]。Kisiela等[29]在研究溶血性曼氏杆菌对牛上皮细胞的黏附研究中发现,溶血性曼氏杆菌的外膜蛋白A(OmpA)和脂蛋白1(Lpp1,也称为PlpA)有助于溶血性曼氏杆菌对牛支气管上皮细胞的黏附。此外,在外膜蛋白中,还有一类脂蛋白同样重要。研究发现,在溶血性曼氏杆菌所有血清型中均发现了一种外膜脂蛋白为PlpE,在接种疫苗后PlpE能够提供免疫性保护[30]。并且,针对A1血清型的PlpE的抗体能够提供针对A6血清型的交叉保护,并促进吞噬作用和补体介导的细菌杀灭作用。此外,研究发现,外膜脂蛋白PlpE也具有良好的免疫原性[30]。
除了上述外膜蛋白和脂蛋白,溶血性曼氏杆菌还产生一类外膜蛋白以获取铁,被称为铁调节的外膜蛋白(IROMPs)。IROMPs对铁具有高度亲和力,能直接从转铁蛋白和乳铁蛋白中摄取铁,同时能抑制中性粒细胞的吞噬作用,从而保证溶血性曼氏杆菌在体内的生长繁殖。研究发现,IROMPs能够被恢复期的牛(绵羊)的血清所识别,表明它们能够作为保护性抗原在体内表达[11]。目前,至少有3种溶血性曼氏杆菌A1血清型IROMP已经被鉴定,大小分别为71、77 kDa和100 kDa[30]。
3.4 荚膜多糖 根据荚膜多糖表面抗原的不同,溶血性曼氏杆菌分为12个血清型(A1、A2、A5~A9、A12~A14、A16和A17)[7]。荚膜多糖在许多革兰阴性菌的致病过程中起作用,这些作用包括黏附、抵抗宿主免疫防御和掩蔽细菌逃脱免疫反应[2]。溶血性曼氏杆菌的荚膜多糖同样参与了溶血性曼氏杆菌的致病过程,已有研究表明,溶血性曼氏杆菌的荚膜可能与肺表面活性物质相互作用,从而促进机体与不同的宿主细胞的局部黏附。
3.5 菌毛和黏附素 黏附是呼吸道病原体感染并定殖于宿主的首要条件,溶血性曼氏杆菌对宿主呼吸道上皮细胞的黏附主要是由菌毛和黏附素介导的。
目前,通过免疫印迹等方法已经鉴定出多种黏附素及其在宿主内的靶细胞,其中包括上面述及的多种外膜蛋白,如:外膜蛋白A(OmpA)和脂蛋白1(Lpp1,也称为PlpA)在溶血性曼氏杆菌对牛上皮细胞的黏附过程中发挥重要作用。此外,还发现外膜蛋白A(OmpA)可能有助于溶血性曼氏杆菌在羊的呼吸道定植。Mora等[31]还发现了1个68 kDa分子,可以作为黏附素与培养的气管上皮细胞结合。
另外,溶血性曼氏杆菌的菌毛上可能存在黏附素分子,并通过结合呼吸道上皮细胞的唾液酸糖蛋白受体来介导黏附作用[32]。
3.6 神经氨酸酶 在其他细菌性呼吸道病原体中,神经氨酸酶可以使唾液糖蛋白脱水,从而使病原体逃避口咽中的防御系统。神经氨酸酶在溶血性曼氏杆菌的定植中也发挥作用,神经氨酸酶可以通过暴露潜在的细胞受体来增强生物膜的形成,并通过裂解唾液糖蛋白来逃避宿主局部的先天性免疫[2]。此外,神经氨酸酶能够降低呼吸道黏液的黏度,增强溶血性曼氏杆菌的黏附性,使溶血性曼氏杆菌更紧密地附着在细胞表面。
3.7 糖蛋白酶 溶血性曼氏杆菌具有多种糖蛋白酶[2]。虽然它们的生物学特征和致病过程中所发挥的作用尚不完全清楚,但已经证明它们有利于细菌定植及肺部感染的形成。研究表明,从培养的溶血性曼氏杆菌的上清液中获得的糖蛋白酶可以选择性地水解IgG1,从而抑制调理素诱导的吞噬作用和细菌杀灭作用。Shewen等[33]研究证明,用重组糖蛋白酶对小牛进行疫苗接种后,可产生显著的血清抗体应答,且能保护小牛免受溶血性曼氏杆菌血清A1型的试验感染。
此外,溶血性曼氏杆菌所有血清型都可以产生一种糖蛋白酶—锌金属蛋白酶(Zinc metalloproteinase)[34]。Nyarko等[35]研究发现,锌金属蛋白酶能够作用于宿主上皮细胞表面增强其黏附力。此外,其还能引起肺泡中血小板的聚集。在体外可通过与LKT共孵育而增强糖蛋白酶活性[36]。
4 展望
溶血性曼氏杆菌作为一种严重威胁牛、羊养殖的重要呼吸道病原[2],全面掌握其分子生物学特征以及感染与免疫的机制等是开发安全、有效的疫苗和采取综合防治措施的前提[4]。因此,近年来国内外学者针对溶血性曼氏杆菌的功能蛋白和毒力因子展开了大量的研究[5]。
毒力因子是决定细菌致病性的关键[13]。如本文所述,目前对溶血性曼氏杆菌的重要毒力因子已进行了鉴定,对其分子结构以及在溶血性曼氏杆菌感染和致病过程中所发挥的作用也进行了大量的研究[16]。相关研究结果也有效促进了新型疫苗的研制工作,例如基于重组LKT[26]、PlpE的亚单位疫苗,以及LKT等功能蛋白增强的灭活疫苗等[13,27],均表现出良好的免疫保护效果。
尽管如此,对溶血性曼氏杆菌毒力因子及其致病机制的了解尚不全面。此外,溶血性曼氏杆菌对牛表现出一定的宿主特异性,但决定这种特异性的分子尚不清楚,这对于溶血性曼氏杆菌的综合防控不利,仍需进一步研究。
