瞬时性受体电位通道香草酸受体5、6参与胎盘滋养层细胞钙转运
2022-01-17黄小兰尹红斌李素华黄景军栾云鹏
季 佳,黄小兰,尹红斌,李素华,黄景军,栾云鹏
(1. 西南林业大学生命科学学院,云南 昆明 650224 ; 2. 云南省动物卫生监督所,云南 昆明 650051)
胎盘是母体与胎儿之间进行物质交换的唯一器官,通过脐带和胎儿相连,胎儿需要的钙全部来自母体。由于胎儿血液钙浓度高于母体,母体-胎儿钙转运是经胎盘的主动转运过程[1]。瞬时性受体电位通道香草酸受体5、6[Transient receptor potential vanilloid 5、6(TRPV5,TRPV6)]是钙离子高度选择性通道,广泛表达于多种哺乳动物组织中[2]。课题组前期研究显示[3],TRPV5高表达于妊娠胎盘的迷路区合体滋养层细胞,TRPV6高表达于妊娠胎盘的连接带海绵滋养层细胞,且二者在妊娠最后5 d的胎盘组织中维持着高表达量,此时期与高效母体-胎儿钙转运一致。研究结果提示,TRPV5和TRPV6可能参与了胎盘介导的母体-胎儿钙转运过程,并参与胎儿钙代谢的调节。本试验以小鼠胎盘滋养层细胞为研究对象,通过细胞TRPV5和TRPV6基因的沉默,分析胎盘滋养层细胞钙转运功能,揭示TRPV5和TRPV6在母体-胎儿钙转运过程中的生理学作用,完善孕期母体和胎儿的钙转运机制,为预防胎儿钙代谢障碍性疾病提供临床基础理论。
1 材料与方法
1.1 主要试剂及仪器 RNA干扰慢病毒载体TRPV5 siRNA/shRNA/RNAi Lentivirus (Mouse)及TRPV6 siRNA/shRNA/RNAi Lentivirus (Mouse),均为Abm生物科技公司产品;TRPV5单克隆抗体为Abcam公司产品;CK7抗体、Vimentin抗体及TRPV6多克隆抗体,均为Santa Cruz公司产品;DMEM高糖培养液为Gibco公司产品;胎牛血清为Hyclone公司产品;Percoll细胞分离液、促转染剂Polybrene聚凝胺及细胞培养级非离子型表面活性剂Pluronic F-127,均为Sigma-Aldrich公司产品;Rhod-2-AM荧光染料为美国Thermo Fisher公司产品,PrimeScriptTMRT-PCR试剂盒及SYBR PremixExTaqTM试剂盒,均为TaKaRa公司产品;其他免疫组织学试剂及细胞培养试剂,均为武汉博士德公司或上海碧云天生物技术研究所产品。CS SP5型激光共聚焦显微镜系统为德国Leica公司产品;荧光定量PCR仪为美国ABI公司7500型产品;荧光显微镜为日本Olympus 公司CX31-32L02型产品。
1.2 胎盘滋养层细胞的分离及鉴定 取发情期雌性昆明小鼠与雄性昆明小鼠等比例合笼,次日观察阴道栓,见栓则记为妊娠0.5 d。取妊娠7.5 d的雌性小鼠,无菌分离胎盘组织,用含双抗的D-Hank’s溶液清洗去除血污,并剪成1 mm3的组织小块。参考Handschuh等[4]建立的Percoll密度梯度离心法,并进行改良。含0.125%胰蛋白酶和50 U的I型DNA酶的混合酶溶液消化组织小块60 min,加入含血清的细胞培养液终止消化。收集消化液,使用200目的无菌不锈钢筛网过滤,收集滤液,500 g离心10 min,无血清DMEM高糖培养基悬浮细胞,加至35%、40%、45%、50%和55%五种不连续的Percoll密度梯度液中,1 000 g离心30 min,吸取40%和45%密度层之间的细胞。加入无血清DMEM高糖培养基中,500 g离心10 min清洗细胞后,以10%胎牛血清的DMEM高糖培养液制成细胞悬液,接种于25 cm2细胞瓶,倒置显微镜下每天观察细胞形态和生长状态。参考已报道的方法[5],利用免疫荧光细胞化学法对小鼠胎盘滋养层细胞进行鉴定。将稀释至1×105个/mL的细胞悬液接种于含盖玻片的12孔细胞培养板中,待细胞长成单层,取出盖玻片,制成细胞爬片。D-Hank’s溶液清洗细胞爬片,4%多聚甲醛室温固定细胞30 min后,滴加足量以1∶100比例稀释的CK7抗体或Vimentin抗体,4 ℃冰箱孵育过夜。D-Hank’s溶液清洗细胞,加入1∶50稀释的FITC标记的羊抗小鼠IgG二抗,室温孵育2 h。 D-Hank’s溶液再次清洗细胞后,荧光显微镜下观察拍照。
1.3 慢病毒转染胎盘滋养层细胞 细胞转染试验分为3个组,即siTRPV5组[细胞转染载体TRPV5 siRNA/shRNA/RNAi Lentivirus (Mouse)],siTRPV6组[细胞转染载体TRPV6 siRNA/shRNA/RNAi Lentivirus (Mouse)]以及Control组(细胞无Lentivirus载体转染的空白对照组)。每组设4个重复。昆明小鼠胎盘滋养层细胞以含10%胎牛血清的DMEM高糖培养液制成细胞悬液,每孔5×104个细胞接种于24孔细胞培养板,置于37 ℃、5% CO2细胞培养箱培养。当细胞汇合度达30%~40%后,更换新鲜的含10%胎牛血清的DMEM高糖培养液,每孔1 mL。siTRPV5组和siTRPV6组各孔分别加入TRPV5 siRNA/shRNA/RNAi Lentivirus、TRPV6 siRNA/shRNA/RNAi Lentivirus 10 μL,感染复数(Multiple of infection,MOI)为20,Control组各孔无慢病毒载体添加;同时向各孔中加入2 μL无菌超纯水溶解的5 μg/μL Polybrene液(终浓度为10 μg/mL)。在37 ℃、5%CO2细胞培养箱中孵育48 h后,更换新鲜含10%胎牛血清的DMEM高糖培养液继续培养,细胞汇合度达90%时,按1∶2传代细胞。
1.4 RT-PCR TRIzol法提取细胞RNA,参考文献[6]报道的方法,分别合成TRPV5和TRPV6基因的上下游特异性引物,利用TaKaRa公司PrimeScriptTMRT-PCR试剂盒,通过传统RT-PCR试验扩增TRPV5和TRPV6基因。根据试剂盒操作说明书,反转录体系为20 μL∶0.5 μL两步法反转录酶、4 μL 5×缓冲液、0.5 μL RNA酶抑制剂、1 μL dNTP混合液、1 μL Oligo dT引物、2 μL模板RNA以及11 μL无RNA酶水;在PCR仪上进行42 ℃反转录反应10 min, 95 ℃失活反应5 min后进行PCR反应。PCR反应体系:5 μL反转录反应液、0.5 μLExTaq酶、5 μL 10×PCR缓冲液、2 μL dNTP混合液、特异上下游引物各0.5 μL以及36.5 μL无菌水补充体系至50 μL;PCR扩增30个循环,循环程序:94 ℃变性30 s、60 ℃退火30 s、72 ℃延伸40 s。
1.5 实时荧光定量RT-PCR 传统RT-PCR验证为阳性的样本,参照文献[7]合成TRPV5和TRPV6基因实时荧光定量RT-PCR反应的特异性引物,利用TaKaRa公司SYBR PremixExTaqTM试剂盒,实时荧光RT-PCR法监测TRPV5/6 mRNA相对定量。按照试剂盒操作说明书,反应体系为25 μL∶12.5 μL 2×SYBR PremixExTaq酶、0.5 μL上游引物、0.5 μL下游引物、2 μL cDNA模板、0.5 μL ROX参考染料以及9 μL ddH2O;反应程序:95 ℃预变性15 min;95 ℃ 15 s,60 ℃ 1 min,72 ℃ 40 s,40次循环。采用相对定量,以β-actin为内参,按照公式RQ=2-△△Ct[ΔCt=Ct(目的基因)-Ct(内参基因),ΔΔCt=ΔCt(样品)- ΔCt(定标组),本试验以Control组作为定标组],进行基因定量分析[8]。
1.6 Western Blot 裂解细胞,取上清液测定蛋白质浓度。调整待检样品浓度定为相同值,SDS-PAGE电泳,半干转膜仪电转至PVDF膜,脱脂牛奶室温封闭2 h后,加入抗体稀释液稀释的一抗(TRPV5 1∶10 000稀释;TRPV6 1∶5 000稀释;β-actin 1∶2 000稀释),4 ℃孵育过夜,室温下二抗(HRP偶联的羊抗兔IgG)孵育2 h。ECL发光底物显色,暗室中采用KODAK X-OMAT BT胶片曝光。经显影、定影的胶片进行扫描,用Image J软件处理分析目标带灰度值,β-actin条带灰度值进行校正,以各条带的相对灰度值代表蛋白的相对表达量。
1.7 激光共聚焦显微镜钙成像 共聚焦成像培养碟预先用20 μL明胶铺底,干燥2 h。分别取Control组、siTRPV5组和siTRPV6组处于对数生长期细胞,制成4×104个/mL的细胞悬液,每碟1 mL接种培养碟。37 ℃、5%CO2孵育32 h后加入1 mL新鲜的成像缓冲液(NaCl 140 mmol/L,KCl 2.5 mmol/L,CaCl21.8 mmol/L,MgCl21 mmol/L,HEPES 20 mmol/L,pH 7.4)。将50 μg Rhod-2-AM溶于100 μL 成像缓冲液、8 μL DMSO及2 μL 浓度为50% Pluronic F-127制成的混合溶液中,制成Rhod-2-AM工作液,加入培养碟中,完全覆盖细胞,置于5%CO2培养箱,37 ℃孵育1 h。然后加入5倍体积的含10%胎牛血清的Hank’s液,继续培养40 min,弃去培养液,用无Ca2+、Mg2+的Hank’s液清洗2次,洗脱未结合的荧光物质。使用TCS SP5 激光共聚焦显微镜系统进行扫描检测,扫描参数:激发波长552 nm,发射波长581 nm,20倍物镜下检测绿色荧光,储存钙荧光图像,应用Kinetics-Image Analysis数据分析软件,分析细胞内荧光强度,每组至少计数10个典型细胞视野,给出相应的荧光强度值。
1.8 统计分析 数据用平均数±标准差方式表示,以SPSS 17.0统计软件处理,采用单因素方差分析作差异的显著性比较,P<0.05表示有显著差异。
2 结果
2.1 昆明小鼠胎盘滋养层细胞的分离培养及鉴定 采用Percoll密度梯度离心分离的细胞,培养5 h后可观察到有细胞开始贴壁生长,20 h后细胞全部贴壁。细胞为单个核,贴壁早期呈现出梭形或纺锤形等多样形态(图1A),培养72 h后细胞呈片状铺展生长(图1B)。细胞爬片CK7及Vimentin抗体免疫荧光染色结果显示,所分离细胞CK7染色阳性,而Vimentin蛋白表达极少(图1C、1D)。结果表明本试验中所分离到的细胞为胎盘滋养层细胞。
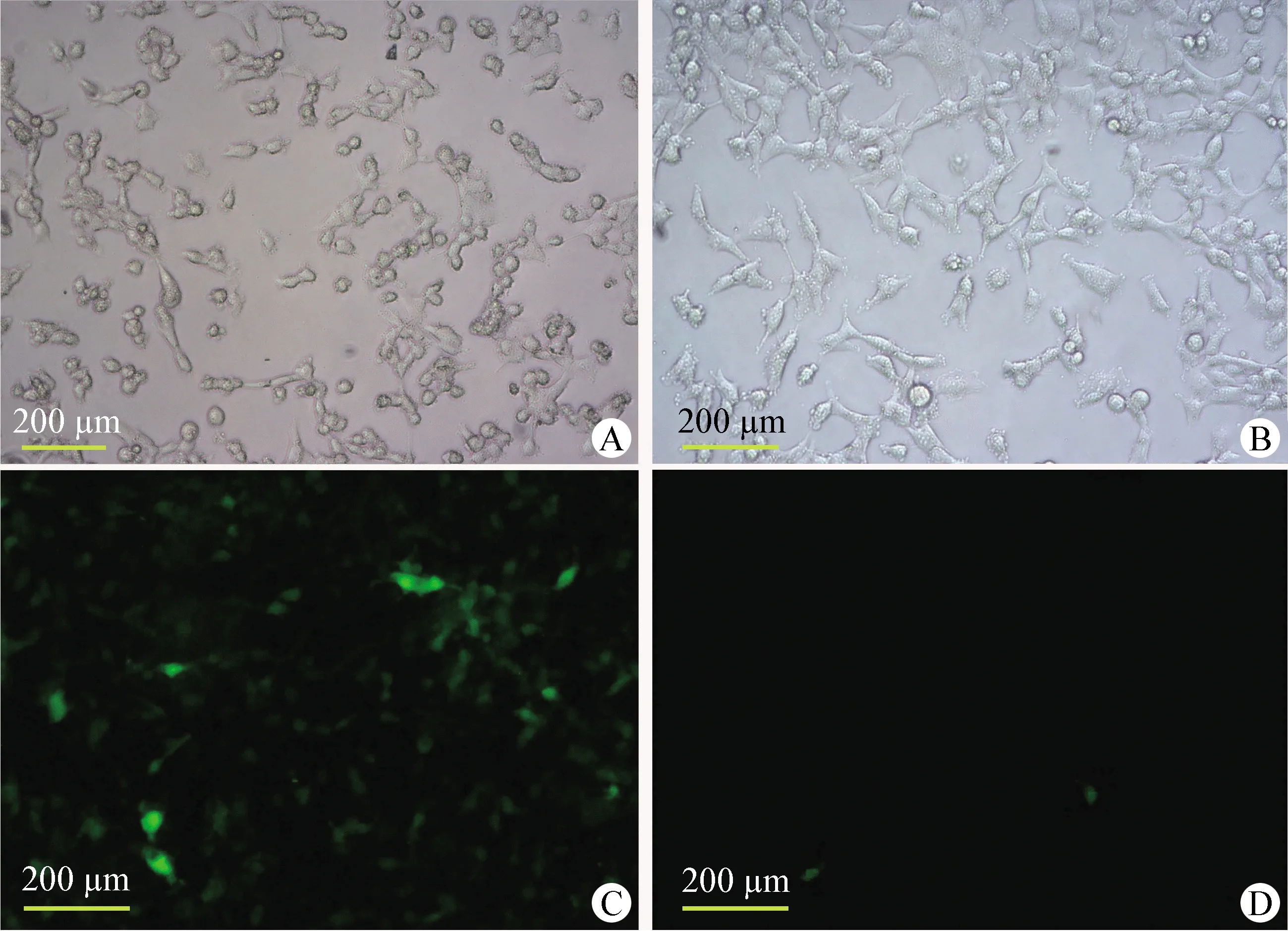
图1 昆明小鼠胎盘滋养层细胞特征(100×,标尺=200 μm)Fig.1 Characterization of cytotrophoblast from Kunming mice (100×,bar=200 μm)A:分离培养20 h的细胞形态; B:分离培养72 h的细胞形态; C:CK7蛋白鉴定阳性; D:Vimentin蛋白鉴定阳性A:Morphology of primary cells after 20 h of incubation; B:Morphology of primary cells after 72 h of incubation; C:Positive expression of cytokeratin 7 by immunofluorescent staining; D:Positive expression of vimentin by immunofluorescent staining
2.2 慢病毒转染对胎盘滋养层细胞TRPV5/6 mRNA及蛋白表达的影响 传统RT-PCR结果显示,各个试验组细胞均可检测到TRPV5和TRPV6的预期目的条带(图2)。实时荧光定量RT-PCR结果显示,TRPV5 RNA/shRNA/RNAi Lentivirus转染48 h后,与Control组相比,siTRPV5组胎盘滋养层细胞的TRPV5 mRNA及蛋白表达量显著降低(P=0.001 5或P=0.032 0),且TRPV6蛋白表达量也显著降低(P=0.022 1);与Control组相比,TRPV6 siRNA/shRNA/RNAi Lentivirus转染48 h后,siTRPV6组胎盘滋养层细胞不仅可见到TRPV6 mRNA及蛋白表达量显著降低(P=0.001 7或P=0.031 9),亦可见到TRPV5 mRNA表达水平的显著降低(P=0.022 5)(图3)。结果表明,慢病毒颗粒干扰效率较好,可以对相应基因的表达产生良好的表达抑制效果。试验结果也显示出TRPV5和TRPV6具有交互作用。

图2 TRPV5和TRPV6基因扩增产物凝胶电泳检测Fig.2 Detection of the gene amplification products for TRPV5 and TRPV6 by agarose gel electrophoresis1:阴性对照; 2~4:TRPV5基因RT-PCR产物(301 bp); 5~8:TRPV6基因RT-PCR产物(312 bp); M:DNA分子量标准DL2 0001:Negative control; 2-4:RT-PCR product of TRPV5 gene (301 bp); 5-8:RT-PCR product of TRPV6 gene (312 bp); M:DNA marker DL2 000
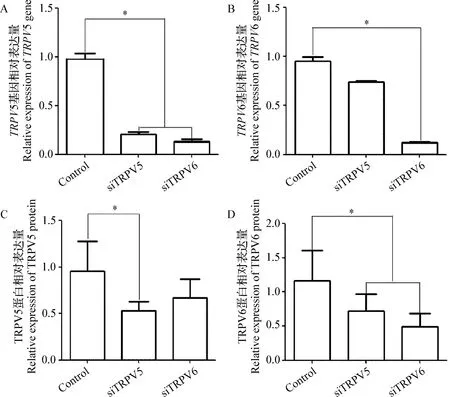
图3 昆明小鼠胎盘滋养层细胞TRPV5、TRPV6的 mRNA及蛋白表达水平Fig.3 mRNA and protein expression of TRPV5 and TRPV6 in placental cytotrophoblasts from Kunming miceA:TRPV5 mRNA基因的相对表达量; B:TRPV6 mRNA基因的相对表达量; C:TRPV5蛋白相对表达量; D:TRPV6蛋白相对表达量siTRPV5:细胞转染载体TRPV5 siRNA/shRNA/RNAi Lentivirus (小鼠); siTRPV6:细胞转染载体TRPV6 siRNA/shRNA/RNAi Lentivirus (小鼠);Control:细胞无Lentivirus载体转染;*:差异显著,P<0.05;下图同A:Relative expression of TRPV5 mRNA gene; B:Relative expression of TRPV6 mRNA gene; C:Relative expression of TRPV5 protein; D:Relative expression of TRPV6 proteinsiTRPV5:Cells transfected with TRPV5 siRNA/shRNA/RNAi lentivirus (Mice); siTRPV6:Cells transfected with TRPV6 siRNA/shRNA/RNAi lentivirus (Mice); Control:Cells without lentivirus transfection; *:Difference was significant,P<0.05. The same as below
2.3 激光共聚焦显微镜钙离子成像检测细胞内钙离子浓度的变化 经TRPV5 siRNA/shRNA/RNAi Lentivirus、TRPV6 siRNA/shRNA/RNAi Lentivirus分别转染昆明小鼠胎盘滋养层细胞,荧光染料Rhod-2-AM负载后,激光共聚焦显微镜进行荧光强度扫描,细胞的钙成像形态见图4。结果显示,与Control组相比,siTRPV5组(P=0.042 1)、siTRPV6组(P=0.008 8)荧光强度降低,慢病毒转染的2个组的细胞荧光强度未见显著差异(P=0.070 1)(图5)。结果说明沉默昆明小鼠胎盘滋养层细胞的TRPV5、TRPV6基因可降低细胞内钙离子浓度,影响细胞的钙转运功能。

图4 昆明小鼠胎盘滋养层细胞Ca2+的激光共聚焦显微镜技术成像Fig.4 Ca2+ imaging by laser confocal microscopy in placental cytotrophoblasts from Kunming mice
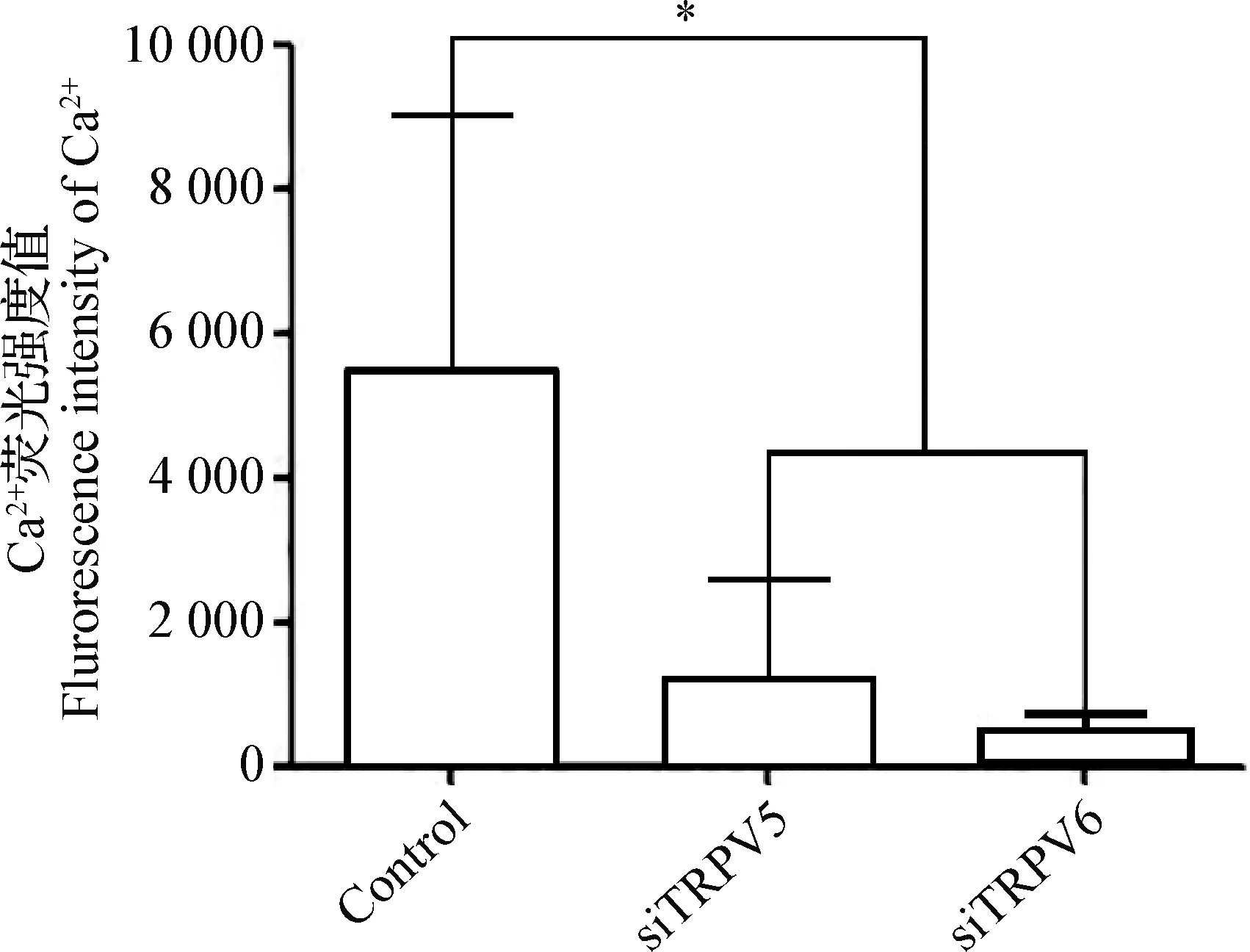
图5 昆明小鼠胎盘滋养层细胞的Ca2+荧光强度Fig.5 Ca2+ fluorescence intensity in placental cytotrophoblasts from Kunming mice
3 讨论
已有研究证实,钙离子的主动转运过程需要钙离子通路、钙结合蛋白以及钠钙交换器等蛋白质的参与[9-10]。妊娠后期的昆明小鼠胎盘滋养层细胞存在高水平的TRPV5和TRPV6,提示TRPV5和TRPV6可能介导了这种母体-胎儿钙转运,且胎盘滋养层细胞可能是介导钙转运发生的细胞。
本试验采用TRPV5 siRNA/shRNA/RNAi Lentivirus、TRPV6 siRNA/shRNA/RNAi Lentivirus转染细胞以此构建TRPV5、TRPV6基因表达沉默的细胞模型。通过实时荧光定量RT-PCR及Western Blot分别检测TRPV5、TRPV6的mRNA及蛋白质表达,结果显示,细胞内TRPV5、TRPV6 mRNA及蛋白水平在慢病毒转染的胎盘滋养层细胞中表达均下调,提示试验采用的慢病毒颗粒对TRPV5、TRPV6基因具有沉默效果。本试验还发现,TRPV6基因的沉默在mRNA水平对TRPV5具有抑制效果,而TRPV5基因的沉默对TRPV6蛋白具有显著的抑制效果,这些结果提示,TRPV5、TRPV6在mRNA水平具有互作效应。研究显示,TRPV5和TRPV6氨基酸序列与瞬时电位受体家族的其他成员仅有30%~40%的同源性,但是二者本身却高度同源[11-12]。在蛋白质结构方面,TRPV5和TRPV6均显示出典型的拓扑结构特征,包括庞大的N-和C-末端结构域以及6个跨膜区域,5-6跨膜结构间存在1个短的疏水片段,被认为是钙孔隙形成区[11-12]。二者在结构上的共同性提示基因间存在互作的可能性。
激光共聚焦显微镜钙离子成像试验显示,昆明小鼠胎盘滋养层细胞内TRPV5、TRPV6基因表达沉默后,细胞内钙离子浓度降低,结果说明,TRPV5、TRPV6在胎盘钙转运过程中发挥着积极的作用,可以促进妊娠期母体-胎儿的钙传递。本试验得到的TRPV6在胎盘钙转运这一生理过程中的生物学作用与Yoshiro等[13]的结论一致。
深入分析本试验结果提示:单一基因的沉默也能导致细胞生理学功能的障碍。笔者认为,昆明小鼠胎盘滋养层细胞的钙转运功能可能是由TRPV5和TRPV6共同完成,TRPV5和TRPV6异四聚体构型可能是介导细胞这一功能的形式。TRPV5和TRPV6可形成低聚复合物的研究已有报道。有学者通过蔗糖梯度沉淀TRPV5、TRPV6复合物,经交联研究、免疫共沉淀试验和分子质量测定已经表明在肾脏远端小管上皮细胞上存在有TRPV5和TRPV6异四通道复合物[14-15]。目前,研究者正在深化关于异聚复合物的认识,以证明这种复合物改变了经典瞬时受体电位通道 (Transient receptor potential canonical channel,TRPC) 家族成员的活性,如TRPC1和TRPC3形成的杂低聚物赋予了这些通道不同的特性[14-15]。笔者推测,昆明小鼠胎盘滋养层细胞内钙离子浓度的降低可能是TRPV5或者TRPV6沉默导致的某一蛋白亚单位缺失,使得TRPV5和TRPV6的低聚四聚体形成障碍所致。因此课题组下一步研究计划揭示昆明小鼠胎盘滋养层细胞上所表达的TRPV5及TRPV6蛋白的亚单位类型,借此进一步完善TRPV5和TRPV6对胎盘钙转运的影响机制。
