猪源出血性大肠杆菌的分离鉴定与药敏试验
2022-01-17田二杰陈喜波赵坤坤
谷 振,田二杰,陈喜波,薛 瑞,孙 哲,赵坤坤
(洛阳中科基因检测诊断中心有限公司,河南 洛阳 471003)
大肠杆菌(Escherichiacoli,E.coli)是人和动物肠道中普遍存在的一种细菌,主要寄生于大肠内,是一种条件性致病菌。猪感染致病性大肠杆菌时,根据发病日龄及临床表现的差异可分为仔猪黄痢、仔猪白痢和猪水肿病[1],其中出血性大肠杆菌可引起断奶仔猪水肿病[2]。本试验对豫西地区某一养猪场临床症状明显的保育阶段的病死猪进行剖检。病猪临床症状主要为咳嗽、腹式呼吸、关节肿大、下颌和眼脸肿大等,该猪场的发病率为40%,死亡率为30%。本试验结果可为临床兽医合理选择由出血性大肠杆菌引起的猪水肿病治疗药物提供参考。
1 材料与方法
1.1 材料
1.1.1 病原菌 病原菌来源于豫西地区某养猪场保育阶段病死猪1头,该病猪剖检可见心包积液增多、积液呈淡青色,肺脏边缘有黄色纤维素性渗出物,肺间质增宽,肾脏肿大,肠道水肿。根据剖检病变情况分别采集肺脏、肾脏、肠道等组织进行细菌分离。
1.1.2 主要试剂 麦康凯琼脂培养基(MAC)、伊红美蓝琼脂培养基(EMB)、胰蛋白胨大豆琼脂培养基(TSA)、营养琼脂(NA)、Mueller-Hinton琼脂培养基(MH)和哥伦比亚血琼脂培养基,均购自青岛海博试剂有限公司;革兰染色试剂,购自北京索莱宝科技有限公司。生化鉴定成套试剂和药敏纸片:头孢噻呋、阿莫西林、甲砜霉素、硫酸黏菌素、阿米卡星、恩诺沙星、卡那霉素、庆大霉素、多西环素、氟苯尼考,均购自杭州微生物试剂有限公司。PCR试剂:16S rDNA基因的通用PCR引物16S-F1500:5′-AGAGTTTGATCCTGGCTCAG-3′,16S-R1500:5′-ACGGCTACCTTGTTACGACTT-3′;毒力基因stx2的PCR引物[3-4]:stx2-F:5′-CAGTCGTCACTCACTGGTTTCATCAC-3′,stx2-R:5′-GGATATTCTCCCCA-CTCTGACACC-3′,均由北京英潍捷基公司合成;DNATaq酶、dNTP Mix、DNA Marker 2 000等,均购自宝生物(大连)工程有限公司。
1.1.3 实验动物 Balb/c小鼠10只,由国家兽用药品工程技术研究中心提供。
1.2 方法
1.2.1 细菌分离与染色 无菌采取病死猪肺脏、肾脏、肠道内容物等,分别接于血平板培养基,37 ℃培养24 h,观察菌落形态。然后挑取单个菌落划线到麦康凯琼脂培养基和伊红美蓝琼脂培养基,37 ℃培养12 h,再挑取伊红美蓝琼脂培养基上的单菌落划线到营养琼脂培养基上纯化培养,纯化培养后的菌株进行细菌涂片,革兰染色后镜检。
1.2.2 生化鉴定 用接种针无菌挑取纯化培养后的单菌落接种到14种生化鉴定管中,生化试验结果根据试管颜色变化、产气情况、有无扩散进行判断反应呈阴性或阳性。
1.2.3 细菌16S rDNA鉴定 采用煮沸法提取DNA模板。PCR反应50 μL体系:DNA模板4 μL,引物16S-F1500 2.0 μL,引物16S-R1500 2.0 μL,10× PCR Buffer 5.0 μL,dNTP Mix 4.0 μL,DNATaq酶1.0 μL,超纯水32.0 μL,总体积50 μL。反应参数:95 ℃预变性5 min;94 ℃变性1 min,56 ℃退火30 s,72 ℃延伸90 s,共35个循环;72 ℃延伸10 min, 取出PCR产物4 ℃保存备用。取5 μL PCR产物,进行琼脂糖凝胶电泳,观察电泳结果,并用凝胶成像系统拍照。PCR产物送至北京英潍捷基公司测序,并用MEGA 7.0软件以邻位相接法进行序列分析。
1.2.4stx2毒力基因检测 大肠杆菌DNA模板的制备采用煮沸法。PCR反应体系:DNA模板4 μL,引物stx2-F 2.0 μL,引物stx2-R 2.0 μL,10×PCR Buffer 5.0 μL,dNTP Mix 4.0 μL,DNATaq酶1.0 μL, 超纯水32.0 μL,总体积50 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性1 min,57 ℃退火60 s,72 ℃延伸60 s,共30个循环;72 ℃延伸10 min, 取出PCR产物4 ℃保存。PCR产物送至北京英潍捷基公司测序,并用MegAlign软件进行序列分析。
1.2.5 小鼠攻毒试验 选取10只体型、日龄相近的健康小鼠,随机分成2个组,分别为试验组和对照组,每组5只。将纯化培养的大肠杆菌制成菌悬液,然后进行稀释(1 mL菌悬液加入到含有4 mL灭菌纯化水的试管中),稀释到菌悬液浓度为0.5标准麦氏单位(1×107CFU/mL)。将试验组的5只小鼠通过腹腔注射稀释后的菌悬液(0.2 mL/只),对照组的5只小鼠腹腔注射等量的灭菌生理盐水。注射后16~24 h内观察小鼠的死亡情况,并对死亡小鼠进行剖检,触片革兰染色,取肝脏、脾脏等组织H.E.染色做病理切片,观察病理变化。
1.2.6 药敏试验 挑取纯化培养的单菌落接种于TSB+血清培养基,置于37 ℃恒温摇床中培养8~12 h,取100 μL均匀涂布于MH培养基上。采用纸片琼脂扩散法(K-B法)[5]进行药敏试验,37 ℃培养16~18 h后,用游标卡尺测量各药敏纸片的抑菌圈直径大小,根据说明书敏感性和耐药性的抑菌圈直径判定菌株对所选药物的敏感程度。
2 结果
2.1 细菌分离和染色 细菌在血平板上生长为灰色大菌落,β溶血,呈黏液状的菌落形态,命名为YXZC01。然后挑取单个菌落进一步进行分离鉴定,菌落在MAC上生长呈光滑、圆形、粉红色大菌落,在EMB上生长呈光滑、圆形、紫黑色、金属光泽的大菌落,革兰染色为阴性杆菌,见图1。符合大肠杆菌的培养与染色特征。

图1 革兰染色镜检(1 000×)Fig.1 Microscopic examination after Gram staining (1 000×)
2.2 生化鉴定 结果见表1,选择分离纯化后的细菌发酵棉子糖、蜜二糖、甘露醇、山梨醇、肌醇、吲哚、VP、苯丙氨酸、柠檬酸盐、硫化氢为阴性,产生尿素酶,不产生鸟氨酸脱羧酶和赖氨酸脱羧酶,具有运动性,符合大肠杆菌的生化特性。
2.3 16S rDNA基因的克隆 初步分离鉴定出的大肠杆菌利用16S rDNA检测引物进行PCR扩增,凝胶电泳可扩增出1 500 bp左右的目的片段,见图2。对测序结果进行同源性比较,下载多重序列进行比对分析,并构建系统进化树,如图3,从结果可以看出,该菌与E.coliATCC 11775同源性达99.36%,说明分离出的细菌为大肠杆菌。
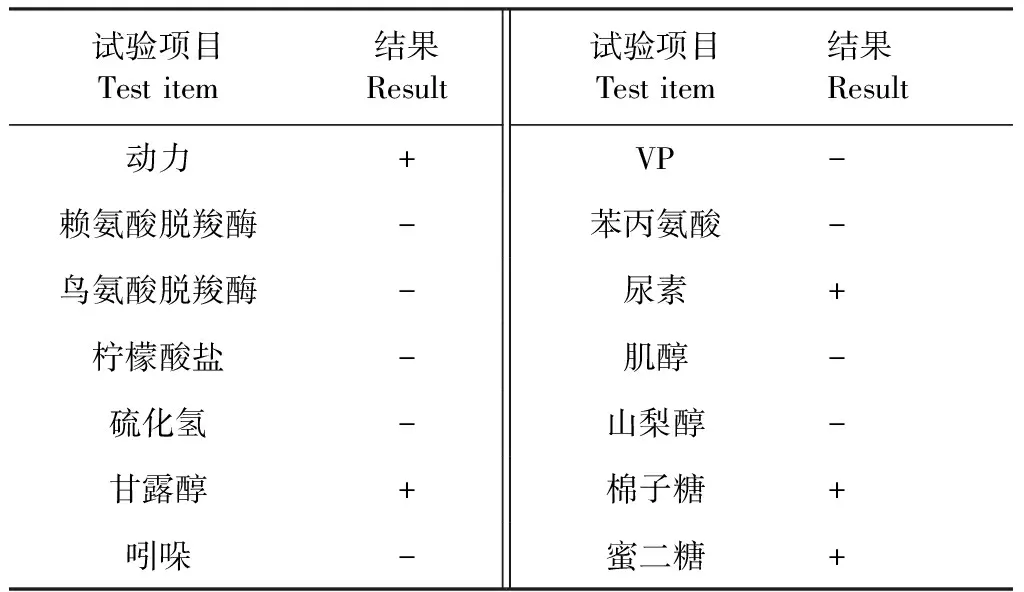
表1 生化鉴定结果Table 1 Biochemical identification results
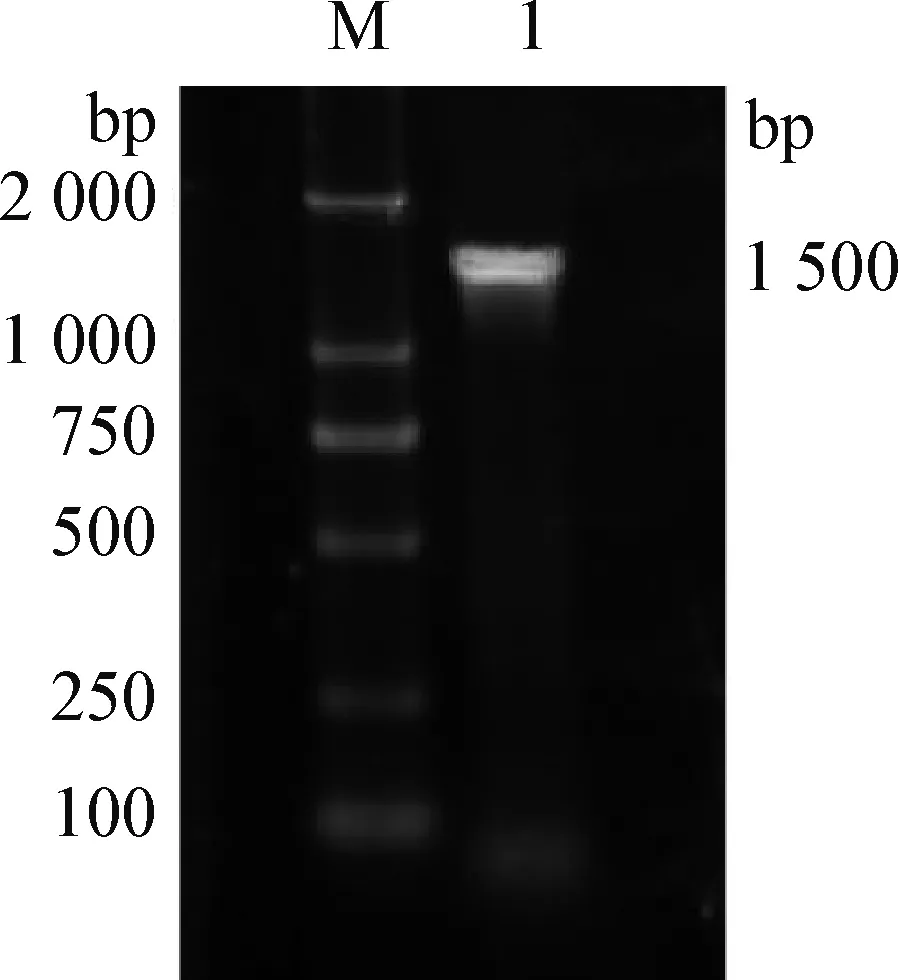
图2 分离菌16S rDNA基因PCR电泳结果Fig.2 PCR electrophoresis results of 16S rDNA gene of the isolateM:DNA Marker 2 000; 1:YXZC01

图3 菌株16S rDNA基因扩增序列系统发育树Fig.3 Phylogenetic tree of 16S rDNA gene amplification sequence of strains▲:本试验分离株▲:The strain isolated in this experiment
2.4 毒力基因检测 对分离出的大肠杆菌进行stx2毒力基因的检测,PCR扩增的stx2毒力基因电泳结果见图4,可见扩增出的目的基因条带大小约283 bp。测序结果通过NCBI中已报道的序列比对,并用DNASTAR软件中的Megaligan进行同源性分析,结果见图5,分离株与已报道的含有stx2的大肠杆菌的同源性达99.30%,说明分离出的大肠杆菌含有stx2毒力基因。
2.5 动物攻毒试验 5只攻毒的小鼠在攻毒后18 h内全部死亡,5只对照组小鼠精神、采食均正常。死亡小鼠剖检后用组织触片、革兰染色可见到具有大肠杆菌染色特征的细菌,如图6。并对肝脏、脾脏、肾脏进行H.E.染色观察,如图7所示,可见肝脏、脾脏等均有出血特征,且肾脏有颗粒变性现象。说明分离出的大肠杆菌具有较强致病性,且能引起组织出血。

图4 stx 2基因扩增电泳图Fig.4 Electrophoretogram of stx 2 gene product M: DNA Marker 2 000; 1:YXZC01目的基因stx2M: DNA Marker 2 000;1: The stx2 gene of YXZC01
2.6 药敏试验 分离到的出血性大肠杆菌对10种抗菌药物的敏感性见表2。该菌株对阿米卡星、硫酸黏菌素、恩诺沙星高度敏感;对头孢噻呋中度敏感;对阿莫西林、甲砜霉素、卡那霉素、庆大霉素、多西环素、氟苯尼考表现低度敏感。
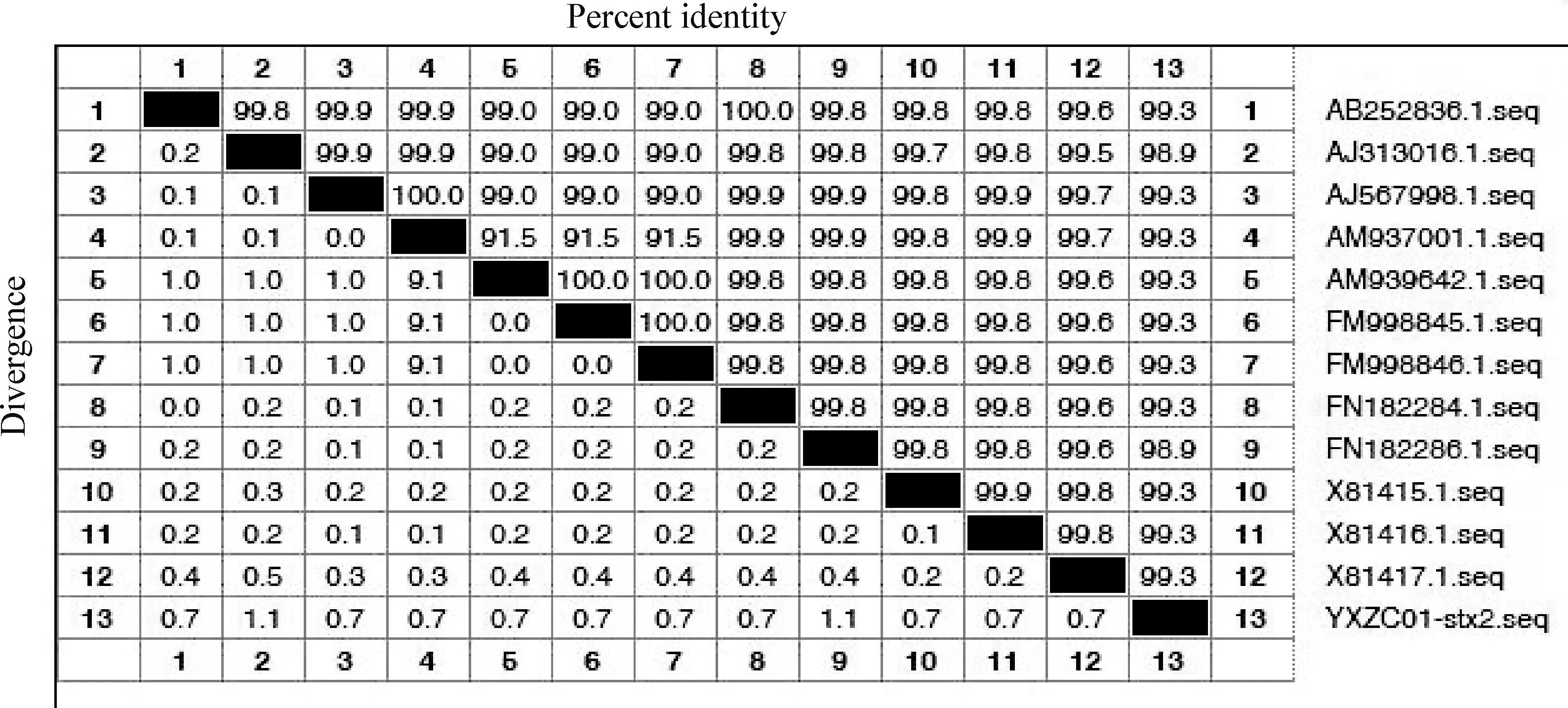
图5 大肠杆菌stx 2基因同源性对比Fig.5 Homology comparison of stx 2 gene in Escherichia coli 图右侧1~12:NCBI上下载基因序列的登录号; 13:测序序列 1-12 on the right side: The login numbers of downloading gene sequences on NCBI; 13: Sequencing sequences

图6 组织触片的染色结果(1 000×)Fig.6 Staining results of tissue contact(1 000×)
3 讨论
本试验根据发病猪的临床症状,通过对菌株分离培养、形态学观察、生化试验鉴定、动物攻毒试验和分子生物学等方法,最终判定引起该猪场发病的原因为致病性较强的出血性大肠杆菌。药敏试验结果表明,分离株菌对硫酸黏菌素、阿米卡星、恩诺沙星表现高度敏感,可为该养殖场临床兽医用药提供选择参考。
出血性大肠杆菌主要依靠它产生的志贺样毒素、溶血素和对上皮细胞的黏附力引起动物机体的损害。目前区分不同病原型的方法主要是检测其是否携带特定的毒力基因[6],在判断出血性大肠杆菌方面,主要是通过PCR方法分析其是否含有stx1、stx2这2个毒力基因[7]。而猪源的产志贺毒素的大肠杆菌主要为含有stx2毒力基因的大肠杆菌[8]。在2015年曾有文献报道关于牛源大肠杆菌的耐药情况及毒力基因的流行情况[9],但猪源感染大肠杆菌的耐药性和毒力基因流行情况,还需要更多的研究。可根据发病情况加强对出血性大肠杆菌的监测,为进一步建立大肠杆菌流行毒株预警机制并合理选择用药提供参考。
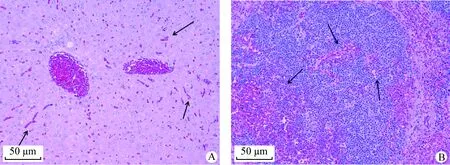
图7 肝脏、脾脏H.E.染色结果(200×)Fig.7 H.E. staining results of liver and spleen (200×) A:肝脏; B:脾脏; 箭头:出血 A: Liver; B:Spleen; Arrow: Bleeding

表2 药敏试验结果Table 2 Drug sensitivity test results
