小鹅瘟病毒的分离鉴定及遗传变异分析
2022-01-17江丹丹林锋强程晓霞朱小丽肖世峰陈仕龙陈少莺
江丹丹,林锋强,2,程晓霞,2,朱小丽,2,王 劭,2,肖世峰,2, 董 慧,2,陈仕龙,2,陈少莺,2
(1. 福建省农业科学院畜牧兽医研究所,福建 福州 350013 ; 2. 福建省畜禽疫病防治工程技术研究中心,福建 福州 350013)
小鹅瘟(Gosling plague,GP)是侵害雏鹅和雏番鸭的高度接触性传染病,病原为鹅细小病毒(Goose parvovirus,GPV)。该病最早由我国学者方定一于1956年首次发现,并在1961年成功分离到其病毒[1],随后我国及世界各地相继报道了小鹅瘟的发生[2-7],直到 1978 年该病病原被确定为鹅细小病毒。该病的病变特征为小肠黏膜表层大片坏死、脱落与纤维性渗出物凝成栓塞物或假膜包裹在肠内容物表面,堵塞肠腔形成“肠栓塞”[1]。该病一年四季均可发生,传播速度快,发病率和死亡率高,是危害养鹅业的重要传染病之一,给养鹅业造成重大损失[1-4]。我国上市推广应用的商品化GPV疫苗及高免血清,有效控制了小鹅瘟的流行和蔓延,但仍有发病死亡的报道[5-8]。本试验从临床以肠栓塞为特征的病死雏鹅病料中分离到3株病毒,经间接免疫荧光试验(IFA)、胶乳凝集试验(LPA)等免疫学方法和基因序列鉴定,确认分离毒为GPV经典毒株。结果报道如下。
1 材料与方法
1.1 病料来源及处理 2021年2月,福建省南平市3个未免疫小鹅瘟疫苗的养鹅场陆续出现疑似小鹅瘟疫病,5~9日龄的雏鹅突然发病,精神萎靡,离群独处,缩头,厌食,排稀粪,临死前头点地,死亡率45%~65%,剖检可见肠道内有不同程度的栓塞,无菌采集肝、脾、胰腺等组织,剪碎研磨,以Hanks液制成20%匀浆,冻融3次,10 000 r/min离心20 min,取上清液经0.22 μm滤器过滤后,供病毒分离用。
1.2 番鸭胚及细胞 番鸭胚购自非疫区,番鸭胚成纤维细胞(MDEF)按常规方法制备。
1.3 主要试剂 抗鹅细小病毒(GPV)单抗[10]和GPV单抗致敏胶乳诊断试剂[11],均为福建省农业科学院畜牧兽医研究所动物病毒研究室研制;异硫氰酸荧光素标记的羊抗鼠IgG(FITC-IgG),购自武汉博士德生物工程有限公司;EasyPure Genomic DNA Kit试剂盒、DH5α感受态细胞,均购自北京全式金生物技术有限公司;胶回收试剂盒,购自天根生化科技有限公司;TaKaRaExTaq、DNA marker DL2 000、DL5 000、pMD18-T,均购自TaKaRa公司。
1.4 GPV全基因扩增引物 扩增GPV全基因引物如表1所示,引物由生工生物工程(上海)股份有限公司合成。
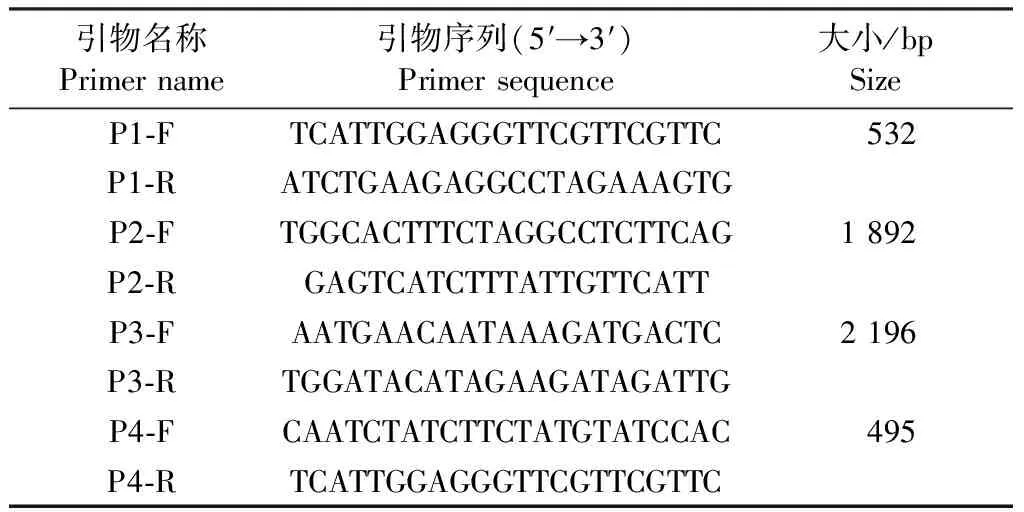
表1 引物序列信息Table 1 The information of primers
1.5 间接免疫荧光试验(IFA) 取内脏组织在冰冻切片机中切成6 μm的薄片,于冷丙酮中固定15 min后,自然晾干,加1∶100稀释的抗GPV单克隆抗体(一抗),并设以生理盐水代替一抗的空白对照,37 ℃湿盒中作用30 min,生理盐水冲洗5~6次,加按工作浓度稀释的FITC-羊抗鼠IgG(二抗),同上作用并冲洗后,以50% PBS甘油封片,置荧光显微镜下观察,以出现亮绿色特异性荧光病灶判定为阳性。
1.6 病毒分离 取1.1处理的匀浆上清经尿囊腔接种11日龄番鸭胚各3枚,0.2 mL/枚,石蜡封孔后置37 ℃温箱孵育,同时设不接毒对照组,每日照胚2次至7 d,弃去24 h内的死胚,胚胎濒死时置4 ℃冰箱4 h以上,解剖、观察病变,收获胚胎和胚液,-20 ℃冻存及传代,并取少许胚液和胚心,分别进行LPA效价测定和胚心冰冻切片IFA检测。
1.7 分离毒对MDEF的适应性试验 取长成单层的MDEF细胞,弃去生长液,接种1.6含毒胚液,在37 ℃、5%CO2培养箱中孵育1 h,用Hanks液润洗1遍,加足量培养液培养,同时设不接毒对照组,每天观察细胞病变至7 d,或当细胞出现病变达75%左右,置-20 ℃反复冻融3次,收获细胞及上清,-20 ℃冻存及传代。将收获的细胞毒同步接种于MDEF 96孔细胞培养板中,于37 ℃、5%CO2培养,当细胞病变达到30%时,弃去培养液,每孔加100 μL甲醇(预置-20 ℃),于4 ℃固定30 min,弃甲醇,用0.85%生理盐水洗涤1次,甩干,按1.5方法加一抗和二抗进行IFA检测。
1.8 胶乳凝集试验(LPA) 将分离毒用0.85%生理盐水做连续倍比稀释,取不同稀释度的混合液12 μL和6 μL GPV单抗致敏胶乳在洁净的96孔细胞培养板的板盖上混匀,于37 ℃水浴温箱中静置20 min,观察凝集反应,同时设阳性对照、阴性对照及致敏胶乳对照。结果判定参照文献[11],以出现“+”以上凝集判定为阳性,以出现“+”凝集的最高稀释度的倒数为分离毒凝集价。
1.9 全基因序列扩增及分析 取第3代尿囊液参照EasyPure Genomic DNA Kit试剂盒的说明书提取病毒核酸,根据GenBank中已发表的经典GPV株全基因序列(DY16株,MH209633.1),应用Oligo 6.0 生物软件设计了4对引物,依照TaKaRaExTaq说明书进行全基因片段的扩增。PCR产物进行电泳后利用回收试剂盒回收纯化,参照pMD18-T质粒试剂盒说明书进行基因克隆,挑取阳性克隆菌送至铂尚生物技术(上海)有限公司进行测序。应用LaserGene 7.1对获得的序列进行拼接,运用MegAlign软件对分离株的基因组序列进行分析,同时与国内外多株GPV全基因序列进行比较,并构建系统进化树。
2 结果
2.1 病死鹅IFA检测 3份病死雏鹅组织冰冻切片经抗GPV单抗为一抗的IFA检测显示组织切片上出现特异性荧光病灶,且荧光强弱不一,分布不均(图1),其中脾脏亮度最强,随后依次为肾脏、肝脏、胰腺和心脏。以生理盐水为一抗的组织切片无荧光反应,结果为阴性。

图1 病死雏鹅组织荧光检测结果(200×)Fig.1 Fluorescence test of dead gosling tissue(200×) A:脾脏; B:肾脏; C:肝脏; D:胰腺; E:心脏; F:空白对照组A: Spleen; B: Kidney; C: Liver; D: Pancreas; E: Heart; F: Blank control group
2.2 病毒的分离 组织匀浆上清接种番鸭胚尿囊腔并盲传3代,3份病料在盲传过程中出现死亡,暂将分离毒株命名为GPV NP1、GPV NP2、GPV NP5。其中GPV NP5盲传3代均出现死亡,随着代次增加,死亡时间由6 d缩短至4 d;GPV NP1和GPV NP2均在盲传第2代出现死亡(表2);剖检死胚可见胚体全身出血,而对照组番鸭胚未见异常(图2);死胚胚心切片的IFA检测显示呈GPV特异性亮绿色荧光阳性反应,而对照组胚心IFA呈阴性(图3)。

表2 番鸭胚接种组织匀浆后的死亡时间和胚液LPA效价Table 2 The death time and LPA titer of muscovy duck embryo inoculated with tissue homogenates

图2 病料接种番鸭胚胚体病变Fig.2 Lesions on infected muscovy duck embryoA: 正常番鸭胚对照; B: 接毒后4 d死亡番鸭胚病变A: Normal muscovy duck embryo control; B: Pathological changes of muscovy duck embryos that died 4 days after inoculation
2.3 LPA检测 从表2可知,收获的死胚尿囊液与GPV致敏胶乳可产生肉眼可见的特异性凝集颗粒,且随着盲传代次增加,其LPA效价也提高;而对照组尿囊液与GPV致敏胶乳无凝集反应。
2.4 MDEF适应性 取第3代尿囊液接种MDEF单层细胞培养并盲传3代,均在第3代出现细胞病变,表现为细胞折光性增强、圆缩,随后病变范围扩大,细胞逐渐脱落拉网。经IFA检测,结果显示在感染细胞核中的特异性亮绿色荧光为GPV阳性(图4),而对照组细胞无荧光反应为阴性。
2.5 分离株全基因序列特性分析
2.5.1 PCR扩增结果及进化树分析 3株分离毒经PCR扩增各获得4个片段,各片段长度均与预期大小一致,经基因测序鉴定后运用LaserGene 7.1软件进行拼接,获得分离株全基因序列:GPV NP1为5 045nt、 GPV NP2为5 045nt、GPV NP5为5 046nt。应用MegAlign软件分析将11条GPV相应全基因序列制作系统进化树(图5)。从图5可以看出,所比对的序列分为3个类群,3株分离株具有很高的同源性,与江苏扬州分离株DY16和重庆分离株RC16有很近的亲缘关系,而与鸭短喙矮小综合征病毒株M15和SC16,及GPV弱毒疫苗株SYG61v亲缘关系较远。

图3 死胚胚心切片IFA荧光病灶(200×)Fig.3 Fluorescent lesions in the heart of dead embryo (200×)A: 正常胚胚心; B: 感染死胚胚心A: Heart of normal embryo; B: Heart of dead embryo图4 分离毒致MDEF单层细胞荧光病灶(200×)Fig.4 Fluorescent lesions of MDEF monolayer on cells infected by isolated viruses(200×)A: 正常细胞; B: 感染细胞A: Normal cells; B: Cells after infection
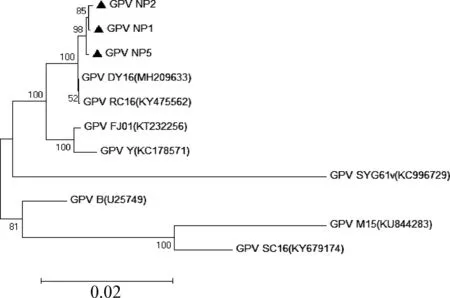
图5 分离株全基因遗传进化树Fig.5 Whole gene phylogenetic of isolated viruses ▲: 本次试验所得分离株 ▲: Isolates obtained in this experiment
2.5.2 核苷酸同源性分析 将分离株与在GenBank数据库获得的GPV序列进行核苷酸同源性比对,结果显示,3株分离株与GPV各毒株全基因核苷酸同源性在92.8%~99.8%,进一步分析可见,与鹅源DY16、RC16株的同源性最高,达99.7%以上;与匈牙利B株、安徽强毒株Y的同源性较高,在96.8%~97.4%;与鸭短喙矮小综合征病毒株M15株和SC16株,及GPV弱毒疫苗株SYG61v同源性低,在92.8%~94.3%。
3 讨论
免疫荧光技术分为直接免疫荧光(FA)[12]和间接免疫荧光方法(IFA),本试验应用抗GPV特异性单抗介导的间接免疫荧光方法(IFA),对送检疑似小鹅瘟的病死雏鹅肝脾胰肾等组织进行IFA检测,能快速准确诊断小鹅瘟病例。应用番鸭胚从IFA阳性组织样品中分离到3株病毒,经IFA、LPA、基因序列测定分析等鉴定确认分离毒为鹅细小病毒。疑似病料组织冰冻切片IFA检测显示,不同组织间特异性荧光强度不同,脾脏>肾>肝>胰>心,这与郭卉等[13]报道的肝脏>脾脏,潘玉民等[14]报道的肾>肝脏>胰腺>脾脏>心存在差异,可能与不同毒株特性、发病病程等有关。
GPV对体外细胞培养宿主专一性较强,鹅胚、番鸭胚及其原代细胞是分离和增殖病毒适宜的试验宿主,初次分离病毒以无母源抗体的番鸭胚和鹅胚最为敏感,且两者接种病毒后的死亡时间、胚体病变情况都大致相同。但番鸭胚或鹅胚中不应该存在抗GPV的母源抗体,否则病毒的复制将受影响[15-16]。本试验将病料匀浆上清接种番鸭胚进行病毒分离,GPV NP1、GPV NP2在盲传第 2代出现死亡,GPV NP5接种第1代即出现死亡,且随传代次数增加,死亡时间缩短至4 d左右,与死胚尿囊液的LPA结果基本吻合,说明3株分离毒对番鸭胚的致病力存在一定差异。收获的尿囊液接种MDEF细胞先折光性增强、圆缩,后呈拉网状直至裂解脱落,与文献报道的致细胞病变基本一致[2,15,17]。感染MDEF的IFA结果显示,特异性荧光主要集中在细胞核中,与文献报道一致[13,22]。
鹅细小病毒不仅是危害雏鹅和雏番鸭的重要疫病[2,17],随着病毒重组或不断变异,感染谱也不断扩大。自2015年以来,我国半番鸭、樱桃谷鸭群出现以短喙、舌外露、生长障碍等为临床特征的新疫病(俗称大舌病、短嘴矮小综合征等)[18-23],经病毒分离鉴定确认其病原为新型鹅细小病毒株或变异株。对分离毒的基因测序发现,本试验的3株分离毒与我国鹅源经典GPV(如DY16、RC16株)具有相似的基因组结构特征,同源性达99.7%以上,与匈牙利的B株同源性97%左右;与鸭短喙矮小综合征病毒M15株和SC16株同源性92.8%~94.3%。这些结果也表明了鹅细小病毒在不断变异和感染宿主谱不断扩大的同时,我国雏鹅群感染的经典GPV毒株至今仍然存在并流行。鹅细小病毒的变异程度不同,其导致的疫病型也不同,防控策略也有差异。因此,鹅细小病毒感染的复杂性和有效防控问题应引起水禽养殖业者和科研工作者的重视。
