加味肾气丸联合髓芯减压术、人牙髓基质干细胞移植对兔早期激素性股骨头坏死的治疗作用研究※
2022-01-15王新民白玉玺
许 杰 刘 飞 王新民 白玉玺 鲁 洋
(河北省秦皇岛市第一医院骨科,河北 秦皇岛 066000)
激素性股骨头坏死是由于患者长时间大量应用激素而引发,近年来随着激素在临床上应用的增多,激素性股骨头坏死的发病率也逐年增高,已成为最常见的非创伤性股骨头坏死类型[1]。目前,激素性股骨头坏死的发病机制尚不完全清楚,一般认为与持续骨内压增高、血管物理性损伤、动脉微血栓、静脉回流受阻等有关,其共同特点是股骨头的血运受损导致股骨头坏死[2]。早期发现、尽早干预是防治激素性股骨头坏死发生发展的关键。随着中医药和现代组织工程技术的发展,为早期激素性股骨头坏死的治疗提供了新的思路。本研究拟通过构建兔早期激素性股骨头坏死模型,然后采用加味肾气丸联合髓芯减压术、人牙髓基质干细胞(human dental pulp stem cells,hDPSCs)移植进行干预治疗并观察疗效,以期为临床治疗早期激素性股骨头坏死提供新方案。
1 材料与方法
1.1 实验动物 成年雄性日本大耳白兔50只,体质量2.0~2.5 kg,由湖北逸挚诚生物科技有限公司提供[动物生产许可证号:SCXK(鄂)2016-0020,质量合格证号:42817300000855],武汉云克隆龙科技股份有限公司进行饲养。hDPSCs齿源由北京泰盛生物科技有限公司提供。
1.2 实验药物 加味肾气丸(按照人兔的等效剂量换算,药物组成:附子1.8 g,桂枝1.8 g,山茱萸2.7 g,地黄2.7 g,山药2.7 g,牡丹皮2.7 g,茯苓2.7 g,泽泻2.7 g,杜仲5.4 g,牛膝2.16 g,丹参2.7 g,骨碎补2.7 g,白芥子1.62 g,菟丝子2.7 g,煎制浓缩为10 mL药液,药材均购自湖北省武汉市同仁堂药店);醋酸泼尼松龙注射液(浙江仙琚制药股份有限公司,国药准字H33020824)。
1.3 主要实验试剂与仪器
1.3.1 主要试剂 α-MEM培养基、谷氨酰胺、胰蛋白酶、血管内皮生长因子(VEGF)酶联免疫吸附法(ELISA)检测试剂盒(美国Gibco公司);胎牛血清[依科赛生物科技(太仓)有限公司];磷酸盐缓冲液(PBS)(北京索莱宝科技有限公司);分散酶、Ⅰ型胶原酶(美国Sigma公司);台盼蓝染色液(美国Bio-Rad公司)。
1.3.2 主要仪器 TDZ5-WS台式低速离心机(湘仪离心机仪器有限公司);TC20 全自动细胞计数仪(美国Bio-Rad公司);Accuri C6流式细胞仪(美国BD公司);兽用X光机(江苏康派宠物医疗科技有限公司);CKX53倒置显微镜(日本Olympus公司);Skyscan 1174型Micro CT机(德国Bruker公司)。
1.4 hDPSCs的获取和培养 由北京泰盛生物科技有限公司操作完成。
1.4.1 hDPSCs的获取 劈开牙齿用牙周刮匙拔出牙髓组织,转移到PBS的培养皿中进行清洁,并将分离的组织切成小块,移入50 mL离心管中,加入5 mL(37 ℃)预热消化酶溶液(4 mg/mL分散酶和3 mg/mL),在37 ℃水浴中孵育60 min,每隔10 min用涡流管彻底分解组织。孵育后加入3 mL完全培养基(α-MEM培养基添加15%胎牛血清(v/v),2 mmol/L谷氨酰胺,100 U/mL青霉素,100 mg/mL链霉素)使消化酶失活,通过70 μm细胞滤网得到单个悬浮细胞,然后以1200 r/min离心10 min,1 mL完全培养基复悬细胞。10 μL 0.4%台盼蓝染色液稀释10 μL细胞悬液,细胞计数仪测定细胞浓度及活力。将3×106的细胞接种150 mm培养皿中3 h,然后用PBS轻轻冲洗培养皿3次,去除未附着的细胞。将10 mL新鲜完全培养基放入培养皿中,接种7 d后更换完全培养基,然后继续培养7 d,细胞生长为一个小簇并形成菌落。
1.4.2 hDPSCs的培养 用3 mL PBS洗涤体外扩增的原代培养细胞2次,在150 mm培养皿中添加5 mL胰蛋白酶/乙二胺四乙酸(EDTA)溶液(37 ℃)分离降解细胞3 min。取5 mL完全培养基灭活胰蛋白酶/EDTA溶液,移液至50 mL离心管中,以1200 r/min离心7 min,吸取上清液,用完全培养基复悬细胞。然后将3×106个细胞接种入150 mm培养皿,进一步扩增。培育2~3 d后,细胞融合程度达80%~90%,进行传代,选第6代hDPSCs制备成单细胞悬液,见图1。
图1 第6代hDPSCs单细胞悬液(×100)
1.5 实验方法
1.5.1 分组及造模 将50只白兔随机分为正常组、模型组、髓芯减压组(以下简称髓减组)、髓芯减压+干细胞移植组(以下简称髓减干移组)、髓芯减压+干细胞移植+加味肾气丸组(以下简称髓减干移加味肾气丸组),每组10只。各组白兔均适应性饲养1周后,除正常组外其余各组均予醋酸泼尼松龙注射液8 mg/kg于右臀部肌肉注射,正常组予等容积0.9%氯化钠注射液于右臀部肌肉注射,每周2次,共6周。各组白兔同时均予青霉素注射液8万单位/kg于左臀部肌肉注射,预防感染,每周2次,共6周。
1.5.2 给药干预 正常组和模型组造模期间不予任何干预。髓减组于造模第4周后给予髓芯减压术治疗。髓减干移组于造模第4周后予髓芯减压术+hDPSCs移植治疗。髓减干移加味肾气丸组在开始造模第1天即开始进行加味肾气丸灌胃,每次10 mL,每周2次,连续灌胃12周,于造模第4周后予髓芯减压术+hDPSCs移植治疗。
1.5.2.1 髓芯减压术 将白兔用3%戊巴比妥钠麻醉后取仰卧位固定,常规消毒,以右侧大转子为中心,沿股骨方向切开长约1.5 cm切口,暴露股骨大转子及股骨粗隆,在X线透视引导下用髂骨穿刺针抵在股骨大转子与股骨颈平行,且与股骨干呈70°钻孔,钻入股骨头髓腔内,拔出导针,抽吸减压。共治疗1次。
1.5.2.2 hDPSCs移植 髓芯减压术过程中,当减压完成后,立即沿髓芯减压孔注入3×106个hDPSCs,分别于造模第4、5、6周各注射1次。
1.6 观察指标及方法
1.6.1 组织病理学观察 各组白兔分别于造模第12周采用气栓法处死。解剖并取出右侧股骨头,采用4%多聚甲醛液固定,5%硝酸脱钙,冠状面剖开取材,常规乙醇梯度脱水,石蜡包埋切片,苏木精-伊红(HE)染色。然后在显微镜下对骨小梁、骨细胞、髓腔结构等进行详细观察,最后利用显微镜随机选择6个观察区域,每个区域计算出50个骨陷窝,统计其中空骨陷窝情况并计算空骨陷窝率。
1.6.2 血清VEGF检测 各组白兔在处死前通过耳缘静脉抽血,并采用ELISA检测血清VEGF水平,操作严格按照试剂盒说明进行。
1.6.3 Micro CT检测 采用Micro CT对各组股骨头样本进行扫描检测。电压50 kV,电流800 μA,再以扫描分辨率26.8 μm、视野大小1304×1024像素对股骨头扫描拍片,连续拍摄150张不同角度不同细节的切片,以骨小梁作为三维重建的基点,通过软件做成三维图像并将其还原重建、分析,计算骨体积分数(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁数量(Tb.N)、骨小梁分离度(Tb.Sp)、结构模型指数(SMI)、骨密度(BMD)。

2 结果
2.1 各组造模第12周股骨头组织病理学观察 造模第12周,正常组软骨细胞排列有序,骨髓腔内骨小梁整齐,成骨细胞数量多。模型组软骨细胞排列紊乱,大小不一,破骨细胞较多,脂肪细胞数量显著增加。与模型组相比,髓减组、髓减干移组、髓减干移加味肾气丸组软骨细胞排列较整齐,成骨细胞有所增加,脂肪细胞明显减少,并可见注射牙髓干细胞的区域骨细胞致密饱满、量大清晰、增生活跃,造血细胞丰富。见图2。

图2 各组造模第12周股骨头组织病理学变化(HE,×100)
2.2 各组造模第12周空骨陷窝率比较 见表1。

表1 各组造模第12周空骨陷窝率比较
由表1可见,与正常组比较,模型组造模第12周空骨陷窝率升高,比较差异有统计学意义(P<0.05),提示造模成功。与模型组比较,髓减组、髓减干移组、髓减干移加味肾气丸组造模第12周空骨陷窝率均降低,比较差异均有统计学意义(P<0.05)。与髓减组比较,髓减干移组、髓减干移加味肾气丸组造模第12周后空骨陷窝率均降低,比较差异均有统计学意义(P<0.05)。与髓减干移组比较,髓减干移加味肾气丸组造模第12周空骨陷窝率降低,比较差异有统计学意义(P<0.05)。
2.3 各组造模第12周血清VEGF水平比较 见表2。
表2 各组造模第12周血清VEGF水平比较
由表2可见,与正常组比较,模型组造模第12周血清VEGF水平降低,比较差异有统计学意义(P<0.05)。与模型组比较,髓减组、髓减干移组、髓减干移加味肾气丸组造模第12周血清VEGF水平均升高,比较差异均有统计学意义(P<0.05)。与髓减组比较,髓减干移组、髓减干移加味肾气丸组造模第12周血清VEGF水平均升高,比较差异均有统计学意义(P<0.05)。与髓减干移组比较,髓减干移加味肾气丸组造模第12周血清VEGF水平升高,比较差异均有统计学意义(P<0.05)。
2.4 各组造模第12周股骨头Micro CT扫描情况比较 造模第12周,正常组扫描显示骨髓腔内骨小梁数量、形态正常,排列整齐,密度均匀;三维重建结果显示骨小梁结构完整,方向性佳,连接良好。模型组可见骨髓腔内骨小梁数量明显减少、变细、疏松,部分骨小梁已断裂、丢失,出现低密度区;三维重建结果显示骨小梁三维空间结构破坏,方向性差,排列紊乱,与周围骨小梁连接性差,出现低密度区。髓减组、髓减干移组、髓减干移加味肾气丸组则可见骨髓腔内骨小梁数量逐渐增多、变粗,密度升高,断裂骨小梁基本恢复正常,低密度区几乎消失;三维重建结果显示骨小梁三维空间结构基本完整,方向性佳,排列整齐,与周围骨小梁连接性佳,偶然见少许低密度区,髓芯减压孔已消失,周围明显异位骨化。见图3。各组造模第12周BV/TV、Tb.Th、Tb.N、Tb.Sp、SMI、BMD情况比较 见表3。
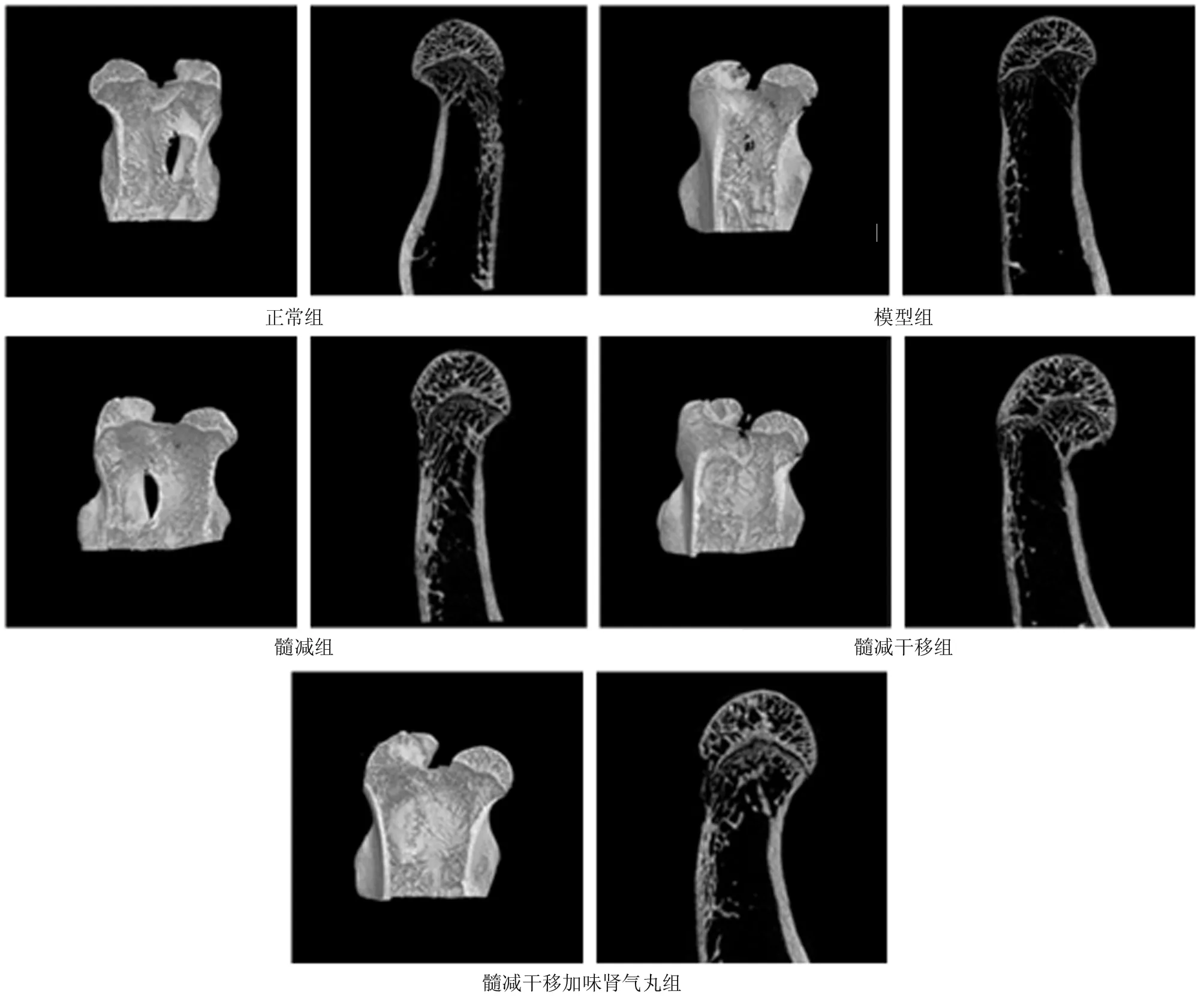
图3 各组造模第12周股骨头Micro-CT扫描情况比较(各组左为三维重建图,右为扫描断层图)

表3 各组造模第12周BV/TV、Tb.Th、Tb.N、Tb.Sp、SMI、BMD情况比较
由表3可见,与正常组比较,模型组造模第12周BV/TV、Tb.Th、Tb.N、BMD均降低,Tb.Sp、SMI均升高,比较差异均有统计学意义(P<0.05)。与模型组比较,髓减组、髓减干移组、髓减干移加味肾气丸组造模第12周BV/TV、Tb.Th、Tb.N、BMD均升高,Tb.Sp、SMI均降低,比较差异均有统计学意义(P<0.05)。与髓减组比较,髓减干移组、髓减干移加味肾气丸组造模第12周BV/TV、Tb.Th、Tb.N均升高,Tb.Sp、SMI均降低,比较差异均有统计学意义(P<0.05)。与髓减干移组比较,髓减干移加味肾气丸组造模第12周BV/TV、Tb.N均升高,Tb.Sp、SMI均降低,比较差异均有统计学意义(P<0.05)。
3 讨论
股骨头坏死是一种股骨头血液供应受损或中断,导致骨细胞死亡、骨组织受到破坏而引起的慢性进行性致残性疾病,根据其发病原因的不同可分为创伤性与非创伤性两大类,其中激素性股骨头坏死是非创伤性股骨头坏死的最常见类型[3]。目前,激素性股骨头坏死的发病机制还未完全清楚,一般认为主要有以下几种原因:①脂肪代谢紊乱导致栓塞,从而阻碍了血液的微循环;②使用激素过量导致血管内皮细胞严重损坏,从而出现前凝血的情况,导致红细胞异常凝结引起微血管栓塞;③激素无法正常代谢排出,在体内蓄积会降低成骨细胞的正常功能,严重者会导致骨质疏松,骨小梁稀疏、塌陷,进一步破坏微循环;④激素诱导细胞毒性,导致氧自由基代谢紊乱[4-6]。早期干预和治疗是防止激素性股骨头坏死发生发展的关键,髓芯减压术是临床上常用的方法之一,通过钻孔减压能够有效的降低骨内压,改变血液循环的内环境,从而优化股骨头血液供给[7]。但也有学者认为单纯髓芯减压治疗效果并不确切,仅仅通过降低骨内压不能成为治愈股骨头坏死的方法,这一方法只是暂时的缓解部分血液黏度,推测大概是因降低压力过程中,微小创伤会刺激机体保护机制,从而释放一些细胞因子致使血管通透性暂时性增加,而这个阶段过去之后,血管通透性就会消失,因此提倡多种方法联合治疗以获得更佳的治疗效果[8-9]。
随着医学技术的不断发展,干细胞移植技术的成熟为激素性股骨头坏死提供了一种更佳的治疗方案,骨髓间充质干细胞和牙髓基质干细胞是临床上最常用的种子细胞[10-11]。骨髓间充质干细胞属于成体干细胞,来源于中胚层,是具有成骨、成软骨、成脂肪等多向分化潜能的一类干细胞,研究已证实其在体外和体内均有向成骨细胞分化的能力,是治疗股骨头坏死比较理想的种子细胞之一[12-13]。牙髓基质干细胞是存在于牙髓组织中具有分化和繁殖能力的祖/干细胞,于2000年Gronthos S等学者在研究人牙髓细胞的过程中所发现[14]。有学者将hDPSCs和其他干细胞研究比较发现,hDPSCs在增殖能力和克隆形成能力方面具有更大的潜力,并已被证实可以分化为成骨、软骨、成牙本质等多种细胞,且其获取途径更方便,来源广,而在科研和临床研究中广泛应用[15]。
激素性股骨头坏死属中医学骨痿、骨蚀等范畴,为本虚标实之证,以肾虚为本,血瘀为标。《灵枢·刺节真邪》记载:“虚邪之入于身也深,寒与热相搏,久留而内着,寒胜其热,则骨疼肉枯;热胜其寒,则烂肉腐肌为脓,内伤骨,内伤骨为骨蚀。”中医学认为,肾为先天之本,主骨生髓,肾精充足,骨髓生化有源,骨骼得以滋养,则骨质坚韧,肾精亏虚,骨髓生化无源,骨骼失养,则痿弱无力。若先天禀赋不足,肾精亏虚,后又受激素药邪热毒侵扰,内犯经络,导致气血痹阻,髓海瘀滞,筋骨失养,髓死骨枯而发本病[16]。故治疗应以补肾助阳、活血化瘀为主。肾气丸原方出自汉·张仲景《金匮要略》,为补肾助阳的经典方剂,方中附子、桂枝温肾助阳,温经通脉;地黄、山药、山茱萸配伍乃“阴中求阳”之意,滋阴补肾生精,补肝养脾益精,如此则阳得阴助而生化无穷;茯苓、泽泻健脾益气,利水渗湿;牡丹皮清热凉血,活血化瘀。在原方基础上加杜仲、菟丝子、牛膝补益肝肾,逐瘀通经,肝充则筋健,肾充则骨强;骨碎补补肾壮阳,坚骨活血;丹参活血祛瘀,通络止痛;芥子化痰逐饮,散结止痛。现代医学研究发现,肾虚证患者BMD普遍较正常人低,且钙、磷等代谢异常,还能通过干预相关基因的表达影响骨代谢,能使机体的微量元素发生变化,影响机体正常生长发育和骨骼结构功能[17-19]。补肾活血类中药可通过下调激素性股骨头坏死大鼠股骨头组织中细胞核转录因子κB受体活化因子配体(RANKL)、核心结合因子α1(Cbfα1)蛋白和mRNA的表达,促进股骨头坏死骨修复和新生骨的生成[20]。
骨陷窝是骨组织中骨细胞胞体所在的腔隙,当骨组织受到破坏,骨细胞发生凋亡后就会形成空骨陷窝,可在一定程度上反映出股骨头坏死的情况[21]。VEGF是一种高度特异性的促血管内皮细胞生长因子,具有促进血管内皮细胞迁移、增殖和血管形成等作用,在改善股骨头缺血,促进坏死修复的过程中具有重要作用[21]。Micro CT是一种新的检测方法,可以无创获得标本的骨微观结构主要参数,提取断层图像,并在必要时进行三维重建,准确的评价骨微观结构[22]。本研究结果显示,造模后模型组空骨陷窝率较正常组明显升高,血清VEGF水平明显降低,微观结构参数BV/TV、Tb.Th、Tb.N、Tb.Sp、SMI、BMD也均有明显改变,提示骨组织受到破坏,而髓减组、髓减干移组、髓减干移加味肾气丸组经相应治疗后,空骨陷窝率较模型组明显降低,血清VEGF水平明显升高,微观结构参数BV/TV、Tb.Th、Tb.N、Tb.Sp、SMI、BMD均有不同程度的改善,且综合比较来看以髓减干移加味肾气丸组治疗效果最好,这也与前文学者提倡多种方法联合治疗的结论一致[8-9]。
综上所述,加味肾气丸联合模型兔髓芯减压术、hDPSCs移植治疗早期激素性股骨头坏死疗效确切,可有效促进坏死股骨头血管再生,改善局部血运,促进骨细胞增殖,促进骨组织修复,多种方案联合治疗具有明显优势。
