有无睑板腺功能障碍患者眼表菌群组成对比△
2022-01-15曹宇辰张杰鑫黎颖莉易果果
曹宇辰 张杰鑫 黎颖莉 易果果 符 敏
睑板腺功能障碍(MGD)是一种慢性的睑板腺分泌异常的疾病,通常以睑板腺开口的阻塞和/或睑脂分泌的质和量的变化为特征。它可能导致泪膜改变,从而导致眼部刺激症状等临床症状明显的炎症和眼表疾病[1]。有研究显示,亚洲人群中MGD患病率约为60%,其中30岁以下人群患病率为33%,60岁以上人群患病率为72%[1-3]。此前的研究显示,眼表菌群变化可能与MGD等眼表疾病的发生发展相关[3-4]。但细菌感染在与MGD相关的炎症中的致病作用仍有待进一步证实,即便如此,各类局部抗生素仍常被用于治疗MGD[5]。值得注意的是,细菌培养的结果常很不准确。不同于皮肤和消化道表面,由于泪膜的抗菌特性和眼睑的持续机械作用,微生物不易附着于眼表面,因此眼表面的微生物群落十分稀疏[6-7]。加之,受细菌培养技术局限性的影响,眼表微生物菌群的变化对MGD患者的影响仍未明确。但研究眼表菌群变化与MGD的联系可以向我们提供有关MGD发病机制的线索。
基于上述背景,本研究我们采用16S rRNA高通量测序,对包括了非MGD(NMGD)和MGD患者的共89名受试者进行了眼表菌群组成的测定,以期了解MGD患者与NMGD者之间以及不同程度MGD患者之间的眼表菌群的差异。
1 资料与方法
1.1 一般资料2018年6月至2018年10月在南方医科大学珠江医院招募57例MGD患者为MGD组,其中,男29例,女28例,年龄15~84(56±14)岁。同时招募32名健康志愿者为NMGD组,男15名,女17名,年龄20~77(50±18)岁。MGD组与NMGD组受试者年龄和性别匹配(P=0.322、0.375)。纳入标准:(1)受试眼停戴角膜接触镜6个月以上;(2)无全身系统性疾病;(3)无除MGD外眼部其他疾病;(4)无眼外伤史或手术史。排除标准:(1)近3个月内使用可能影响眼表菌群的药物或纤维补充剂;(2)有贫血、胃肠道疾病或慢性疾病者;(3)怀孕或哺乳。双眼同时符合入选标准时,随机选取一眼入组。研究团队成员向每位参与者详细解释了课题内容,进而取得了受试者的书面知情同意。本研究得到南方医科大学珠江医院伦理委员会的批准,并根据《赫尔辛基宣言》的宗旨进行。
1.2 MGD的诊断和分级由两名经验丰富的眼科医生基于临床表现,参照文献[8]的标准对MGD进行独立诊断:(1)超过3个月的眼表症状(眼部干燥、疲劳、灼烧感和/或异物感、沙砾感);(2)裂隙灯检查见睑板腺孔堵塞;(3)睑板腺分泌物的质(睑脂混浊、伴或不伴分泌物中的条絮或颗粒、睑脂黏稠如膏状)和/或量异常。按照表1的标准将MGD患者分为3级,纳入研究的57例MGD患者中,25例为Ⅰ级,20例为Ⅱ级,12例为Ⅲ级。

表1 MGD分级标准
1.3 样本收集眼表面麻醉后,由同一名医生使用一次性无菌干棉签对受试者的上睑、下睑、泪阜和穹隆结膜分别采集样本,共得到来自89名受试者的89份DNA样本,这些样本在采集后立即置入无菌管中,-80 ℃保存备用。
1.4 DNA提取物使用DNA提取试剂盒从棉签中提取细菌DNA,并按照说明书用超微量紫外分光光度计(Thermo Fisher Scientific,MA,美国)测量浓度和纯度。PCR分析之前,向每个样品中添加20 mL的洗脱缓冲液,并立即转移到-20 ℃储存备用。
1.5 PCR扩增和16S rRNA测序使用Invitrogen(Carlsbad,CA,美国)合成长度为12 bp的条形码引物,以89份DNA样本为模板,行PCR扩增细菌16S rRNA的V3-V4片段,之后使用Illumina Miseq(PE 300)测序,SynGene基因分析软件分析。
1.6 数据分析使用QIMME(版本1.8.046)读取序列,使用操作分类单位表生成细菌16S rRNA序列,并在R软件中显示。观测物种的α多样性指数,包括Chao 1指数、Shannon指数、Simpson指数、Dominance指数和PD-whole-tree,并使用QIIME(V1.9.1)显示受试者眼表菌群的多样性、丰富度或均匀性。通过R软件使用k-样本Fisher-Pitman排列检验显示以上数据。为了评估89份样本在物种多样性上的差异,使用QIIME软件计算了Bray-Curtis相异度、加权和未加权的Unifrac Beta多样性指数。通过主坐标分析(PCoA)获取主坐标,将复杂、多维的数据可视化,在R软件中通过QIIME和ggplot2包显示。基于Bray-Curtis距离矩阵,对两组间门、属水平前30个物种的丰度进行热图分析。进行LEfSe分析是为了确定两组之间是否存在显著性差异,并寻找每组中特定的生物标记物。
2 结果
2.1 16S rRNA基因序列分析为了确定细菌的多样性,整个修剪的16S rRNA序列被聚集成操作分类单位,这些序列通过在线软件(V10;http://www.drive5.com/usearch/)分析,其中,≥97%相似的序列被分配给相同的操作分类单位。PCR扩增后共产生了5 365 536个测序读数。在去除低质量或非细菌的16S rRNA序列读数后,对每个样本使用5 001 025个高质量读数(占总读数的93.21%)进行进一步分析,结果见表2。
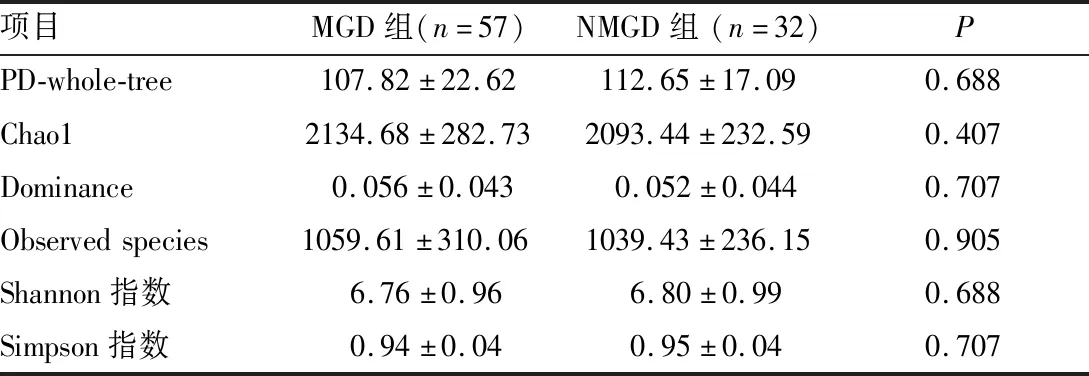
表2 MGD组与NMGD组受试者16S rRNA基因序列基本信息表
2.2 两组受试者眼表菌群对比将每位受试者的细菌16S rRNA测序读数分为门水平和属水平。在门水平上,眼表菌群在MGD组被分成37门,在NMGD组被分成38门(占比在0.01%以上的菌门被纳入)。两组眼表菌群均由14个主要门类主导(括号内分别为各菌门在MGD组和NMGD组测序的占比),包括酸杆菌门(1.70%vs.1.60%)、放线菌门(5.91%vs.6.68%)、拟杆菌门(14.45%vs.14.79%)、绿弯菌门(1.47%vs.1.70%)、蓝细菌门(1.80%vs.1.80%)、Epsilonbacteraeota(1.11%vs.1.07%)、厚壁菌门(16.75%vs.17.42%)、浮霉菌门(1.36%vs.1.51%)、变形菌门(48.67%vs.50.90%)、异常球菌-栖热菌门(0.29%vs.0.33%)、梭杆菌门(0.29%vs.0.33%)、Patescibacteria(0.82%vs.0.87%)、螺旋体门(0.27%vs.0.34%)、疣微菌门(0.98%vs.1.03%),它们一起占所有测序的约 97%。上述14个菌群门类占比两组受试者间差异均无统计学意义(均为P>0.05)。
在属水平上,MGD组和NMGD组受试者的16S rRNA测序读数被分为15个菌属(括号内分别为各菌属在MGD组和NMGD组测序的占比),即不动杆菌属 (8.30%vs.7.95%)、芽孢杆菌属 (7.39%vs.7.38%)、金黄杆菌属 (2.55%vs.2.35%)、柠檬酸杆菌属 (1.02%vs.0.98%)、棒状杆菌属(2.61%vs.2.74%)、毛螺旋菌属(1.06%vs.0.80%)、Pedobacter(2.10%vs.2.10%)、发光杆菌属 (2.01%vs.1.49%)、假单胞菌属 (14.93%vs.14.10%)、罗尔斯顿菌属 (1.55%vs.1.70%)、红假单胞菌属 (0.99%vs.1.07%)、鞘氨醇单胞菌属(1.95%vs.1.86%)、葡萄球菌属(1.08%vs.2.36%)、 链球菌属(0.83%vs.0.80%) 和硫杆菌属 (1.18%vs.1.05%),上述15个菌属两组受试者间差异均无统计学意义(均为P>0.05)。
2.3 两组受试者眼表菌群多样性的比较MGD组与NMGD组受试者间眼表菌群的Shannon指数、Simpson指数、Chao 1指数及Dominance指数差异均无统计学意义(均为P>0.05), 表明MGD组和NMGD组受试者眼表菌群具有相似的丰度和均匀度。 PCoA分析结果表明,MGD组与NMGD组受试者间结膜菌群构成差异无统计学意义(未加权的Unifrac PCoA;P>0.05)(图1)。
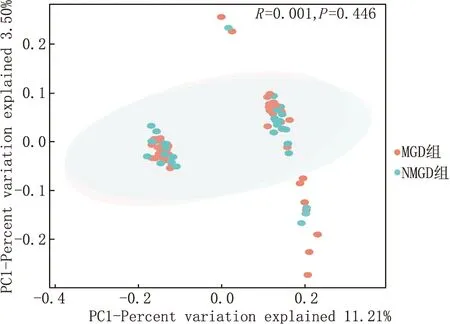
图1 使用未加权的 Unifrac 方法构建主坐标分析 MGD组和NMGD组受试者的结膜菌群
LEfSe分析结果显示,与NMGD组受试者相比,MGD组患者的眼表富含Sphingorhabdus、AKYH767、Hydrogenobaculaceae、Hydrogenobaculum、Aquificales和Aquificae,这些细菌可以归类为 MGD 细菌。 然而,与 NMGD 组受试者相比,MGD组患者眼表中Kocuria、Cyanobium-PCC-6307、Terrimicrobiaceae、厌氧黏杆菌、Archangiaceae和Chloroflexi-bacterium-RBG-16-58-14的含量显著降低(LDA 评分>2分)(图 2)。
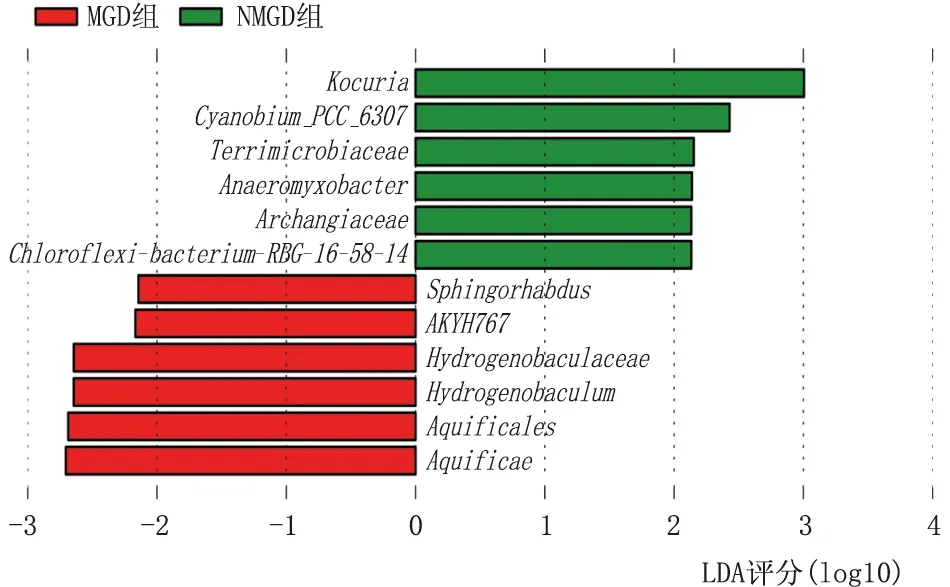
图2 根据使用 LEfSe 算法计算的 MGD组和NMGD组受试者间的比较确定的LDA值列出的分类群
2.4 MGD不同分级患者间眼表菌群的差异对MGD组患者的细菌16S rRNA测序读数进行分类,可见10个菌门占优势(括号内为各菌门相对丰度在不同样本中的范围):变形菌门(33.33%~67.78%)、拟杆菌门(8.74%~31.41%) 、放线菌门(1.88%~30.97%)、厚壁菌门(5.56%~30.49%)、Patescibacteria(0.50%~8.88%)、酸杆菌门(0.39%~6.71%)、绿弯菌门(2.11%~5.77%)、蓝细菌门(3.29%~4.87%)、疣微菌门(0.80%~3.60%)和浮霉状菌门(0.26%~3.87%)。在这些菌门中,前三位(变形菌门、厚壁菌门和拟杆菌门)共占42.07%~100.00%。
I级、II级、III级MGD患者中拟杆菌门、Epsilonbacteraeota和变形菌门相对丰度间差异均有统计学意义(均为P<0.05)。与 II 级MGD患者相比,I级MGD患者眼表中拟杆菌门(P=0.012) 和Epsilonbacteraeota (P=0.006)均显著减少,变形菌门(P=0.001)显著增加(表3)。 尤其,部分患者以单一菌门为主,例如某MGD患者变形菌门总测序读数的相对丰度为 67.78%。
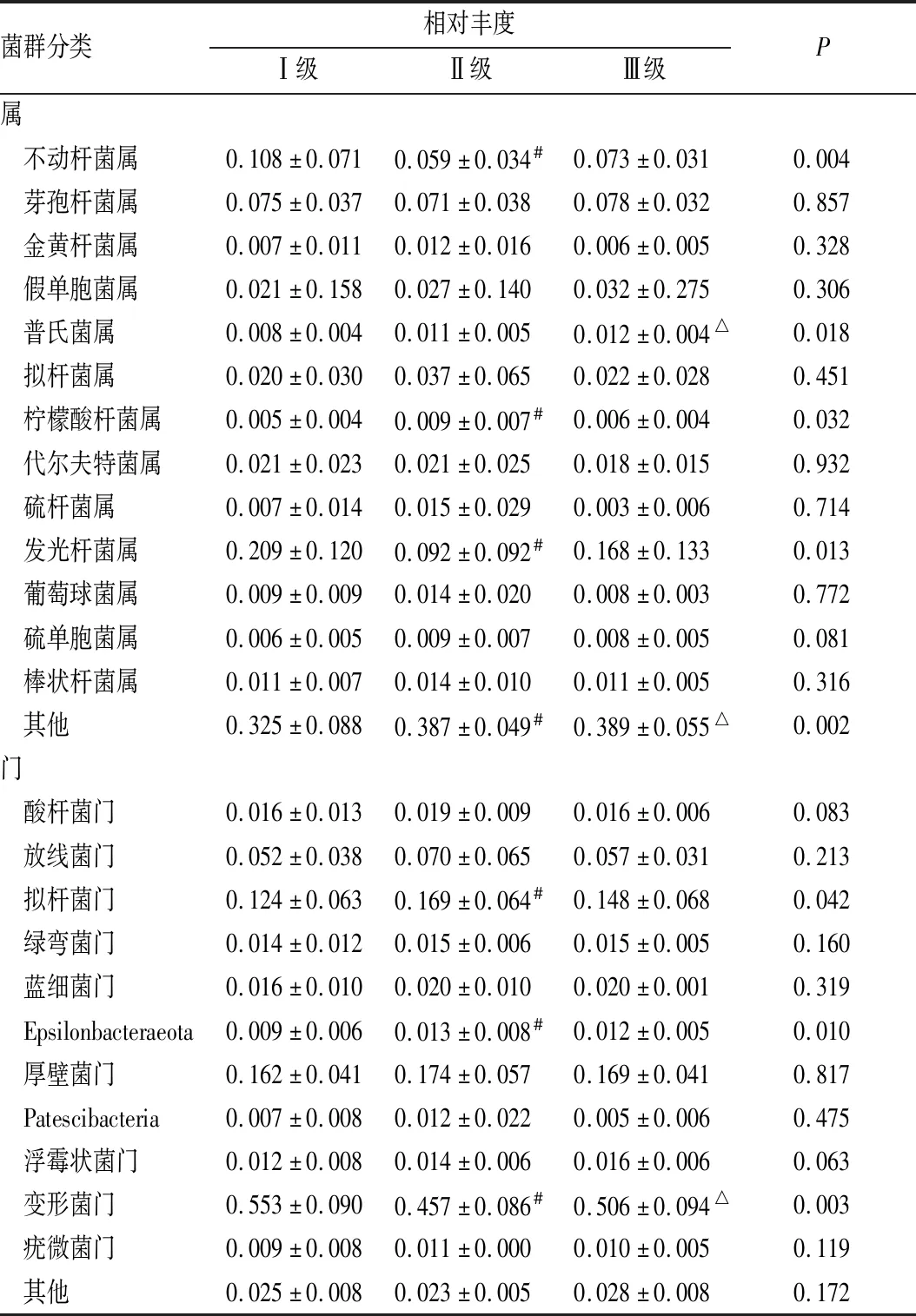
表3 MGD组不同分级患者眼表菌群的相对丰度
在属层面上,13个菌属被确定为MGD患者的常见菌属(括号内为菌属相对丰度在不同样本中的范围),分别为不动杆菌属(5.86%~10.77%)、芽孢杆菌属 (7.05%~7.50%)、金黄杆菌属 (2.12%~3.16%)、假单胞菌属(1.71%~41.23%)、普氏菌属(0.00%~7.24%)、拟杆菌属 (0.00%~4.78%)、柠檬酸杆菌属 (0.84%~1.21%)、代尔夫特菌属 (0.54%~0.10%)、硫杆菌属(0.40%~3.75%)、发光杆菌属(1.77%~2.08%)、葡萄球菌属 (0.93%~1.40%)、硫单胞菌属 (0.40%~2.98%) 和棒状杆菌属 (0.17~2.85%)。
在I级、II级、III级MGD患者中,不动杆菌属、普氏菌属、柠檬酸杆菌属、光细菌属和未分类菌属相对丰度间差异均有统计学意义(均为P<0.05)。与 II 级MGD患者相比,I级MGD患者眼表中不动杆菌(P=0.001) 和假单胞菌 (P=0.004)显著增加,代尔夫特菌(P=0.009) 和未分类物种(P=0.002)显著减少。与III级MGD患者相比,Cirobacter (P=0.012) 和未分类物种(P=0.005) 在 I 级中MGD患者显著减少(表3)。
2.5 MGD不同分级患者间眼表菌群的统计学比较α多样性分析结果表明,I级、II级和III级MGD患者眼表菌群的发育多样性(Shannon指数)存在显著差异(P=0.006)。 根据Shannon指数,II级MGD患者眼表菌群多样性最高,而I级MGD患者眼表菌群多样性最低。 此外,I级、II级和III级MGD患者在Dominance指数上差异具有统计学意义(P=0.012)。从Dominance指数来看,I级MGD患者优势菌最多,II级MGD患者优势菌最少。MGD组I级、II级和III级患者之间PD-whole-tree(P=0.117)、Chao 1指数(P=0.456)和Simpson指数(P=0.090)相比,差异均无统计学意义(图3)。
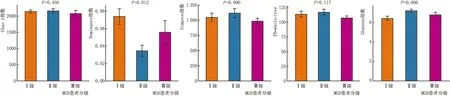
图3 I级、II级、III级MGD患者结膜菌群的α多样性
使用未加权的Unifrac(图4A)和加权的Unifrac方法(图4B)构建的 PCoA 图结果表明,I级、II级、III级MGD患者之间的样品可以清楚地区分(未加权的Unifrac、加权的Unifrac分别为P=0.013、P=0.039)。 各组菌群培养后,I级和II级MGD患者样本中菌群紧密地聚集在一起,而III级MGD患者样本菌群生长遍布了整个培养基。 为了进一步确定可以区分MGD患者和正常受试者的生物标志物,进行了 LEfSe 分析(LDA 评分 >3.5分,P<0.05)。在I级、II级和III级MGD患者中,共有22个菌群差异有统计学意义(均为P<0.05)。I级MGD患者眼表中γ变形杆菌、杀香鱼假单胞菌、假单胞菌、不动杆菌、莫拉菌、醋酸钙不动杆菌、Caldibacillus、弧杆菌和阿氏芽孢杆菌的相对丰度较高;II级MGD患者显示出最独特的眼表菌群,其特征是差异球菌科、异形杆菌科、毛螺螺旋科、肠杆菌科、弯曲杆菌和Epsilonbacteraeota数量较高;而III级MGD患者眼表菌群富含柠檬杆菌、弗氏柠檬酸杆菌、δ-变形菌纲和着色杆菌(图5)。
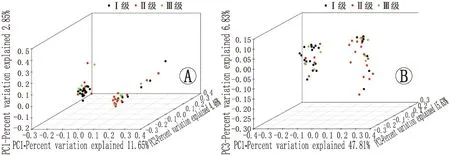
图4 I级、II级和III级MGD 患者结膜菌群的3D-PCoA分析 A:I级(黑点)、II级(红点)和III级(绿点)MGD患者中的未加权的Unifrac PCoA;B:I级(黑点)、II级(红点)和III级(绿点)MGD患者之间的加权的Unifrac PCoA。
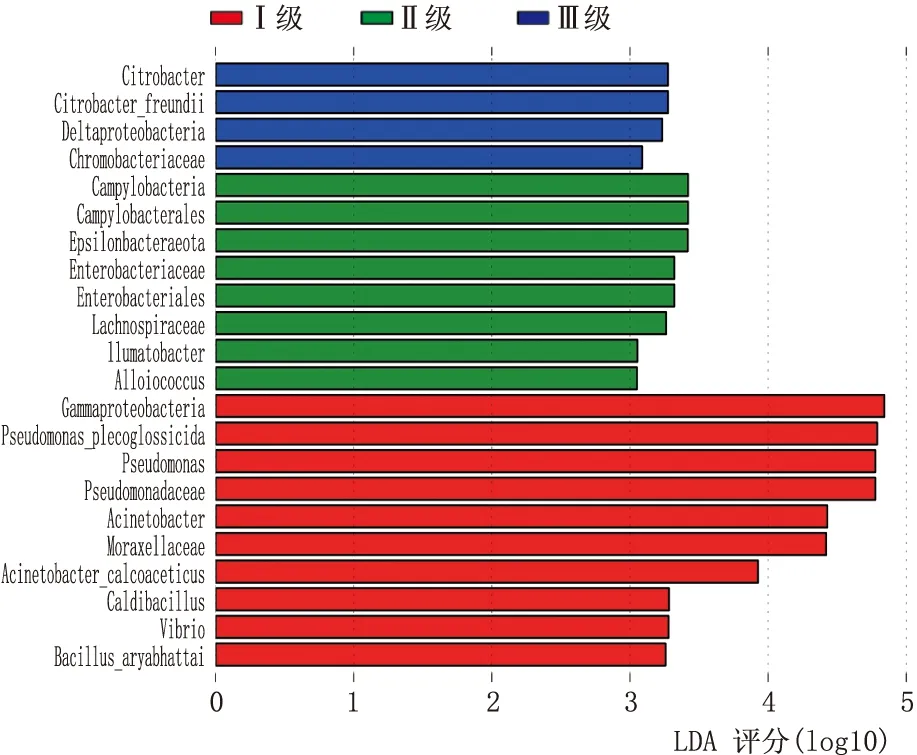
图5 根据使用 LEfSe 算法计算的 MGD I级、II级和III级患者间的比较确定的LDA值列出分类群
3 讨论
健康的眼表菌群可以保护眼表免受疾病侵害。现有的研究结果表明,在健康人群的结膜表面,同时有需氧菌群(24.0%~90.6%)和厌氧菌群(51.6%~77.3%)附着,其中以凝固酶阴性葡萄球菌和痤疮丙酸杆菌为主[1-4]。而当眼表面菌群失调,其屏障功能减弱,就可能罹患眼表疾病。已有研究揭示了眼表菌群可能在眼表疾病的病理生理过程中发挥重要作用,如干眼症、睑缘炎和MGD等[9-10]。有研究报道,在正常健康结膜中,细菌培养阳性率为24%~75%[11-12],而在干眼患者结膜中,细菌培养阳性率高达97%[12]。此外,与健康人群相比,睑缘炎和结膜炎患者结膜中的金黄色葡萄球菌和表皮葡萄球菌数量增加[13]。可见,细菌数量与眼表疾病的发生相关。
利用高通量测序技术,许多研究人员在他们的研究中得到了一些与此前认知相悖的结果。如Huang等[14]曾报道了一些从未被发现的细菌可能可以代表健康结膜微生物群的核心属。而利用16S rDNA PCR技术,Graham等[12]在MGD和干眼症患者的结膜微生物群中都发现了多种潜在致病菌。此外, Lee等[15]研究表明,与健康人群相比,睑缘炎患者的结膜上发现的细菌群落明显减少。随着高通量测序技术日趋成熟,相关研究的结果可能比基于传统方法的研究结果具有更高的可信度。
本研究利用高通量16S rRNA测序,对比分析了MGD患者和NMGD受试者中结膜菌群的组成。本研究结果显示,MGD患者和NMGD受试者具有类似的结膜菌群构成。值得关注的是,芽孢杆菌和葡萄球菌被认为是干眼、眼睑炎和其他眼表疾病的共同病原体[16],但本研究结果显示,MGD患者和NMGD受试者眼表菌群构成之间没有差异。同样与此前研究结果相悖的还有,我们通过α多样性和PCoA图得到MGD患者与NMGD受试者的眼表菌群差异没有统计学意义(P>0.05)的结论。在此前基于细菌培养的研究结果显示,分离出的主要物种是表皮葡萄球菌(厌氧菌)和痤疮丙酸杆菌(厌氧菌),且MGD患者的结膜囊和睑板腺分泌物中细菌培养阳性率显著提高,需氧菌和厌氧菌的分布范围更广,该研究还显示,MGD患者睑板腺分泌物(需氧菌为75.6%,厌氧菌为34.3%)和结膜囊(需氧菌为64.7%,厌氧菌为30.8%)中细菌培养阳性率较健康人群显著增高(P>0.05)[17]。从这些研究中可以看出,眼表患病者的眼表微生物群落发生了变化,这种改变可能参与了眼表疾病的发病过程。虽然本研究结果表明,MGD患者的眼表菌群与NMGD受试者在统计学上没有差异,但这给我们一个启示,即眼表菌群的改变在MGD的发病中起到的作用可能远低于我们的预估。值得一提的是,在本研究中,MGD组患者和NMGD组受试者眼表均发现了一些既往研究中发现的致病菌,如芽孢杆菌和葡萄球菌等。
同时我们也发现,在不同严重程度的MGD患者之间,包括不动杆菌属、柠檬酸杆菌属、普氏菌属、发光杆菌属和未分类菌属在内的眼表菌群,在统计学上有显著差异(均为P<0.05)。而在其他研究中,也曾报道过Lysinibacillu、麦氏棒状杆菌等致病菌在不同程度MGD患者中也有显著差异(均为P<0.01)[17]。此外,眼表菌群发育多样性Shannon指数(P=0.006)和Dominance指数(P=0.012)在I级、II级和III级MGD患者之间差异均具有统计学意义。在I级MGD患者的样本中培养出了较多的优势菌,而在II级MGD患者中则培养得到的优势菌最少,表明II级MGD患者中眼表菌群丰度和均匀度均高于其他两组。PCoA图也显示I级、II级和III级MGD患者样本间的明显差异(P=0.039),在I级和II级MGD患者的样本中,菌落紧密相邻生长,而在III级MGD患者的样本中,菌落生长遍布了整个培养基。
此前有研究报道,在MGD患者和NMGD受试者的睑缘都发现了类似的微生物组成,同时报道了一些细菌,如痤疮丙酸杆菌,与MGD严重程度呈正相关[18],这在一定程度上与我们的研究结果一致。Jiang等[19]研究认为,MGD的严重程度与较高的分离率、细菌菌落数和细菌生长程度呈正相关,这在一定程度上与我们的研究结果一致。此外,在Graham等[12]的报道中也提及,健康人群和疾病程度最严重的MGD患者之间眼表的平均细菌计数有显著差异(P<0.005),这也说明了MGD的严重程度和眼部微生物群落之间的关系。据此,我们可以初步得出结论,随着MGD严重程度的变化,眼表微生物群落也会发生改变,但改变的方向还仍待进一步探究。
此外,尽管细菌在MGD患者的病理生理过程中的作用仍然不确定,以阿奇霉素为代表的局部抗生素仍常用于治疗MGD,以求抑制某些被认为与MGD有关的致病性微生物生长[5],且在临床中,这样的治疗方案也收到了一定的效果。为了更好地治疗MGD,我们应该在了解不同严重程度的MGD患者眼表菌群改变的基础上,进行个性化抗菌治疗。我们的研究结果将进一步阐明不同严重程度的MGD患者眼表面菌群的差异,为个体化和特异性的抗菌治疗提供参考依据。
由于地理、人种等的差异以及样本量、研究方法、细菌的演化等因素的影响,我们的研究得到了不同于此前研究的一些结果。我们认为,本研究使用的16S rRNA高通量测序技术得到的结果更可信。但在现有条件下,16S rRNA高通量测序对于活微生物和死亡微生物的辨别仍然存在缺陷[18,20]。此外,不同程度MGD患者中眼表菌群改变所带来的功能和代谢通路改变仍不明确,针对这些细菌改变的个体化和特异性治疗方法也有待深入探索。
