黄腐酸对大豆内源激素的调控及结瘤能力的影响
2022-01-14侯慧云徐梦蕾郭昱娴袁红莉高同国朱宝成
侯慧云,徐梦蕾,郭昱娴,袁红莉,高同国,朱宝成
(1.河北农业大学 生命科学学院,河北 保定 071000;2.中国农业大学 生物学院,北京 100194)
大豆与根瘤菌形成的特殊结构——根瘤可以将空气中的氮气还原为氨而被植株直接吸收利用[1],而根瘤的形成和发育过程受到多种植物内源激素的共同调控[2]. 在大豆结瘤初期,生长素的准确定位、运输和积累起着非常重要的作用[3-4],苜蓿LAX基因(MedicagotruncatulaLAX,MtLAX)有助于生长素的积累,在皮层、根瘤菌侵染部位和生长中的根瘤原基中表达,Mtlax2突变体中侵染线形成和结瘤发育均受损[5];细胞分裂素在结瘤初期作为一种关键的信号分子,可以诱导苜蓿和百脉根早期结瘤基因ENOD40的表达[6],促进根瘤原基的形成[7];Camille等[8]研究发现赤霉素能够同时调控根瘤菌侵染过程和根瘤原基形成过程;乙烯负调控根瘤的形成和发育,沉默表达乙烯的EIN2基因会出现超结瘤表型[9-10];脱落酸通过干扰结瘤因子引起的钙离子峰来控制根瘤数量[11-12],同时,脱落酸还抑制了细胞分裂素对ENOD40的诱导,与细胞分裂素拮抗调控根皮层结瘤的发生[13].在根瘤原基分裂细胞中,由细胞分裂素引起的生长素局部积累对根瘤器官的形成至关重要[14].生长素、细胞分裂素和脱落酸相互平衡、相互协调,共同决定形成侧根还是根瘤[6,15].
腐植酸是由动植物残体经过一系列生化反应形成的天然高分子有机混合物[16-17],而黄腐酸是腐植酸中分子质量最小、活性最好的全水溶有机芳香族类物质[18],具有生长调节剂的作用. Rezazadeh等[19]研究发现叶面喷施腐植酸肥显著提高了作物根系生长、根瘤数量和根瘤含氮率. 邱小倩等[20]和张云婷[21]也证实喷施黄腐酸可提高苜蓿结瘤数量、根瘤鲜重及单位质量固氮酶活性,进而提高苜蓿产量.另外,黄腐酸可提高土壤中固氮菌的竞争力,使其在根系的活力和数量显著增加,从而加强根系的生物固氮作用[22-23]. 高同国[24]采用蛋白质组学方法研究了黄腐酸提高大豆结瘤的机理,表明黄腐酸诱导结瘤过程涉及物质运输、能量代谢、DNA合成与修复、氮代谢、碳代谢等过程. Capstaff等[25]采用转录组学方法证实黄腐酸提高苜蓿的结瘤数量,其过程涉及结瘤初期转录因子、根瘤菌和激素诱导的植物反应相关基因、结瘤相关基因. 本研究前期经热裂解气相色谱质谱分析发现黄腐酸中含有黄酮类物质结构[24],并且证实黄腐酸可以提高大豆的结瘤能力.已有研究表明生长素、细胞分裂素、脱落酸、赤霉素等内源激素在大豆结瘤中起着重要调控作用[2],但黄腐酸与内源激素如何共同作用影响大豆结瘤数量还不清楚. 本文通过研究大豆结瘤固氮初期黄腐酸对植株内源性激素含量和分布的影响,为解析黄腐酸提高大豆根瘤固氮的机理提供理论依据.
1 材料与方法
1.1 实验材料
供试菌株:辽宁慢生根瘤菌(Bradyrhizobiumliaoningense) CCBAU 05525(中国农业大学根瘤菌研究中心保存菌种).
黄腐酸:由中国农业大学环境微生物实验室赠与.
供试种子:冀豆17,购买于市场.
试剂:细胞分裂素ZT、赤霉素GA3、生长素IAA、脱落酸ABA、染料木黄酮,以上试剂均购于Biotopped公司.
YMA培养基:甘露醇 10 g,KH2PO40.25 g,K2HPO4·3H2O 0.327 g, MgSO4·7H2O 0.2 g,NaCl 0.1 g,酵母粉 0.8 g,蒸馏水1 L,pH 7.0;固体培养基加琼脂20 g.
低氮植物营养液(1 L):Ca(NO3)20.03 g,CaSO4·2H2O 0.582 g,KCl 0.075 g,MgSO4·7H2O 0.06 g, K2HPO4·3H2O 0.178 g,柠檬酸铁 0.075 g,微量元素 1 mL.
微量元素配方(1 L):H3BO32.86 g,MnSO4·H2O 2.02 g,ZnSO4·7H2O 0.22 g,CuSO40.512 g,H2MoO40.02 g.
1.2 实验方法
1.2.1 辽宁慢生根瘤菌的培养
将辽宁慢生根瘤菌(B.liaoningense) CCBAU 05525 在YMA固体培养基上28 ℃活化3 d,挑取单菌落转接到YMA液体培养基中,28 ℃ 170 r/min培养约7 d,使OD600值达到1左右,备用.
1.2.2 大豆的栽培
大豆种子用体积分数95%的酒精消毒1 min,用体积分数5%的H2O2消毒3 min,无菌水冲洗5~6次后避光、浸泡过夜.将浸泡后的大豆转入无菌带滤纸的培养皿中,滤纸提前用无菌水润湿,室温避光催芽,待大豆长出1 cm左右的芽时备用. 在超净工作台中将灭菌蛭石装到中间带孔、用无菌纱布连接低氮培养液的双层瓶中.将发芽的大豆种进蛭石中,上层用封口膜隔绝外界,放置于人工气候培养箱培养.培养箱设定为光照16 h,温度25 ℃;黑暗8 h,温度22 ℃,湿度60%.当幼苗长出蛭石层面2~3 cm时将上层封口膜剪开,保证植株生长.
1.2.3 实验设计
待植株的子叶刚好张开,正要长出第1片真叶的时候,对幼苗进行处理.处理分5组,如表1所示,其中G为对照组,G300H、G500H、G1000H为实验组,GM为阳性对照组.接种后,分别在第1、2、3、5、8、12天取样,每个处理取3个重复,每个重复分离根、茎、叶,并分别用锡纸包好,液氮冷冻5 min后放-80 ℃冰箱保存备用.长出根瘤的,将其从根系分离并计数.
1.2.4 植物内源激素的提取
采用陈雪梅等[26]的高效液相色谱法(HPLC)法略加改动. 将样品放入液氮研磨后,分3次加6 mL 体积分数80%(含体积分数1%冰乙酸)的甲醇提取液,4 ℃浸提15 h后,4 ℃ 10 000 r/min离心10 min,吸取上清液1 mL,与3 mL体积分数1%的冰乙酸溶液混匀,过C18萃取小柱,用6 mL 体积分数10%的甲醇清洗杂质,再加入0.5 mL 体积分数80%(含体积分数1%冰乙酸)的甲醇洗脱,收集洗脱液过0.22 μm微孔滤膜后,直接上样测定各激素含量.
1.2.5 植株内源激素的测定条件
所用仪器为Agilent Technologies 1260型高效液相色谱仪. 色谱柱为Hadesil C18柱(250 mm×4.6 mm,5.0 μm),流动相为甲醇和超纯水(体积比45∶55),进样量为50 μL,流速为0.8 mL/min,柱温30 ℃,检测波长254 nm,定量方法为外标法,通过ZT、IAA、GA3、ABA标准曲线定量,每个样品3次重复.
1.3 数据处理
采用IBM SPSS 23.0对数据进行处理和方差分析,采用Excel 2017制图.
2 结果与分析
2.1 黄腐酸对大豆根瘤数目的影响
接种根瘤菌后,大豆结瘤情况如图1所示. 根瘤从第12天开始出现,第16天几乎全部植株都已结瘤并且其中一些根瘤横切面呈暗红色,趋于成熟. 接种后第12天,G500H组结瘤数量显著高于其他处理组,比G组多43.9%,而G1000H组此时还没有形成明显根瘤. 第16天G500H组结瘤数量最多,比G组多73.1%,比阳性对照GM组多18.9%;G300H组结瘤数量比G组多32.1%,而G1000H组比G组根瘤数少39.2%,即1 000 mg/L的黄腐酸抑制了大豆结瘤.实验再次证实适宜质量浓度的黄腐酸可以提高大豆结瘤数量,而高质量浓度的黄腐酸反而起到抑制作用.
表1 实验处理

同一天不同字母表示差异显著(P<0.05).图1 单株大豆结瘤数量Fig.1 Nodulation number of soybean per plant
2.2 黄腐酸对大豆植株中ZT含量的影响
2.2.1 黄腐酸对大豆根系ZT含量的影响
黄腐酸对大豆根系中ZT含量的影响见图2. 与对照组(G组)相比,黄腐酸促进了结瘤初期根部ZT的积累. G300H组在第3天ZT含量(质量分数,下同)达到最高值32.3 μg/g,第12天含量最低,为7.4 μg/g;G300H组ZT含量在第1天比G组高383.4%. G500H组ZT含量在第3天达到最高值37.7 μg/g,在第12天含量最低,为22.6 μg/g;在测定的时间内G500H组ZT含量都比对照组的高,在第1天最高多304.3%. G1000H组从使用后就表现出抑制作用,与对照组相比其值偶有增加. 阳性对照GM组在第1天表现出最高值47.3 μg/g,在第3天表现最低值1.1 μg/g. G300H组和G500H组与对照G组相比,ZT含量增加,表现为促进作用,其在第1天最高,比对照G组含量分别高383.4%和304.3%,表明300 mg/L和500 mg/L的黄腐酸均可提高根中ZT含量.

同一天不同字母表示差异显著(P<0.05).图2 黄腐酸对结瘤初期大豆根部ZT含量的影响Fig.2 Effect of fulvic acid on ZT content of soybean roots at the early stage of nodulation
2.2.2 黄腐酸对大豆茎部ZT含量的影响
黄腐酸对大豆茎中ZT含量的影响见图3.与对照组相比,黄腐酸促进了结瘤初期茎中ZT的积累. G300H组在第2天达到最高值52.0 μg/g,在第12天处于最低值2.5 μg/g. G500H组在第2天达到较高值66.4 μg/g,但在第8天出现极高的现象,达到了81.9 μg/g;G500H组ZT含量在第2、3、5、8天都比对照高. G1000H组从使用后就表现出抑制作用,只在第12天ZT含量比对照G组高.阳性对照GM组在第1天出现最高值28.8 μg/g;除第3天外,GM组ZT含量都比对照G组含量高.说明适宜质量浓度的黄腐酸可以提高茎中ZT含量.
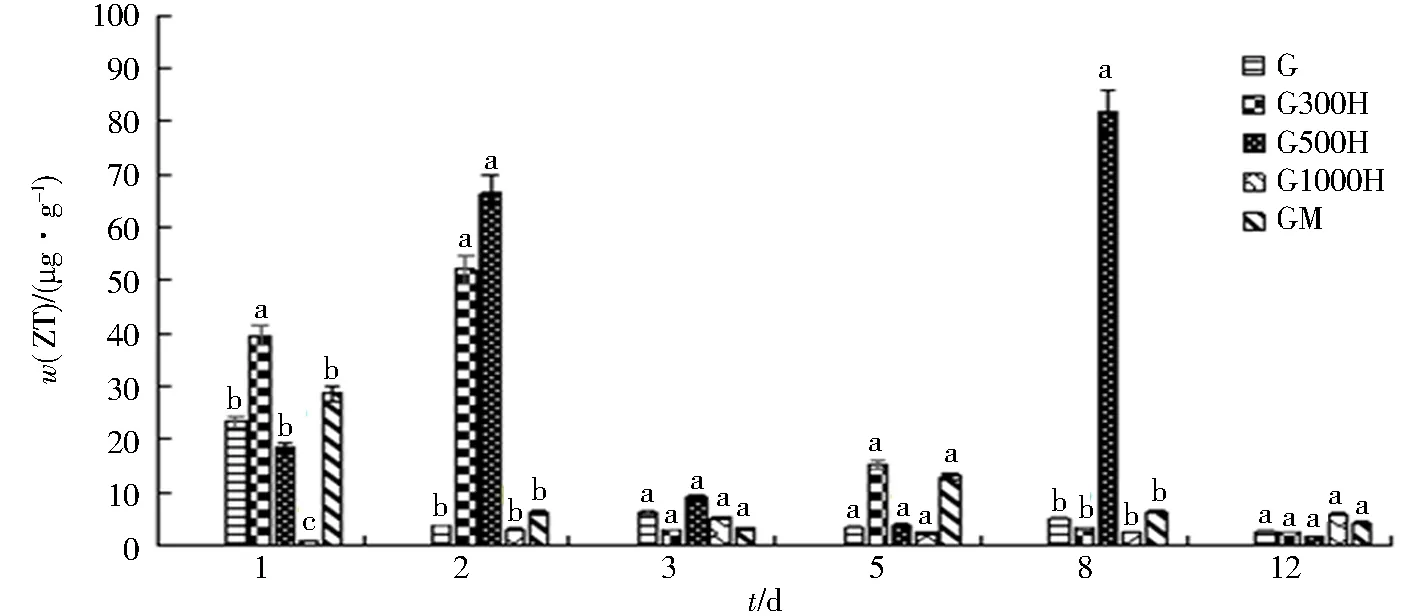
同一天不同字母表示差异显著(P<0.05).图3 黄腐酸对结瘤初期大豆茎中ZT含量的影响Fig.3 Effect of fulvic acid on ZT content of soybean stems at the early stage of nodulation
2.2.3 黄腐酸对大豆叶中ZT含量的影响
黄腐酸对大豆叶中ZT含量的影响见图4.与对照组相比,黄腐酸促进了结瘤初期叶中ZT的积累. G300H组从接种后叶中ZT含量先减少后增多,在第3天含量降到最低值2.2 μg/g,在第1天含量最高,为16.0 μg/g. G500H组在第5天达到最低值5.0 μg/g,在第1天含量最高,为23.6 μg/g;在第1、2、3、8、12天G500H组ZT含量都比对照组高. G1000H组从使用后就基本表现为抑制作用,与对照组相比仅在第12天表现为增加. 阳性对照GM组在第2天出现最低值2.9 μg/g,第12天最高,为25.9 μg/g. G300H组和G500H组表现为促进作用,其在第12天时最高,分别比对照组ZT含量高196.0%和245.1%.上述结果说明500 mg/L的黄腐酸提高叶中ZT含量更显著.
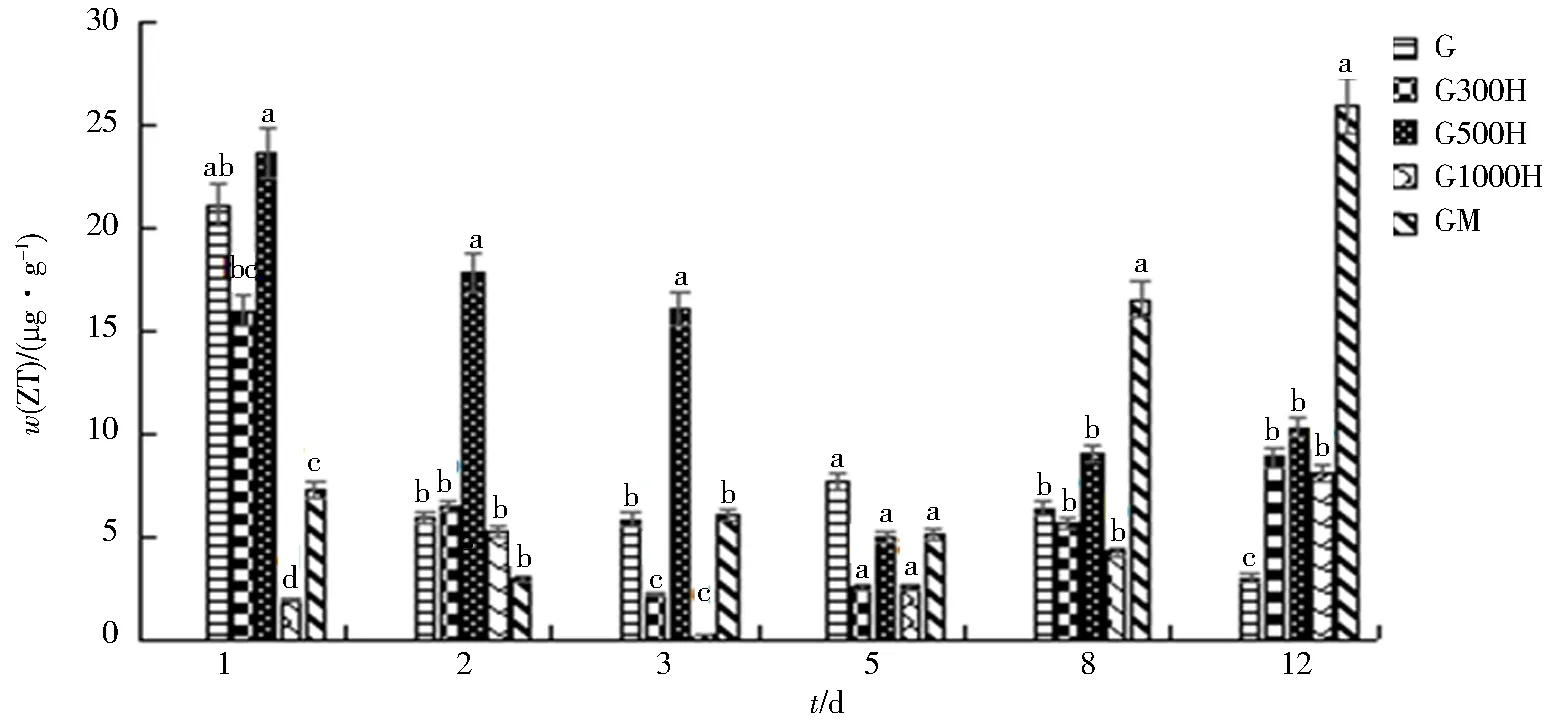
同一天不同字母表示差异显著(P<0.05).图4 黄腐酸对结瘤初期大豆叶中ZT含量的影响Fig.4 Effect of fulvic acid on ZT content of soybean leaves at the early stage of nodulation
2.3 黄腐酸对大豆植株中IAA含量的影响
2.3.1 黄腐酸对大豆根系IAA含量的影响
黄腐酸对大豆根系中IAA含量的影响见图5.由图5可知,黄腐酸促进了结瘤初期根部IAA的积累. G300H组在第5天达到最低0.8 μg/g,在第12天达到最高值3.7 μg/g. G500H组在第5天达到最低0.7 μg/g,在第12天达到最高值8.1 μg/g;除第5天外,G500H组IAA含量均高于对照组. G1000H组与对照组相比其值偶有增加. 阳性对照GM组在第1天IAA含量最低,为1.3 μg/g,在第12天最高,为7.5 μg/g. 上述结果说明500 mg/L的黄腐酸提高根部IAA含量效果更好.

同一天不同字母表示差异显著(P<0.05).图5 黄腐酸对结瘤初期大豆根部IAA含量的影响Fig.5 Effect of fulvic acid on IAA content of soybean roots at the early stage of nodulation
2.3.2 黄腐酸对大豆茎中IAA含量的影响
黄腐酸对大豆茎中IAA含量的影响见图6.图6表明黄腐酸促进了结瘤初期茎中IAA的积累. G300H组在第5天达到最低值2.1 μg/g,在第12天达到最高值4.5 μg/g. G500H组IAA含量在第3天达到最低值1.6 μg/g,在第12天达到最高值13.4 μg/g;G500H组IAA含量在第1、5、8、12天都比对照组高. G1000H组前期起抑制作用,从第5天后表现为促进作用. 阳性对照GM组与G300H组相似,在第5天达到最低值1.7 μg/g,在第12天达到最高值6.7 μg/g. 由此可知,500 mg/L的黄腐酸一定程度上提高了茎中IAA含量.

同一天不同字母表示差异显著(P<0.05).图6 黄腐酸对结瘤初期大豆茎中IAA含量的影响Fig.6 Effect of fulvic acid on IAA content of soybean stems at the early stage of nodulation
2.3.3 黄腐酸对大豆叶中IAA含量的影响
黄腐酸对大豆叶中IAA含量的影响见图7.由图7可知,黄腐酸促进了结瘤初期叶中IAA的积累. G300H组在第2天达到最低15.2 μg/g,在第12天达到最高值33.2 μg/g. G500H组IAA含量在第5天达到最低32.4 μg/g,在第12天达到最高值104.8 μg/g;除第5天外,G500H组IAA含量均高于对照组. G1000H组与对照组相比,前期表现为促进作用而后期表现为抑制作用. 阳性对照GM组在第2天出现最低值19.9 μg/g,在第8天最高,为71.2 μg/g. 从图7可知,G500H组基本都比G300H组IAA含量高,即500 mg/L的黄腐酸对叶中IAA含量影响最明显.

同一天不同字母表示差异显著(P<0.05).图7 黄腐酸对结瘤初期大豆叶中IAA含量的影响Fig.7 Effect of fulvic acid on IAA content of soybean leaves at the early stage of nodulation
2.4 黄腐酸对大豆植株中GA3含量和分布的影响
2.4.1 黄腐酸对大豆根系GA3含量的影响
黄腐酸对大豆根系中GA3含量的影响见图8.图8表明,黄腐酸促进了结瘤初期根部GA3的积累. G300H组在第5天达到最低值13.7 μg/g,在第8天达到最高值87.2 μg/g;G300H组GA3含量在第1、2、8、12天均高于对照组. G500H组GA3含量整体呈先升后降趋势,在第1天最低,为42.6 μg/g,第8天最高,为330 μg/g;除第5天外,G500H组GA3含量均比对照组高. G1000H组在第3天达到最低值20.8 μg/g,在第8天达到最大值189.3 μg/g;除第3天外,G1000H组GA3含量都比对照组的高,其也表现出了促进作用. 阳性对照GM组GA3含量变化一直处于波动中,其在第5天出现最高值145.5 μg/g,第3天最低,为13.6 μg/g. G300H组在第2天时最高,比对照组高217.9%,G500H组和G1000H组在第8天分别比对照组高581.6%和291.0%. 即500 mg/L黄腐酸提高根系GA3含量更显著.

同一天不同字母表示差异显著(P<0.05).图8 黄腐酸对结瘤初期大豆根部GA3含量的影响Fig.8 Effect of fulvic acid on GA3 content of soybean roots at the early stage of nodulation
2.4.2 黄腐酸对大豆茎中GA3含量的影响
黄腐酸对大豆茎中GA3含量的影响见图9.图9表明,黄腐酸促进了结瘤初期茎中GA3的积累. G300H组GA3含量在第2天达到最高值153.1 μg/g,在第12天最低,为15.7 μg/g. G500H组在第8天达到最高值181.3 μg/g,在第2天最低,为50.8 μg/g;除第5天外,G500H组GA3含量都比对照组的高. G1000H组与对照组相比,前期表现为抑制作用,从第5天开始表现为促进作用. 阳性对照GM组GA3含量在第1天出现最大值156.3 μg/g,在第3天达到最低值26.0 μg/g. 综合来看500 mg/L的黄腐酸对提高茎中GA3含量效果更好.

同一天不同字母表示差异显著(P<0.05).图9 黄腐酸对结瘤初期大豆茎中GA3含量的影响Fig.9 Effect of fulvic acid on GA3 content of soybean stems at the early stage of nodulation
2.4.3 黄腐酸对大豆叶中GA3含量的影响
黄腐酸对大豆叶中GA3含量的影响见图10.图10表明,黄腐酸促进了结瘤初期叶中GA3含量的积累. G300H组GA3含量在第5天达到最低24.2 μg/g,在第12天达到最高值67.2 μg/g;在第3、8、12天G300H组GA3含量均比对照组高. G500H组GA3含量在第12天达到最高值127.9 μg/g,在第3天达到最低值17.3 μg/g;在第2、8、12天G500H组GA3含量均比对照组高. G1000H组GA3含量在第1天出现最高值131.2 μg/g;在第1、3、5、8、12天G1000H组GA3含量均比对照组高. 阳性对照GM组在第3天出现最低值19.3 μg/g,在第1天其值最高,为107.6 μg/g. G300H、G500H、G1000H组在第12天分别比对照组高223.2%、515.0%、59.8%. 表明黄腐酸可以提高叶中GA3含量.

同一天不同字母表示差异显著(P<0.05).图10 黄腐酸对结瘤初期大豆叶中GA3含量的影响Fig.10 Effects of fulvic acid on the content of GA3 of soybean leaves at the early stage of nodulation
2.5 黄腐酸对大豆植株中ABA含量和分布的影响
2.5.1 黄腐酸对大豆根系ABA含量的影响
黄腐酸对大豆根系中ABA含量的影响见图11.由图11可知,G300H组在第5天达到最低值0.9 μg/g,在第12天含量最高,为2.6 μg/g;G300H组ABA含量在第2、3、5、8天均比对照组低. G500H组ABA含量在第1天最低,为0.6 μg/g,在第8天达到最高值1.9 μg/g;在第1、2、3、5、12天G500H组ABA含量均比对照组低. G1000H组与对照组相比在第3、5、12天的ABA含量均比对照组低. 阳性对照GM组ABA含量在第3天最低,为1.3 μg/g,在第12天最高,为2.4 μg/g. G300H组和G500H组分别在第5天和第1天时比对照组低48.2%和54.8%. 说明黄腐酸与黄酮类物质类似可以降低根部ABA含量,且综合来看500 mg/L的黄腐酸降低根中ABA含量更显著.

同一天不同字母表示差异显著(P<0.05).图11 黄腐酸对结瘤初期大豆根部ABA含量的影响Fig.11 Effects of fulvic acid on ABA content of soybean roots at the early stage of nodulation
2.5.2 黄腐酸对大豆茎中ABA含量的影响
黄腐酸对大豆茎中ABA含量的影响见图12.由图12可知,黄腐酸增加了结瘤初期茎中ABA的积累. G300H组在第5天达到最低值1.8 μg/g,第1天出现最高值3.6 μg/g;在第1、2、3、12天G300H组ABA含量均比对照组高. G500H组ABA含量在第5天时达到最低值2.3 μg/g,在第1天出现最高值3.4 μg/g;在第1、2、3、5、8天G500H组ABA含量比对照组高. G1000H组在第1、3、8、12天ABA含量都比对照组高. 阳性对照GM组在第3天达到最低值2.1 μg/g,在第2天ABA含量最高,为3.6 μg/g. G300H组和G500H组第1天分别比对照组高34.9%和29.0%. 说明黄腐酸可一定程度上提高茎中ABA含量,但不显著.

同一天不同字母表示差异显著(P<0.05).图12 黄腐酸对结瘤初期大豆茎中ABA含量的影响Fig.12 Effects of fulvic acid on ABA content of soybean stems at the early stage of nodulation
2.5.3 黄腐酸对大豆叶中ABA含量的影响
黄腐酸对大豆叶中ABA含量的影响见图13.由图13可知,黄腐酸增加了结瘤初期叶中ABA的积累. G300H组ABA含量在第1天最高,达12.2 μg/g,在第8天最低,为4.4 μg/g. G500H组在第2天达到最高值18.1 μg/g,在第5天出现最低值4.7 μg/g;在第2、3、8、12天G500H组ABA含量比对照组高. G1000H组在第1、2、5、8天比对照组高,也表现为促进作用. 阳性对照GM组第3天达到最低值6.3 μg/g,在第1天最高,为11.3 μg/g. G500H组和G1000H组分别在第8天和第2天比对照组高95.1%和70.4%. 500 mg/L的黄腐酸对叶中ABA含量积累影响最明显.

同一天不同字母表示差异显著(P<0.05).图13 黄腐酸对结瘤初期大豆叶中ABA含量的影响Fig.13 Effects of fulvic acid on ABA content of soybean leaves at the early stage of nodulation
3 讨论
大豆结瘤过程受到植物激素的严密调控.根瘤菌侵染大豆根毛后,侵染线会在1~2 d内到达表皮细胞[27-28].而本实验从加入根瘤菌后,在1~2 d时ZT、IAA、GA3含量变化明显,表明这些激素调控侵染线的形成,即调控大豆结瘤的起始时期.张伟[29]在研究根瘤原基形成和根瘤发育的动力学中发现接种慢生根瘤菌,根瘤原基在接种后的第7天出现,根瘤在接种后第13天出现,按时间推算与本论文研究的根瘤在接种后第12天出现很接近,而各激素含量变化在第8天比较明显,这很可能是根瘤原基的形成时期.本实验中发现的12 d内各激素的变化规律特别是1~2 d的侵染线形成时期、第8天的根瘤原基形成时期和第12天的根瘤形成时的变化与Liu等[2]总结的各激素增加、转运和局部积累对结瘤的作用基本符合,但其具体机理和调控没有深入解析.
黄酮类物质在大豆结瘤过程中具有重要的作用.在结瘤初期,生长素在根部的局部积累对根瘤的形成至关重要,而查尔酮合酶突变体表现出生长素局部积累能力的丧失,结果严重地抑制了结瘤[30],这说明了黄酮类物质可以调控生长素的转运.外源加入黄酮类物质可以抑制生长素在豆科植物根部的向顶性运输[31],而不影响向基性运输,这使得生长素能够在结瘤敏感区(根毛)积累,从而引起根瘤器官的形成.本研究所使用的黄腐酸含有黄酮类物质的结构[24],这可能也是黄腐酸促进大豆结瘤的原因之一.在调控生长素在根部的局部积累中,细胞分类素也对其起到一定作用[6].从Ng等[31]的研究中发现根瘤菌接种到细胞分裂素受体缺陷型的蒺藜苜蓿后,生长素的向顶性运输不受抑制,致使生长素无法在结瘤敏感区积累,从而影响根瘤形成,这表明细胞分裂素通常在生长素信号的上游发挥作用,而细胞分裂素作为结瘤信号参与结瘤的起始,很可能是通过调控黄酮类物质或结瘤因子来影响生长素转运的.黄腐酸中含有的黄酮类物质也可能具有调控作用.
目前对共生体系的研究结果表明,其受到植物和共生菌的共同调控.植物体中除了内源激素调控外,还存在一套结瘤负调控系统(即AON系统),二者在发挥作用时存在部分交叉且完整的作用机制都不清楚,此外共生菌也会通过分泌一些信号肽或激素作用于植物来调控结瘤.由此可见,植物结瘤本身受到多方因素的调控,而黄腐酸不仅可以提高共生菌的竞争力同时诱导结瘤相关基因的表达,还可以通过影响植物激素来调控结瘤过程,在大豆结瘤的不同时期和过程都发挥作用.但由于结瘤过程中涉及共生双方的时空表达的基因和调控的物质很多,十分复杂,所以目前具体分子机制尚不清楚,也没有形成完整的表达及调控网络,本实验仅仅从植物内源激素含量与分布方面分析黄腐酸对结瘤的影响,而后续的相关基因的挖掘和功能验证是课题组工作的重点内容和重心.
4 结论
适宜的黄腐酸质量浓度提高大豆的结瘤固氮能力,高质量浓度的黄腐酸抑制了大豆结瘤固氮能力.这可能是由于适宜质量浓度的黄腐酸(如500 mg/L)通过增加大豆根茎叶中ZT、IAA、GA3等3种激素含量,降低根系ABA含量同时提高叶中ABA含量来发挥促进效果,而高质量浓度的黄腐酸(如1 000 mg/L)对激素的调控起到相反作用的结果.
