盐酸莫西沙星氯化钠注射液治疗下呼吸道感染患者的药动学及药效学分析
2022-01-12章超肖婷
章 超 肖 婷
1.江西省九江市第一人民医院临床药学室,江西九江 332000;2.江西省九江市第一人民医院老年科,江西九江 332000
下呼吸道感染(lower respiratory tract infection,LRTI)多由病毒、细菌及支原体等所致,患者多以咳嗽、发热及呼吸困难为主要表现,若未能及时诊治会诱发呼吸衰竭,更为严重者危及患者生命安全。LRTI 以抗菌药物对症治疗为主,莫西沙星(moxifloxacin,Mox)属于氟喹诺酮类抗菌药物,Mox 与其他抗生素无交叉耐药现象,具有抗菌谱广、抗菌能力强等优点,已被广泛用于呼吸系统疾病的治疗中[1-2]。Mox 为一线抗感染药物, 但目前临床上针对Mox 的药动学以及药效学研究报道较少[3-4]。 鉴于此,本研究将分析LRTI 患者采取盐酸莫西沙星氯化钠注射液治疗的药动学以及药效学,以期为接受盐酸莫西沙星氯化钠注射液治疗的LRTI 患者提供确切指导。
1 资料与方法
1.1 一般资料
选取2019 年 3 月至 2021 年 3 月九江市第一人民医院收治的76 例LRTI 患者作为研究对象。其中男42 例,女 34 例;年龄 23~62 岁,平均(37.1±4.7)岁;病程 1~6 d,平均(3.26±0.58)d;体重指数 18.5~27.0 kg/m2,平均(22.85±1.20)kg/m2;疾病类型:支气管哮喘合并感染18 例,慢性支气管炎22 例,肺炎36 例。本研究获医院医学伦理委员会批准。
1.2 纳入及排除标准
纳入标准:①LRTI 诊断标准符合《医院感染诊断标准》[5];②肝肾功能、血尿常规及心电图检查均正常;③患者能够耐受Mox 治疗;④治疗前7 d 内未使用过相关抗菌药物治疗;⑤患者签署知情同意书。 排除标准:①妊娠、哺乳期女性;②患有精神疾病,无法积极配合临床诊治。
1.3 方法
1.3.1 给药方法 所有LRTI 患者均静脉滴注盐酸莫西沙星氯化钠注射液(北大医药股份有限公司,国药准字 H20203328,生产批号 20190324)治疗,400 mg/次,1 次/d,滴注时间为 90 min,共治疗 7 d。
1.3.2 标本采集及样品测定 患者在接受治疗期间避免剧烈活动,禁止饮用含咖啡因的饮料及酒、茶等,避免在强光下长时间暴露;Mox 用药后即刻、 次日用药前即刻及第3 日给药后即刻,采集患者同侧肘静脉血5 ml 置于肝素抗凝管中,3000 r/min 离心 15 min,取血浆,置于-20℃环境中保存。 Mox 在血浆中的浓度测定: 取 0.25 ml 血浆置于 1.5 ml EP 管中, 加入甲醇0.75 ml 沉淀血浆蛋白, 随后加入加替沙星内标溶液40 μl,旋转混合后取上清液 40 μl 进样,同时取不同浓度的Mox 系列溶液进行试验。
1.3.3 测定痰液标本中常见致病菌最低抑菌浓度 治疗前、治疗后取患者痰液标本进行细菌培养,最低抑菌浓度(minimum inhibitory concentration,MIC)采用肉汤稀释法测定, 分离患者痰液中的肺炎支原体、金黄色葡萄糖菌、肺炎克雷伯杆菌、肺炎链球菌、流感嗜血杆菌进行培养,取依次编号1~13 号试管,另取经环氧乙烷灭菌的一次性无菌试管3 支,分别作为“质控菌生长对照” 管、“检测菌生长对照” 管、“肉汤对照”管,向第2~13 支试管内加入无菌肉汤2 ml,分别在第1 和第2 支试管中加入128 mg/L 药物溶液2 ml,第2 管混匀后吸出2ml 加到第3 管中,按照同样操作,依次倍比稀释到第13 管,从第13 支试管中吸出2 ml弃去;按照此操作,1~13 号试管中Mox 药物浓度依次为128、64、32、16、8、4、2、1、0.5、0.25、0.12、0.06、0.03 mg/L;将待检细菌的试管、 含有药物溶液置于35℃培养箱中,孵育18~24 h 取出,观察并记录含有不同浓度药物的试管中细菌生长情况;MIC 判定标准为:含有药物的待测菌管、 检测菌生长对照管培养条件相同,“检测菌生长对照”管中细菌生长良好,含有药物待测菌管中, 无细菌生长试管对应药物浓度即为病原菌MIC。
1.4 观察指标及评价标准
观察患者临床疗效及病原学疗效。①临床疗效依据《抗菌药物临床应用指导原则》[6]中标准判定,患者临床症状、体征消失,病原菌检测及实验室检查无异常为治愈;患者临床症状、体征、病原菌检测及实验室检查结果中存在1 项未恢复正常为有效;未达到有效标准为无效, 总有效率=(治愈+有效) 例数/总例数×100%。 ②在治疗前、治疗结束后对患者咳出的深部痰进行培养,依据培养结果,计算细菌清除率,细菌清除率=治疗后病原菌清除数/治疗前病原菌检出数×100%。 ③观察Mox 的药动学结果,主要包括Mox 在血浆中浓度、Mox 对病原菌的MIC、稳态血药浓度/MIC。稳态血药浓度/MIC 为评估Mox 作用效果及药动学常用指标, 其中稳态血药浓度/MIC 数值高表明Mox 抗感染治疗效果好,有利于感染的治疗。
1.5 统计学方法
采用SPSS 22.0 统计学软件进行数据分析, 计量资料用均数±标准差()表示;计数资料用率表示。
2 结果
2.1 药效学
2.1.1 临床疗效 患者经治疗总有效率为89.47%(68/76), 其中肺炎患者治疗总有效率高达100.00%(36/36)(表 1)。
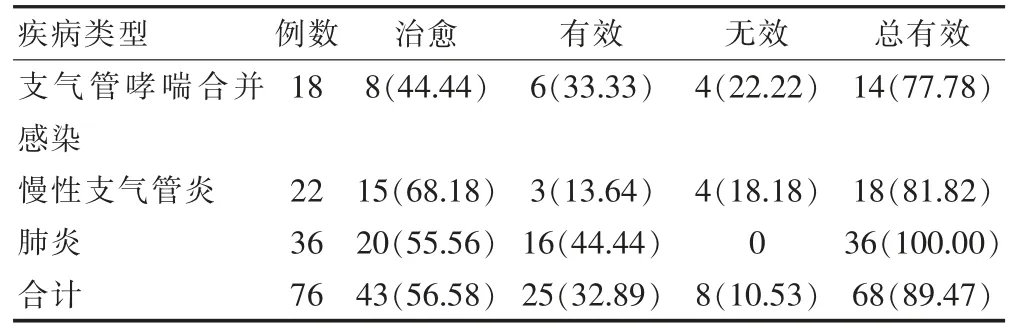
表1 患者的临床疗效分析[n(%)]
2.1.2 病原学疗效 治疗前在患者中共检出病原菌76株,其中肺炎支原体检出率最高为35.53%(27/76),金黄色葡萄糖菌次之; 治疗后病原菌清除率90.79%(69/76)(表 2)。

表2 患者的病原学疗效分析[n(%)]
2.2 药动学
Mox 在血浆中的浓度及对病原菌的MIC 分析结果,单剂量给药后,Mox 峰浓度、谷浓度、稳态血药浓度分别为(4.25±0.06)、(1.44±0.08)、(3.67±0.05)mg/L。
Mox 对肺炎支原体、 肺炎链球菌敏感性较好,MIC为0.25 mg/L;Mox 对金黄色葡萄糖菌敏感性较差(表 3)。
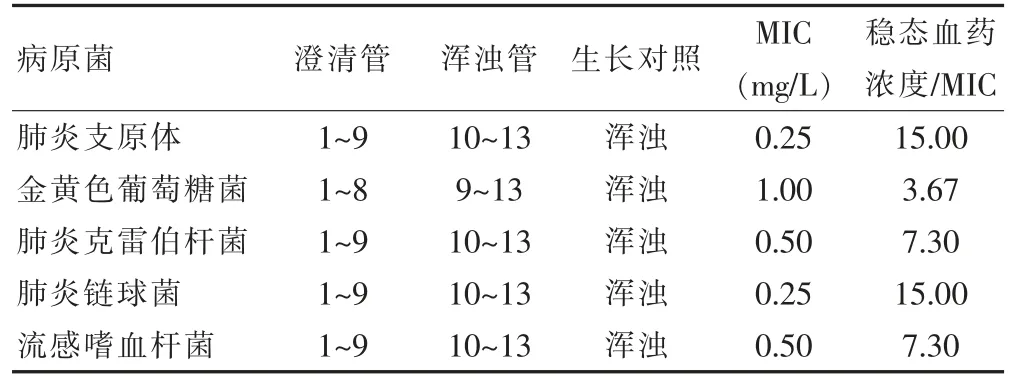
表3 Mox 对病原菌的MIC 分析
3 讨论
LRTI 属于常见的感染性疾病, 是指声门以下的气道感染, 对患者身心健康及生活质量影响较大,故早期发现LRTI 症状后应及时诊断、治疗,以尽快控制病情进展[7-8]。 目前LRTI 患者抗生素使用不规范现象仍较为常见,若抗生素滥用会造成抗生素耐药细菌的广泛传播,增加LRTI 治疗难度,故合理使用抗生素治疗LRTI 显得尤为重要。
通过分析LRTI 病原菌的耐药性和分布情况发现,导致LRTI 的病原菌主要为革兰阴性杆菌,而最常见的则包括铜绿假单胞菌、肺炎克雷伯杆菌;除此之外还包括革兰氏阳性球菌,如金黄色葡萄球菌、肺炎链球菌[9-10]。 Mox 属于新型8-甲氧基的第4 代氟喹诺酮类药,保留第3 代抗革兰氏阴性杆菌活性,同时将对抗厌氧菌及革兰氏阳性杆菌的活性增强[11-12]。 Mox用药后可促使血浆蛋白结合力降低,能够快速分布至血管外间隙, 给药后能够快速达到治疗所需浓度,且不会出现细菌耐药现象[13]。 本次研究结果显示,患者经治疗总有效率为89.47%; 肺炎患者治疗总有效率高达100.00%;治疗前患者中共检出病原菌76 株,其中肺炎支原体检出率最高, 金黄色葡萄糖菌次之;治疗后病原菌清除率90.79%。 Mox 的血浆蛋白结合率较低,Mox 能够在支气管分泌物及血浆中快速达到并维持较高的浓度, 清除病原菌, 改善患者症状、体征,获得良好的治疗效果[14-15]。 同时研究结果显示,单剂量给药后,Mox 峰浓度、谷浓度、稳态血药浓度分别为(4.25±0.06)、(1.44±0.08)、(3.67±0.05)mg/L;Mox 对肺炎支原体、肺炎链球菌敏感性较好,MIC 为0.25 mg/L;Mox 对金黄色葡萄糖菌敏感性较差。 Mox 抗菌活性强,对肺炎克雷伯杆菌、流感嗜血杆菌稳态血药浓度达到MIC 的7.30 倍,对肺炎支原体、肺炎链球菌达到15倍的MIC, 在LRTI 患者治疗中应用有利于控制感染。 孙婉[15]研究中指出,LRTI 患者选择盐酸莫西沙星氯化钠注射液治疗能够获得较高的治疗浓度,临床治疗效果显著,有利于提高患者生活质量,与本次研究结果较为相似。 但本次研究中纳入病例数较少,可能会对研究结果准确性造成一定影响,仍需经后续大样本量深入研究,以进一步分析盐酸莫西沙星氯化钠注射液治疗LRTI 患者的药动学以及药效学, 以更好的指导临床用药治疗。
综上所述, 在LRTI 患者治疗中采取盐酸莫西沙星氯化钠注射液疗效确切,有利于清除病原菌,是治疗LRTI 的一种有效抗菌药物。
