响应面法优化独一味多糖酶解提取工艺
2022-01-08高飞邵湘玲李雨婷范潇刘志海
*高飞 邵湘玲 李雨婷 范潇 刘志海
(青岛农业大学化学与药学院 山东 266109)
独一味(Lamiophlomis rotate(Benth.)Kudo)是藏药中十分出色的一味中药,已在少数民族中广泛使用,该药最早载于藏族医药学巨著《四部医典》及《晶珠本草》中,且历史悠久。书中记载该药味甘、微苦,温,主接骨、干黄水[1-2]。在现代临床医学学研究中,该药多用于膏药,主要治疗跌打损伤、筋骨疼痛等,其主要作用在于镇痛、消炎。国内外研究报道,独一味具有抗氧化、抗炎镇痛的药理活性,但全部关注于独一味中的环烯醚萜类,对其中多糖组分的生物学功能未见有报道[3]。
多糖是生命活动中不可或缺的一部分,能够维持和保证生物体生命活动正常运转[4]。据研究表明,天然植物多糖具有抗肿瘤、免疫调节、抗病毒及抗氧化等多种药理作用,在绿色天然产物领域是不可多得的优秀免疫调节剂,深得国内外学者追捧[5]。目前,提取植物多糖的方法有水提醇沉法、酸提取法、碱提取法、微波及超声提取法等多种方法[6-8]。研究报道,使用水提醇沉法可获得独一味多糖,但该提取方法提取率低,而独一味为名贵中药,无法发挥其最大价值。酶尤其是果胶酶、纤维素酶、木瓜蛋白酶,其活性高、易得价廉,可应用于植物多糖的提取,因此本研究使用酶解提取,并优化其提取工艺。
1.材料与方法
(1)材料与仪器
①试剂
无水D-葡萄糖对照品(批号:110833-201205,纯度:95%~98%),购自中国食品药品检定研究院;独一味,购自青藏高原地区;纤维素酶(400U/g)(CAS:9012-54-8)、果胶酶(500U/g)(CAS:9032-75-1)、木瓜蛋白酶(800U/g)(CAS:9001-73-4),购自福州飞净生物科技有限公司;80%乙醇、浓硫酸、苯酚均为分析纯。
②仪器
循环水多用真空泵(SHZ-D(Ⅲ)型,郑州英峪领科仪器设备有限公司),恒温水浴锅(HH-4A型,常州国华电器有限公司),超声波清洗仪(KQ5200DA型,杭州博可超声波设备有限公司),紫外/可见分光光度计(UV-110011型,上海天美科学仪器有限公司);台式高速冷冻离心机(智拓科技控股有限公司),电子分析天平(AL204型,梅特勒-托利多仪器有限公司),高速粉碎机(H5322型,邢台中德机械制造有限公司),pH测试仪(上海佑科仪器仪表有限公司)。
(2)试验方法
①独一味脱脂
将独一味粉末用回流瓶经80%的乙醇加热8h,用于脱脂、脱色、除去低聚糖和小分子杂质,置于干燥通风处,挥干溶剂,得到干燥样品[8]。
②糖含量测定
精确称取105℃干燥至恒重的葡萄糖标准品0.01g,溶解于超纯水,定容至100mL,得0.1mg/mL溶液。精密吸取0mL、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL并加超纯水补至2mL,分别加入5%苯酚溶液1mL,摇匀,垂直液面快速加入浓硫酸5mL,摇匀。冷水浴至温度下降到室温,显色。以空白为对比,将样品置于紫外分光光度计上,测定其在490nm处的吸光度值。
绘制标准曲线,得到回归方程y=0.0063x-0.0077(R2=0.9992),其中x为葡萄糖标准品浓度,单位mg/mL,y为吸光度值[9-10]。
精密称取独一味多糖1mg溶解于10mL蒸馏水中,配制成0.1mg/mL溶液。吸取1mL加蒸馏水至2mL,加入5%苯酚1mL,摇匀,然后迅速垂直加入浓硫酸5mL,充分摇匀。冷水浴至温度下降到室温,于490nm处测定吸光度。根据标准曲线计算独一味多糖浓度,并计算多糖得率(Y):
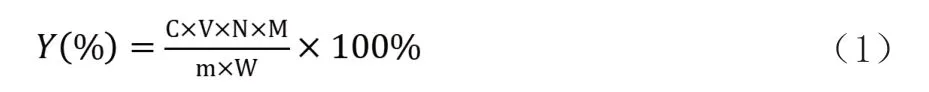
Y:多糖提取率(%);C:通过对标准葡萄糖标曲计算得到多糖浓度(mg/mL);V:定容体积(mL);N:稀释倍数;m:测定所用的多糖质量(mg);M:多糖质量(g);W:提取用独一味粉末质量(g)。
③单因素考察
A.温度对独一味多糖提取的影响
称取3g预处理样品,加入适量蒸馏水,浸泡2h,复合酶(果胶酶:纤维素酶:木瓜蛋白酶=2:2:1)用量2%、提取温度(20℃、30℃、40℃、50℃、60℃)、pH为6,水浴浸提90min,于100℃将酶灭活5min,弃沉淀,将上清液减压浓缩至原体积20%,加入无水乙醇,使得乙醇终浓度为80%,置于4℃醇沉12h。弃上清液,收集沉淀真空干燥得独一味多糖(LRP),计算多糖提取率[11]。
B.时间对独一味多糖提取的影响
取3g预处理样品,加入适量蒸馏水,浸泡2h,在复合酶用量2%,温度40℃,pH为6,提取时间(30min、60min、90min、120min、150min)条件下进行操作,同1.2.3.1,计算多糖提取率[12]。
C.pH对独一味多糖提取的影响
称取3g预处理样品,加入适量蒸馏水,浸泡2h,在复合酶用量2%,温度40℃,pH(4、5、6、7、8),提取90min条件下进行操作,同1.2.3.1,计算多糖提取率[13]。
④响应面优化设计
通过单因素试验,利用Box-Behnken Design(BBD)中心组合方法设计响应面试验,其中,响应值为LRP提取率Y(%),将单因素试验中三个独立变量分别进行考察,即提取温度(A)、提取时间(B)和pH(C)(每个因素取3个平行实验对照,分别以1、0、-1对每个自变量的高、中、低实验水平进行编码)。实验因素和水平见表1所示,所有实验均进行3次,并利用Design-Expert(8.0.6.1版))软件进行数据处理分析。
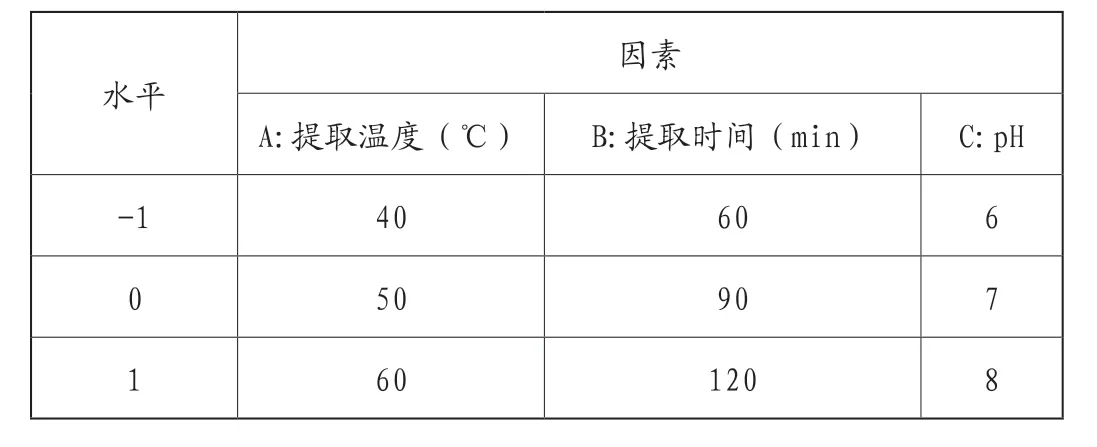
表1 BBD响应面试验因素与水平表
⑤验证试验
选取响应面试验分析得出的最佳工艺参数作为提取条件,重复三次得到试验结果,计算三颗针多糖得率,以确定三颗针多糖的最优提取工艺。
⑥紫外可见吸收光谱
配制1mg/mL的三颗针多糖溶液,以蒸馏水调零,于紫外分光光度计中200-800nm范围内全波长扫描。
⑦FTIR光谱
取2mg干燥的三颗针多糖粉末,与150mg溴化钾混合研磨均匀后压片,于红外谱仪中400-4000cm-1范围进行扫描。
⑧数据分析
利用Design-Expert V8.0.6.1软件进行响应面试验设计及回归模型分析。
2.结果与分析
(1)单因素对多糖得率的影响
①提取温度对独一味多糖得率的影响
如图1所示,在固定pH为6,复合酶添加量为2%,酶解时间90min条件下,酶解温度20℃~50℃时,温度升高与多糖得率成正效应关系,之后进一步提高酶解温度则多糖得率下降。试验中,提取温度由20℃提升到50℃,多糖的提取率不断上升,然而在温度高于50℃时,多糖提取率出现了显著的下降。其原因是温度可以提高多糖在溶剂中的溶解度、扩散系数,使得多糖在提取时更容易沉淀,有利于多糖提取;但是,温度过高会使得多糖降解,破坏多糖结构,从而导致提取率降低。因此,提取温度选择在40℃、50℃、60℃上进行响应面设计。
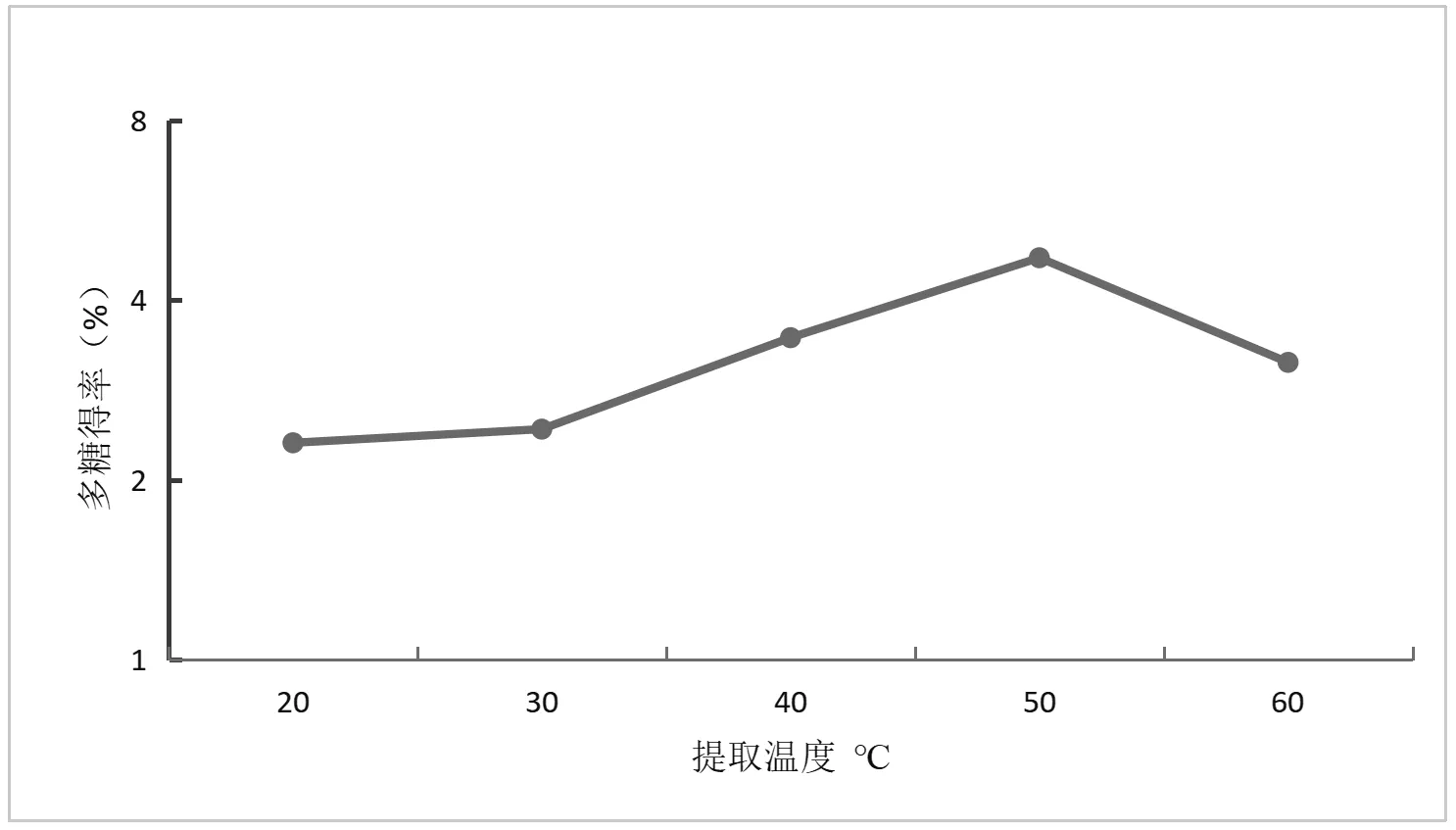
图1 提取温度对独一味多糖得率的影响
②提取时间对独一味多糖得率的影响
如图2所示,在固定pH为6,复合酶添加量为2%,酶解温度40℃条件下,酶解时间30min~90min时,提取时间增加与多糖得率成正效应关系,之后进一步增加提取时间则多糖得率下降,因此选择提取时间60min、90min、120min进行响应面设计。
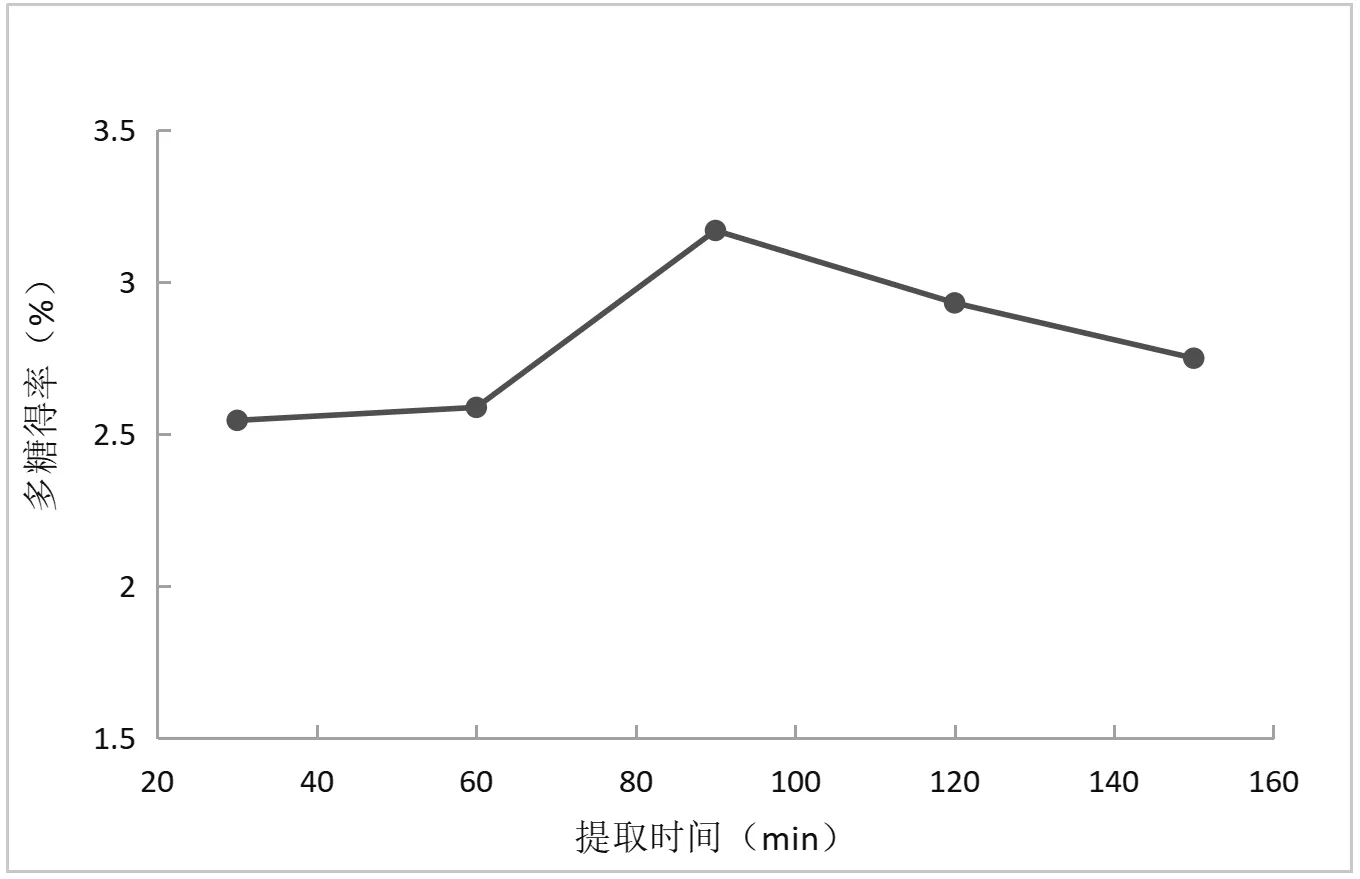
图2 提取时间对独一味多糖得率的影响
③pH对独一味多糖得率的影响
如图3所示,在固定复合酶用量2%,提取温度40℃,提取时间90min条件下,在pH为5~7时,多糖得率与pH值成正效应,在pH为8时多糖得率下降,可能是过碱条件下,酶的空间结构受到了破坏,影响了与底物的结合,从而使提取得率下降,因此应选择在pH为6、7、8较宜。
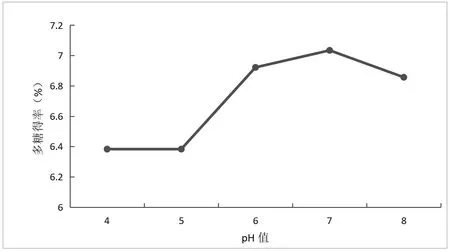
图3 pH对独一味多糖得率的影响
(2)响应面法优化独一味多糖提取工艺
①模型的建立与检验
以提取温度(A)、提取时间(B)、pH(C)为变量,独一味多糖得率为响应值,利用Design-Expert V8.0.6.1软件中Box-Behnken设计法进行三因素三水平的响应面优化试验,每个试验重复3次,结果见表2。
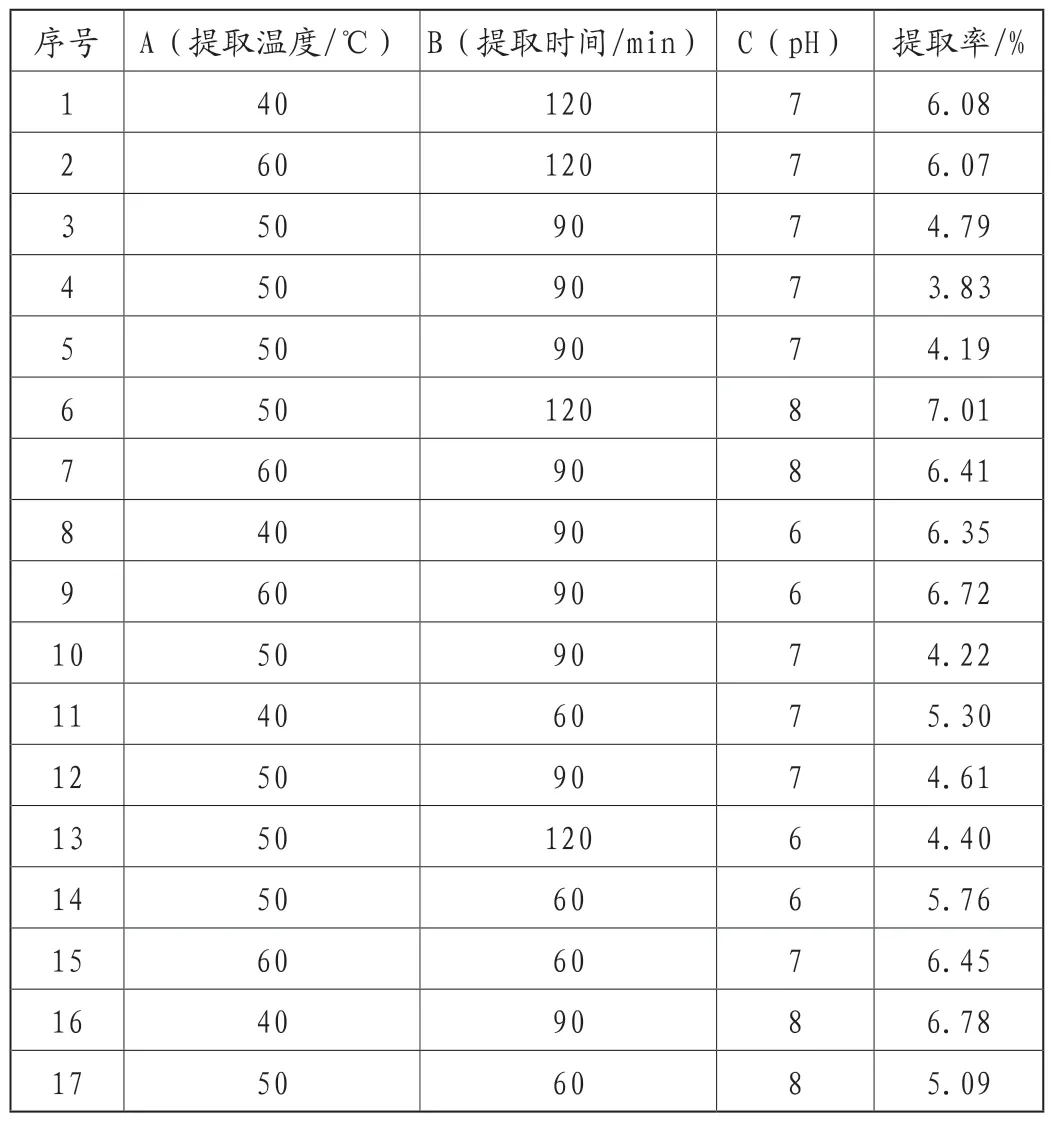
表2 响应面设计及结果
②回归方程拟合及方差分析
利用Design-Expert V8.0.6.1软件对表2试验结果进行回归模型拟合,对三个因素进行回归拟合后得到回归方程:Y=4.33+0.14A+0.12B+0.26C-0.29AB-0.19AC+0.82BC+1.32A2+0.32B2+0.91C2。
拟合二次多项式模型的方差分析结果见表3。校正系数R2=0.9339,R2模型的P值小于0.01,为极显著;失拟项P值大于0.05,不显著,以上说明模型拟合度较好,二次模型拟合度较高,可正确反映各因素与响应值之间的变化关系。由模型的方差分析可得出,二次项A2、C2以及交互项BC系数的显著性均小于0.05,其余一次项、二次项和交互项系数的显著性均大于0.05。三个因素对响应值的影响显著性排序为C>A>B。
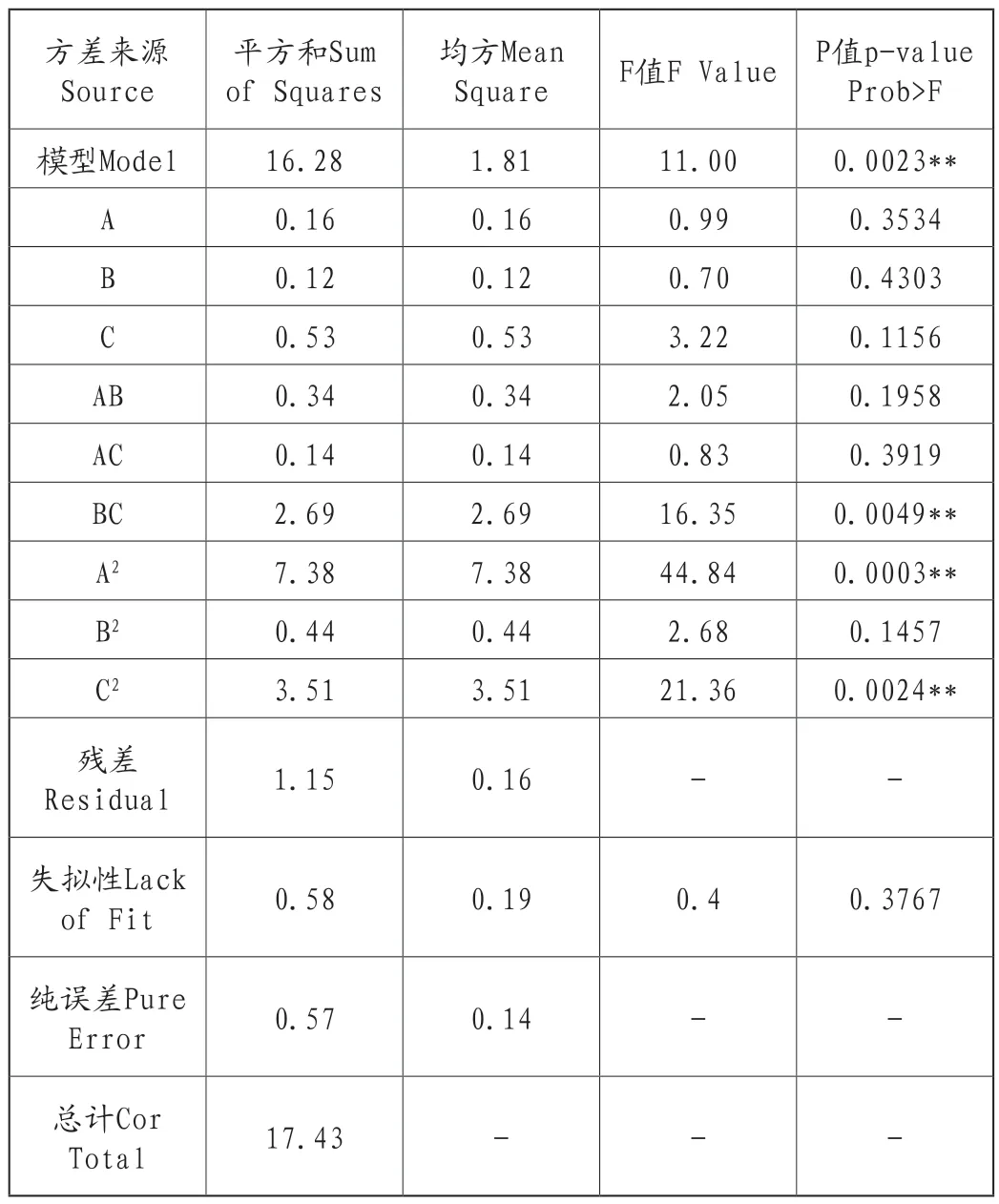
表3 拟合二次多项式模型的方差分析
③3D响应面和等高线图分析
响应面和等高线图可直观反映两因素间的交互作用。响应面图越陡峭表明两自变量间交互作用对响应值影响程度越大,反之亦然。等高线图越密集,呈现椭圆时表明两变量间交互作用对响应值影响较显著,反之亦然。分析结果见图4-图6。
由图4可知,3D响应面图显示,多糖的得率受提取温度和提取时间共同影响,且成正相关,提取温度的升高和提取时间增加,多糖得率增加,且在提取温度和时间达到最高值时,多糖得率出现下降的趋势。由等高线图可以表明,等高线沿提取温度轴变化密集,说明提取温度对响应面的影响明显显著于提取时间。

图4 提取温度和提取时间对独一味多糖得率的影响
由图5可知,3D响应面图显示,多糖的得率受提取时间和pH共同影响,且与提取时间呈现正相关,与pH值呈现负相关,即提取时间的增加、pH的降低,多糖得率增加,且在提取时间达到最高值和pH值达到最低值时,多糖得率出现下降的趋势。由等高线图可以表明,等高线沿pH值轴变化密集,说明pH值对响应面的影响明显显著于提取时间。
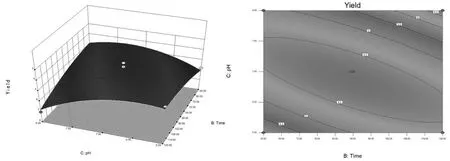
图5 提取时间和pH对独一味多糖得率的影响
由图6可知,3D响应面图显示,多糖的得率受提取温度和pH共同影响,且与提取温度呈现正相关,与pH值呈现负相关,即提取温度的增加、pH的降低,多糖得率增加,且在提取温度达到最高值和pH值达到最低值时,多糖得率出现下降的趋势。由等高线图可以表明,等高线沿pH值轴变化密集,说明pH值对响应面的影响明显显著于提取温度。
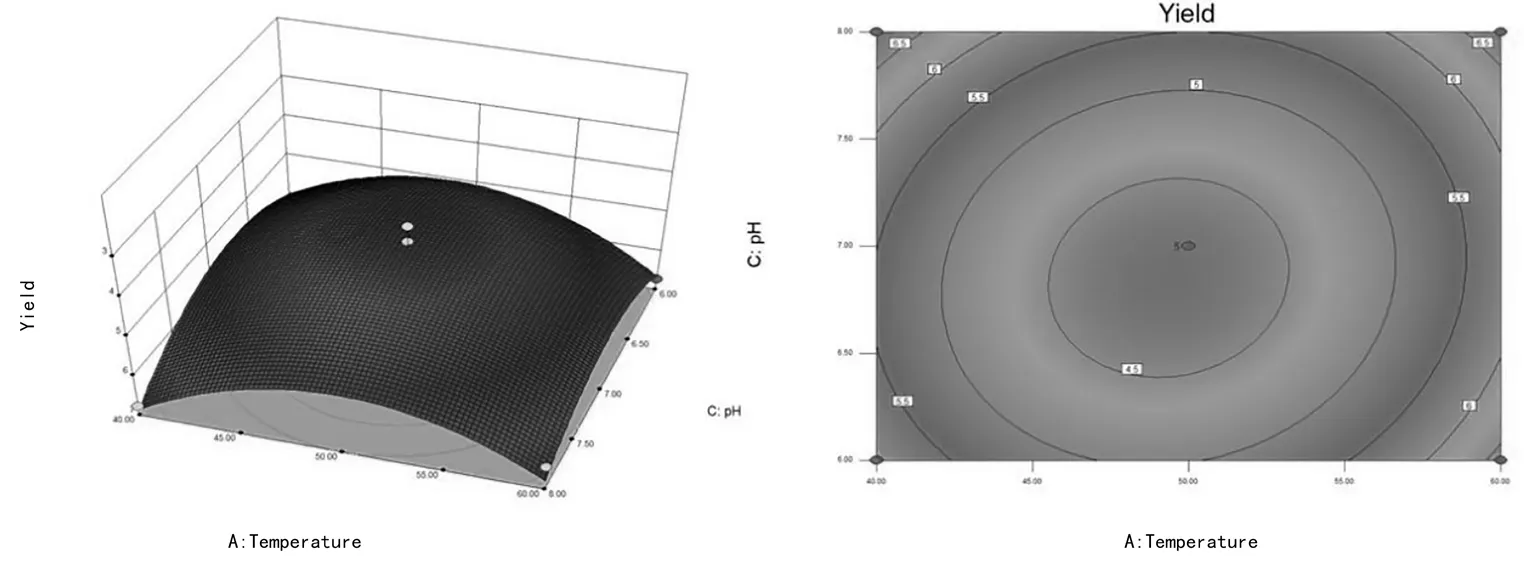
图6 提取温度和pH对独一味多糖得率的影响
(3)紫外吸收光谱结果分析
独一味多糖的紫外吸收图谱如图7所示,独一味多糖在280nm处有轻微吸收峰,表明该多糖中有蛋白的存在[16];在260nm处无吸收峰,表明该多糖中无核酸的存在[17]。
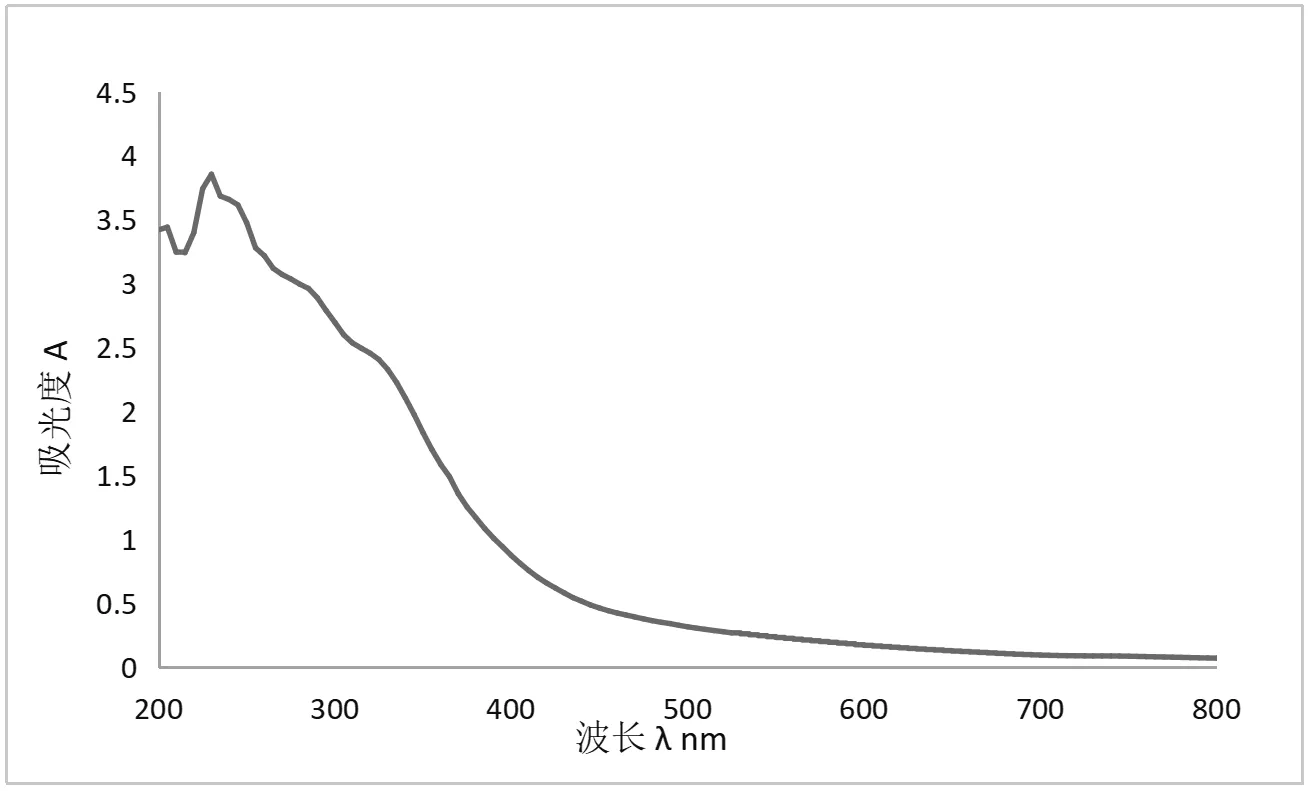
图7 独一味多糖紫外吸收图
(4)红外光谱结果分析
如图8所示,在3600cm-1~3000cm-1处,有一个吸收较强的宽峰,3420.16cm-1和3389.46cm-1,为-OH伸缩振动峰;在1399.81cm-1处有振动吸收峰,是C-H变角振动峰[18-19];在1168.68cm-1处的吸收峰是由吡喃糖环的醚键(C-O-C)和-OH伸缩振动引起的,此4组吸收峰均是糖类物质的特征吸收峰,说明本研究中的提取物为多糖类物质[20-21]。另外654.66cm-1处有一强的吸收峰,为酰胺Ⅰ带的吸收峰;558.26cm-1是N-H的变角振动,为酰胺Ⅱ带的吸收峰[22],证明多糖中有少量的与糖结合的蛋白(如糖蛋白)存在。

图8 独一味多糖红外吸收光谱
(5)验证试验
通过使用Design-Expert 8.0.6.1软件,预测模型极值点,计算结果显示最佳提取条件为:提取温度60℃,提取时间60min,pH为6,在此最佳提取条件下预测多糖得率为7.95%。之后,按照优化后提取条件进行3次平行试验,最终测得多糖得率为(7.93±0.02)%,与预测值接近,差异不明显,表明该模型拟合度良好[23],因此,提取温度60℃,提取时间60min,pH为6时提取独一味多糖的工艺优化合理、有效。
3.结论
通过单因素考察及RSM试验,确定独一味多糖的最佳提取工艺条件为,提取温度60℃,提取时间60min,pH为6。本研究的结果表明酶解提取独一味多糖是一种有效、操作方便、可靠和可行的方法,其最佳提取工艺条件为提取温度为60℃,提取时间60min,pH为6,复合酶量为2.0%。
