3-芳基喹喔啉-2(1H)-酮衍生物的合成研究进展
2022-01-07宋华龙劳红标宋胜杰周春松
宋华龙,劳红标,宋胜杰,周春松
(1.绍兴水处理发展有限公司,浙江 绍兴 312030;2.浙江工业大学 药学院,浙江 杭州 310014;3.宜兴国际环保城科技发展有限公司,江苏 宜兴 214200;4.浙江工业大学化学工程学院西南研究院,贵州 福泉 550599)
喹喔啉-2(1H)-酮(1a)广泛存在于天然产物和生物活性化合物中,是一种极具价值的结构母核,其在有机合成、农药、材料科学和药物化学等领域具有广泛的应用[1-3]。3-芳基喹喔啉-2(1H)-酮骨架(1b)是许多药物分子中的药效团,可用作抗肿瘤和抗菌剂[4],以及针对硬脂酰辅酶A 去饱和酶[5]、醛糖还原酶[6]、凝血因子Xa[7]、脯氨酸寡肽酶[8]和丝氨酸/苏氨酸-蛋白激酶(STK)33[9]等的强效抑制剂。结构式见图1 和图2。

图1 喹喔啉-2(1H)-酮(1a)和3-芳基喹喔啉-2(1H)-酮(1b)结构式


图2 含有3-芳基喹喔啉-2(1H)-酮骨架的生物活性分子
鉴于其重要的应用价值,3-芳基喹喔啉-2(1H)-酮衍生物引起了合成化学和药物化学领域学者们广泛的兴趣。在过去几十年中,已经开发了各种策略用于合成3-芳基喹喔啉-2(1H)-酮衍生物,本文从传统合成方法和C-H 官能团化方法分别介绍3-芳基喹喔啉-2(1H)-酮衍生物的最新合成研究进展。
1 传统合成方法
1.1 通过芳基取代前体的缩合反应制备
以芳香乙二醛(1)、N-Boc 保护的苯二胺(2)为底物,以CH2Cl2为溶剂,SeO2为氧化剂,在微波辐射条件下经过一步氧化酰胺化反应得到化合物3,再通过TFA 处理,分别经过脱保护、环化、脱水等步骤以中等至良好的产率(42%~75%)获得一系列3-芳基喹喔啉-2(1H)-酮衍生物(6)[10],见图3。
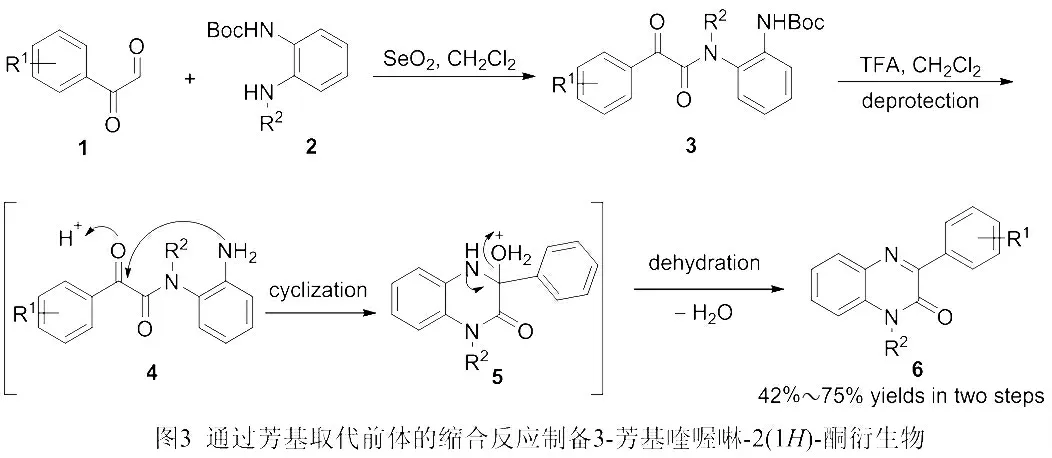
图3 通过芳基取代前体的缩合反应制备3-芳基喹喔啉-2(1H)-酮衍生物
上述反应中使用SeO2作为氧化剂,通过串联氧化酰胺化、脱保护、环化、脱水等步骤合成3-芳基喹喔啉-2(1H)-酮衍生物,无需使用金属试剂,产率中等至良好。然而,该传统方法所使用的原料需提前制备,反应步骤较多,微波辐射条件较为苛刻,效率不高。
1.2 通过邻苯二胺与末端炔烃的氧化环合反应制备
以取代的邻苯二胺(7)和芳基乙炔(8)为原料,以CH3CN/MeOH 为溶剂,CuCl 作为催化剂,在K2CO3和氧气的参与下,通过可见光引发实现CN 偶联,合成3-芳基喹喔啉-2(1H)-酮衍生物。通过控制实验,发现可见光、催化剂、碱和氧气为必需条件,反应的关键步骤是原位生成的芳基乙炔铜的直接光氧化,该反应最高能以99%的产率得到相应的3-芳基喹喔啉-2(1H)-酮衍生物(9)[11],见图4。
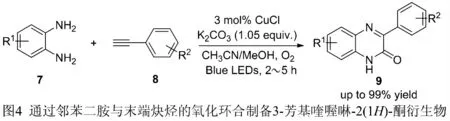
图4 通过邻苯二胺与末端炔烃的氧化环合反应制备3-芳基喹喔啉-2(1H)-酮衍生物
上述反应中使用CuCl 作为催化剂,氧气作为氧化剂,合成方法简单、条件温和、产率高,无需配体和强氧化剂,但是仍然需要当量碱的参与,也没能避免金属试剂的使用。
1.3 通过苯硼酸的偶联反应制备
以3-氯喹喔啉-2(1H)-酮衍生物(10)为原料,通过醋酸钯/三苯基膦(PPh3)催化体系,与芳基硼酸(11)发生Suzuki 偶联反应,能够以广泛的底物适用性和良好的产率实现3-芳基喹喔啉-2(1H)-酮衍生物(12)的制备[6],见图5。

图5 通过苯硼酸的偶联反应制备3-芳基喹喔啉-2(1H)-酮衍生物
在上述反应中,尽管能够以较好的产率直接通过偶联反应实现喹喔啉-2(1H)-酮衍生物3-位的芳基化,但是必不可免的使用了过渡金属钯,且反应条件较为苛刻。
2 C-H 官能团化方法
2.1 芳基肼对喹喔啉-2(1H)-酮的芳基化反应
使用芳基肼(14)作为芳基化试剂,亚碘酰苯(PhIO)作为氧化剂,CH3CN 作为溶剂,在空气氛围和室温条件下,能够顺利实现喹喔啉-2(1H)-酮衍生物(13)C-3 位的直接氧化芳基化[12]。该反应无需过渡金属催化剂,反应条件温和,底物适用性较广,最高能以86%的良好产率获得相应的3-芳基喹喔啉-2(1H)-酮产物(12),见图6。然而,当芳基肼苯环上取代基为氰基和硝基时,芳基化反应不能发生,此外,该反应仍然需要使用过量的氧化剂。
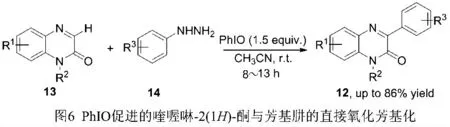
图6 PhIO促进的喹喔啉-2(1H)-酮与芳基肼的直接氧化芳基化反应
2.2 二芳基碘鎓盐对喹喔啉-2(1H)-酮的芳基化反应
使用二芳基碘鎓盐(15)作为芳基化试剂,CH3CN 作为溶剂,在Cs2CO3存在的室温条件下,能够顺利合成多种3-芳基喹喔啉-2(1H)-酮衍生物(12),见图7。该反应条件极其温和,无需过渡金属参与,对这种官能团均有良好的兼容性,底物适用性广,最高产率可达90%,但反应时间长达72 h,反应效率不高[13]。
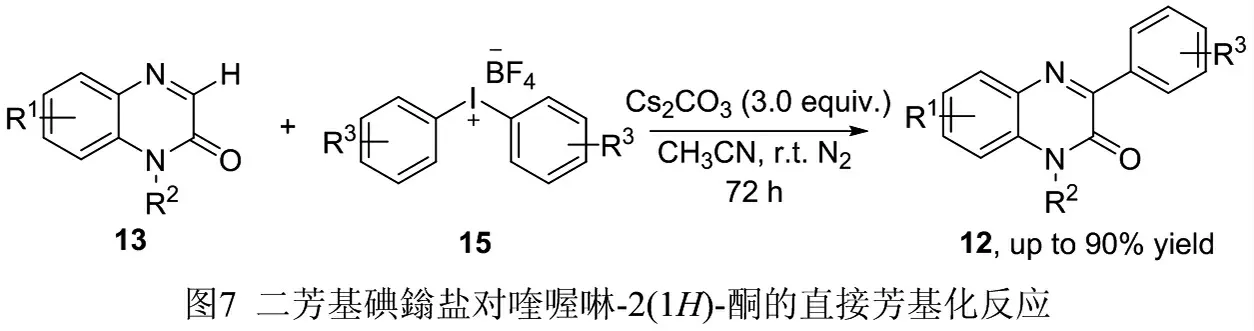
图7 二芳基碘盐对喹喔啉-2(1H)-酮进行的直接芳基化反应
2.3 芳胺/芳基重氮盐对喹喔啉-2(1H)-酮的芳基化反应
芳胺在有机合成中是一类廉价、易得、通用的中间体。在亚硝酸叔丁酯或其他重氮化试剂作用下,芳胺可以转化为芳基重氮盐进而用于交叉偶联反应。如图8(a)所示,在酸性条件下,芳胺(16)和亚硝酸叔丁酯(t-BuONO)原位生成芳基重氮盐,室温下仅需1.5 h 就能够以高达87%的产率获得喹喔啉-2(1H)-酮的芳基化产物[14];与此同时,有学者对上述反应进一步改进,如图8(b)所示,使反应在不加酸的条件下获得更高的产率(92%),反应条件极其温和,可以耐受广泛的官能团,但是反应时间较长,需要48 h[15]。此外,也有学者报道了利用芳基重氮盐(17)在光催化条件下进行喹喔啉-2 (1H)-酮C-3 位的芳基化反应,使反应时间缩短至1 h(图9)[16]。

图8 芳胺对喹喔啉-2(1H)-酮进行的芳基化反应

图9 光催化条件下芳基重氮盐对喹喔啉-2(1H)-酮进行的芳基化反应
2.4 芳酰基过氧化物对喹喔啉-2 (1H)-酮的芳基化反应
芳酰基过氧化物(18)是一种廉价易得的羧酸衍生物,在过渡金属催化、加热和/或光催化条件下,可生成酰氧基自由基和芳基自由基。如图10(a)所示,使用芳酰基过氧化物作为芳基化试剂,EtOAc 作为溶剂,在80 ℃加热条件下反应24 h,能够以高达92%的产率获得喹喔啉-2 (1H)-酮C-3位的芳基化产物[17];在此基础上,有学者在不添加光催化剂的情况下,直接通过可见光照射,芳酰基过氧化物能够在室温条件下对喹喔啉-2 (1H)-酮进行芳基化反应,反应条件极其温和,反应时间短,产率良好(图10(b)[18]和图10(c)[19])。研究发现,该反应能够顺利进行是因为喹喔啉-2 (1H)-酮自身可以起到光催化剂的作用。
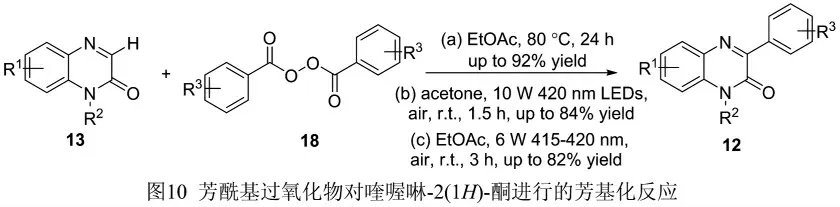
图10 芳酰基过氧化物对喹喔啉-2(1H)-酮进行的芳基化反应
3 结语
合成3-位芳基取代喹喔啉-2(1H)-酮类化合物的方法还有很多,例如利用Pd(TFA)2催化喹喔啉-2(1H)-酮与芳烃的直接偶联实现芳基化[20];通过电催化还原芳基重氮盐与喹喔啉-2 (1H)-酮偶联进行芳基化反应[21];利用电催化还原诱导实现4-氰基吡啶对喹喔啉-2(1H)-酮的直接芳基化[22];通过共价有机材料在光催化条件下实现芳基肼对喹喔啉-2(1H)-酮的芳基化反应[23]等。
多数传统合成方法通常存在一些缺点,例如反应步骤多、需预官能团化起始原料、底物范围窄、反应条件苛刻以及需要过渡金属的参与等,上述缺点成为阻碍传统方法广泛应用的主要限制因素。相较而言,近年来发展的C-H 官能团化方法,能够有效避免过渡金属的使用,反应温和高效,然而存在需要过量的酸、碱或氧化剂以及反应时间长等问题。这些问题也是指导喹喔啉-2(1H)-酮芳基化研究的重要方向,期望在不久的将来,能够开发出更加简单、温和、方便、经济和环境友好的喹喔啉-2(1H)-酮芳基化策略。
