脑白质高信号与帕金森病患者运动症状脑萎缩及认知功能的关系
2022-01-07李阳阳刘欣欣王晓雪
李阳阳 刘欣欣 王晓雪
河南大学第一附属医院,河南开封 475000
帕金森病(Parkinson’s disease,PD)是一种常见老年神经系统退行性疾病,主要病理改变为中脑黑质多巴胺(dopamine,DA)能神经元的变性死亡。流行病学显示,65 岁以上人群中,每10 万人中有1 700 例PD 患者[1]。PD患者主要临床表现为静止性震颤、肌强直、运动迟缓、姿势步态障碍等运动症状,严重影响患者日常生活[2]。脑小血管病(cerebral small vessel disease,CSVD)是以脑内小静脉、小动脉、微静脉、微动脉、毛细血管等小血管受累为主要病理改变,以脑萎缩、微出血、血管周围间隙、腔隙、脑白质高信号(white matter hyperintensity,WMH)为主要影像特征,以认知功能障碍、运动功能障碍、自主神经功能障碍以及情绪异常为主要表现的一组临床综合征,与PD 临床表现极为相似,且其发病亦与年龄有关[3-4]。CSVD会引发老年人尿失禁、情绪障碍、认知功能障碍、运动功能障碍等,因此,理论上而言,合并CSVD 会加重PD 患者运动症状、认知功能障碍程度。
老年人脑部磁共振中经常可发现WMH存在。WMH 又称脑白质疏松(leukoaraiosis,LA)或脑白质损伤(white matter damage,WMD),其潜在病理主要是因CSVD 导致慢性缺血而引发轴突丧失及脱髓鞘改变[5-6]。随着影像学技术不断发展,WMH 越来越受人们重视,关于WMH与各种疾病相关性报道日益增多。但中国较少报道WMH 与PD 患者运动症状、认知功能的关系。近年来研究显示,血-脑屏障破坏可能为神经退行性疾病潜在发病机制,提示血-脑屏障破坏与神经血管单元功能异常可能为PD、CSVD共同发病机制[7]。研究表明,WMH 可能加重PD 患者认知功能障碍,此外,脑萎缩虽为衰老有关影响标志之一,DNA 也与PD 患者认知功能障碍相关,而WHM 可通过轴索-神经元逆行性退变导致脑萎缩和脑萎缩存在潜在相互作用,但WMH是否独立于脑萎缩而加重PD患者认知功能障碍尚未达成共识[8-10]。本研究回顾性分析不同程度WMH 的PD 患者运动症状、脑萎缩及认知功能水平,并分析WMH与PD患者运动症状、脑萎缩及认知功能的关系,旨在为改善PD 临床症状探寻新干预手段。
1 资料与方法
1.1 一般资料 回顾性纳入2019-02—2021-02收治的97例PD患者。纳入标准:(1)均符合《中国帕金森病治疗指南(第4 版)》中关于原发PD诊断标准;(2)参与研究前未接受系统治疗;(3)临床、影像资料完整。排除标准:(1)帕金森叠加综合征、继发性帕金森综合征、特发性震颤、抑郁症;(2)颅脑外伤史、手术史、肿瘤史;(3)其他原因所致运动症状、认知功能障碍;(4)MRI检查禁忌;(5)合并严重肝、肾功能异常;(6)临床、影像资料不全。根据半定量Fazekas 量表评分分为轻度WMH 组(59例)、中度WMH 组(23 例)、重度WMH 组(15例),评分标准见表1。量表总分0~6 分,0~2分为轻度WMH,3~4分为中度WMH,5~6分为重度WMH。

表1 Fazekas量表评分标准Table 1 Fazekas scale scoring criteria
1.2 方法 采用回顾性分析,收集所有患者临床、影像资料。(1)运动症状以Hoehn-Yahr(H-Y)分级、世界运动障碍协会统一帕金森病评定量表第三部分(MDS-UPDRS Ⅲ)评估。记录MDS-UPDRS Ⅲ总分及震颤、肌强直、运动迟缓、姿势步态障碍分项分值。计分方式如下:震颤=3.15 姿势性震颤(左+右)+3.16 动作性震颤(左+右)+3.17 静止性震颤(左上肢+右上肢+左下肢+右下肢+唇/下颌)+3.18 静止性震颤时间。肌强直=3.3肌强直(颈部+左上肢+右上肢+左下肢+右下肢)。运动迟缓=3.4手指捏合(左+右)+3.5 手掌运动(左+右)+3.6 前臂回旋运动(左+右)+3.7 脚趾拍地(左+右)+3.8腿部灵活性(左+右)+3.9 从椅子上起立+3.14运动迟缓。姿势步态障碍=3.10 步态+3.11 冻结步态+3.12姿势平衡度。(2)脑萎缩以三维磁共振结构成像评估,均采用3T MRI 系统(GE 3.0T Discovery MR 750)行磁共振扫描,扫描序列为 3D-MPRAGE 磁敏感加权成像(susceptibility weighted imaging,SWI)序列、液体衰减反转恢复成像(fluid attenuated inversion recovery,FLAIR)序列及T1、T2加权相序列。3D-MPRAGE T1加权相参数相同:矢状位片数为196,层厚1 mm,反转角为8°,重复时间/回波时间为7 ms/3 ms。测定指标为全脑皮质平均厚度、双侧丘脑平均灰质体积,分析软件为FreeSurfer 6.0 版。(3)认知功能以简易精神状态量表[11](mini-mental state examination,MMSE)、蒙特利尔认知评估量表[12](Montreal cognitive assessment,MoCA)评估。MMSE量表包含定向力、注意力、计算力、即刻及短期记忆、语言及听从指令等5 个维度,总分0~30分,0~9 分为重度障碍,10~20 分为中度障碍,21~25 分为轻度障碍,≥26 分为正常。MoCA量表包含空间与执行能力、注意力、语言能力、抽象能力、命名能力、延迟记忆能力和定向力等7个维度,总分0~30分,≥26分为正常。
1.3 统计学方法 数据采用SPSS 22.0 软件处理。计数资料以率(%)表示,行χ2检验;正态分布计量资料以均数±标准差(±s)表示,3组间行单因素分析,两两成对行LSD-t 检验;等级资料多组间行Kruskal-Wallis 检验,两两成对行Mann-Whitney U 检验;采用有序多分类Logistic 回归、Spearman 相关分析WMH 与PD 患者运动症状、脑萎缩及认知功能的关系。以P<0.05为差异有统计学意义。
2 结果
2.1 3组患者人口学资料及临床特征比较 3组患者性别、BMI、高血压史、糖尿病史、冠心病史、吸烟史、饮酒史、文化程度、H-Y 分级、丘脑体积等比较,差异均无统计学意义(P>0.05);3 组患者年龄、发病年龄、病程、MDS-UPDRS Ⅲ总分、震颤、肌强直、运动迟缓、姿势步态障碍分值、全脑皮质平均厚度、MMSE评分、MoCA评分比较,差异均有统计学意义(P<0.05),年龄、发病年龄、MDS-UPDRSⅢ总分、震颤、肌强直、运动迟缓、姿势步态障碍分值比较,重度WMH 组>中度WMH 组>轻度WMH 组,病程、全脑皮质平均厚度、MMSE评分、MoCA 评分比较,重度WMH 组<中度WMH组<轻度WMH组(P<0.05)。见表2。典型患者三维磁共振结构成像见图1。
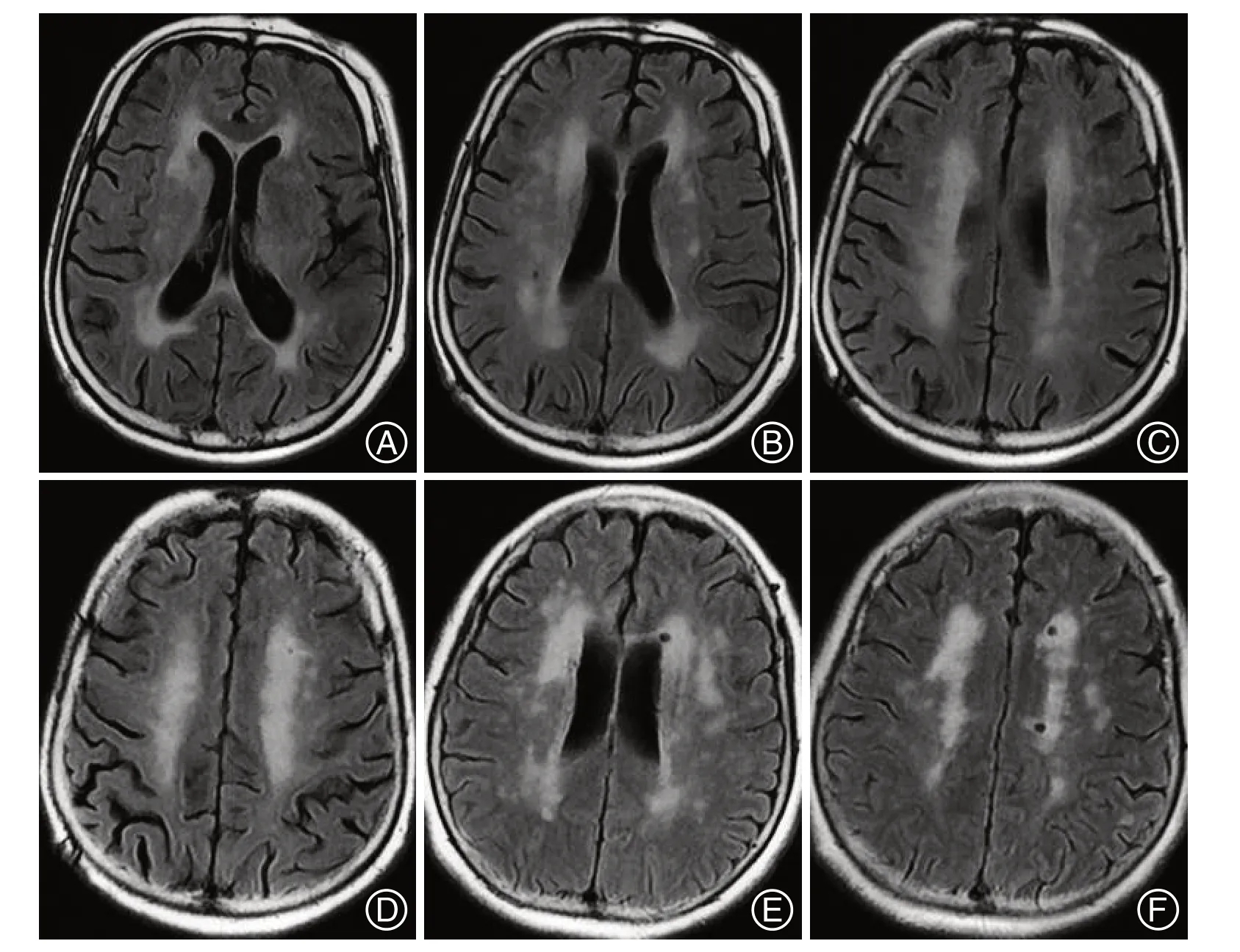
图1 典型患者三维磁共振结构成像图Figure 1 Three-dimensional magnetic resonance structure imaging of a typical patient
2.2 有序多分类Logistic回归分析 以WMH程度为因变量,将表2 中差异有统计学意义(P<0.05)的因素为自变量纳入有序多分类Logistic 回归分析模型,结果显示,年龄、发病年龄、MDS-UPDRS Ⅲ总分、震颤、肌强直、运动迟缓、姿势步态障碍分值为WMH程度的独立危险因素(P<0.05),病程、全脑皮质平均厚度、MMSE 评分、MoCA 评分为WMH 程度的独立保护因素(P<0.05)。见表3。

表2 3组患者人口学资料及临床特征比较Table 2 Comparison of demographic data and clinical characteristics of the three patient groups

表3 有序多分类Logistic回归分析Table 3 Ordinal multi-class Logistic regression analysis
2.3 WMH与PD患者运动症状、脑萎缩及认知功能的相关性分析 Spearman 相关分析显示,WMH 与MDS-UPDRS Ⅲ总分、震颤、肌强直、运动迟缓、姿势步态障碍均呈显著正相关(r=0.431、0.464、0.362、0.432、0.496,P<0.01),与全脑皮质平均厚度、MMSE评分、MoCA评分均呈显著负相关(r=—0.652、—0.599、—0.401,P<0.01),而与丘脑体积无关(P>0.05)。见表4。

表4 WMH与PD患者运动症状、脑萎缩及认知功能的相关性分析Table 4 Correlation analysis of WMH and motor symptoms,brain atrophy,and cognitive function in PD patients
3 讨论
目前认为,PD 发病可能与免疫/炎症反应、线粒体功能障碍、氧化应激反应、兴奋性毒性、环境因素、遗传因素等多机制有关[13]。环境因素中长期农药暴露是主因,而遗传因素中主要为PD相关基因错义突变,致使α-突触核蛋白聚集,加剧其介导神经毒性[14]。此外,高龄为PD发病最突出危险因素,PD发病率随年龄升高呈指数性升高,90 岁以上人群发病率接近100%[15]。
PD 患者除运动症状外,还会伴随情绪低落、焦虑、睡眠障碍、认知障碍等非运动症状,其中认知功能障碍较为常见,且程度随PD 进展逐渐加重[16]。研究表明,PD患者认知功能障碍可能继发于灰质萎缩、WMH、多巴胺能、非多巴胺能神经递质系统功能异常、脑组织路易小体分泌异常、颅内血管病变等途径[17]。WMH作为CSVD重要影像学改变,近年来在PD认知功能障碍中作用逐渐被临床所重视[18]。本研究回顾性分析97例PD患者人口学资料、临床特征及WMH 程度发现,WMH 严重程度与PD患者运动症状呈明显正相关,而与PD 患者脑萎缩、认知功能呈明显负相关。
国外研究显示,WMH 和老年PD 患者姿势步态障碍有关[19]。另一项国内研究则表明,WMH 与PD 患者静止性震颤具有显著相关性[20]。本研究中经Logistic 回归、Spearman相关分析发现,WMH 与PD 患者MDS-UPDRSⅢ总分、震颤、肌强直、运动迟缓、姿势步态障碍均呈明显正相关,随着WMH 程度加深,MDS-UPDRS Ⅲ总分、震颤、肌强直、运动迟缓、姿势步态障碍评分明显升高,与上述研究结果一致。分析原因[21-22]:其一,WMH可使脑黑质多巴胺能神经元水平降低,致患者出现各种运动症状;其二,WMH脑白质损伤使基底神经节-丘脑皮层环路遭到破坏,阻断其信号传导,从而导致各种运动症状。
脑萎缩(即皮质、皮质下灰质萎缩)系人体衰老典型特征之一,近年来研究显示,脑萎缩和PD 患者认知功能障碍存在明显相关,但未见与WMH 相关报道,且有关机制尚不清楚[23]。脑白质质量占脑部一半,主要血供来源于终末动脉,吻合支较少,难以建立侧支循环,易出现缺血情况,因而脑白质萎缩进程相对灰质更早。研究表明,有WMH 患者较无WMH 患者脑萎缩程度更深,推测WMH 可能为脑萎缩危险因素之一[24]。本研究表明,WMH 与PD 患者全脑皮质平均厚度呈明显负相关,全脑皮质平均厚度为WMH独立保护因素,与相关研究[25]结果相同,分析原因可能与WMH 致使轴索-神经元逆行性退变从而引发脑萎缩有关。此外,本研究发现脑萎缩会加重PD 患者认知功能障碍,提示WMH 可能通过影响脑萎缩而加重PD 患者认知功能障碍。
尽管极少数研究认为WMH 不会对PD 患者认知功能造成影响,但大部分研究认为WMH 与PD 患者认知功能有关。既往病理学认为,PD 患者认知功能障碍主要与路易小体异常沉积及神经纤维缠结有关,但越来越多研究表明,PD 患者认知功能障碍可能与多种因素有关[26-27]。研究[28]指出,脑旁室、深部WMH 均可影响PD 患者认知功能。本研究结果与之一致,WMH 与PD 患者MMSE 评分、MoCA 评分均呈明显负相关,随程度加深,MMSE 评分、MoCA 评分明显降低。分析原因[29-36]:其一,WMH通过破坏皮质和(或)额叶皮质下神经网络通路,阻断扣带回内侧、外囊外侧胆碱能纤维通路,从而影响PD 患者认知功能;其二,WMH 使得皮质变薄,导致皮质病变,从而影响PD患者认知功能。
WMH 会加重PD 患者运动症状及认知功能障碍,并加剧脑萎缩进程,临床需警惕PD合并WMH,尽早予以脑血管二级预防。本研究局限在于:本研究为回顾性分析,可能会对结果产生一定偏倚;本研究未划分不同PD 临床亚型,不同亚型PD 患者WMH 是否存在差异有待进一步证实;WMH 评估采用半定量Fazekas 量表,可能存在敏感性较低问题;此外,本研究样本量较小,患者年龄范围较小,但高龄PD 患病率非常高。考虑到以上局限,未来仍需进一步完善研究设计,为PD 临床诊治提供更为可靠的依据。
