抗Ro52抗体阳性的自身免疫性脑炎临床特征分析
2022-01-07高乐虹郭雅聪刘爱华
苏 楠 高乐虹 陈 佳 郭雅聪 刘爱华
1)首都医科大学宣武医院,北京 100053 2)濮阳市人民医院,河南濮阳 457000
抗SSA/Ro抗体是目前抗核抗体谱中检测的常见项目,在许多自身免疫性疾病中均可见到,1958 年首先由JONES 在干燥综合征(Sjogren’s syndrome,SS)患者的唾液腺和泪腺里发现,根据分子量不同主要分为Ro52 和Ro60两种,Ro52蛋白相对分子质量为52×103,含有一个锌指结构域、B-box 基序以及N 端的卷曲螺旋结构[1],属于三结构域蛋白家族成员之一,是一种重要的免疫调节蛋白,多见于干燥综合征、多发性肌炎/皮肌炎、原发性胆汁性肝硬化和弥漫性皮肤硬皮病的患者。研究显示,在系统性红斑狼疮和干燥综合征的患者中,Ro52 蛋白可抑制细胞的增殖及促进细胞凋亡[2]。在原发性干燥综合征中,抗SSA/Ro抗体和凋亡细胞的联合在外周血单个核细胞诱导α干扰素(IFN-α)中起关键作用。在原发性干躁综合征(primary Sjogren’s syndrome,pSS)患者的唾液腺中,上皮细胞凋亡小体与抗SSA抗体结合,可通过浸润细胞诱导IFN-α产生,进而诱导上皮细胞表达肿瘤坏死因子。在体内,SS中I型干扰素可诱导局部自身抗体产生,Ro52是胞质干扰素诱导的蛋白质[3]。近年来抗Ro52 抗体在感染、肿瘤等相关领域许多新的研究显示,抗Ro52 抗体在卵巢癌的出现率较高,并认为其可预测卵巢癌的良性预后[4]。近年来,自身免疫性脑炎逐渐引起学者们的重视,2007年国际抗NMDA受体抗体脑炎报道,2010 年我国首例抗NMDA 受体抗体脑炎报道,目前发现的有LGI1脑炎、抗GABA受体脑炎、抗接触蛋白相关蛋白2(CASPR-2)脑炎、抗GAD-65 脑炎、抗-α-氨基3-羟基-5-甲基-4-异唑-丙酸受体脑炎,还有少见的抗二肽基肽酶样蛋白抗体6 脑炎[5]、抗IgLON 家族蛋白5脑炎等。抗Ro52抗体阳性合并自身免疫性脑炎的病例临床可以见到,但临床特征尚无研究。本研究纳入8例抗Ro52抗体阳性自身免疫性脑炎患者的临床资料,并随访观察,同时对比32 例抗Ro52 抗体阴性自身免疫性脑炎患者的部分资料,以期了解伴Ro52 抗体阳性的自身免疫性脑炎的特点,加强临床认识和诊治经验。
1 临床资料
1.1 一般资料 2018-01—2021-06首都医科大学宣武医院收治8例抗Ro52抗体阳性的自身免疫性脑炎患者。纳入标准:(1)诊断均符合中国自身免疫性脑炎诊治专家共识中确诊的自身免疫性脑炎诊断标准;(2)Ro52抗体检测阳性。排除标准:(1)诊断为抗体阴性的自身免疫性脑炎;(2)未在本院完成腰穿检查的患者;(3)未完成抗核抗体谱检测的患者。同时收集抗Ro52阴性的自身免疫性脑炎患者32例。纳入患者姓名、性别、年龄、入院时间、发病至就诊时间、临床表现、头颅磁共振、脑电图、脑脊液压力、糖、蛋白、氯化物、自身免疫性脑炎抗体类型及滴度、抗核抗体谱、抗狼疮抗凝物、抗中性粒细胞抗体、甲状腺功能全项、电解质、治疗以及预后。
1.2 临床特征 Ro52抗体阳性患者男3例,女5例,包括4例LGI1脑炎,1例抗NMDA受体抗体脑炎,2 例GABA 脑炎,1 例GAD65 脑炎,发病年龄14~68 岁,中位年龄56 岁,发病至就诊时间7 d~3 a,中位时间33 d,其中7例表现为癫痫发作(87.5%),其中2例为部分性发作伴意识障碍,余5例为全面性强直-阵挛发作(general tonic-clonic seizure,GTCS),4 例记忆力下降(50%),2例精神行为异常(25%),1例头痛、发热,其他伴随症状还包括头晕、失语、构音障碍、肋部刺痛等。见表1。Ro52抗体阴性的患者男15例,女17例,年龄9~66岁,其中LGI1 11例,NMDA 9 例(2 例合并MOG),GAD65 6 例,CASPR-2 5 例,GABA-B 1 例。症状表现包括癫痫22例(68.7%),记忆力下降11例(33.3%),精神行为异常5例(15%),头痛1例。不同类型抗体脑炎的癫痫发生率见表2。
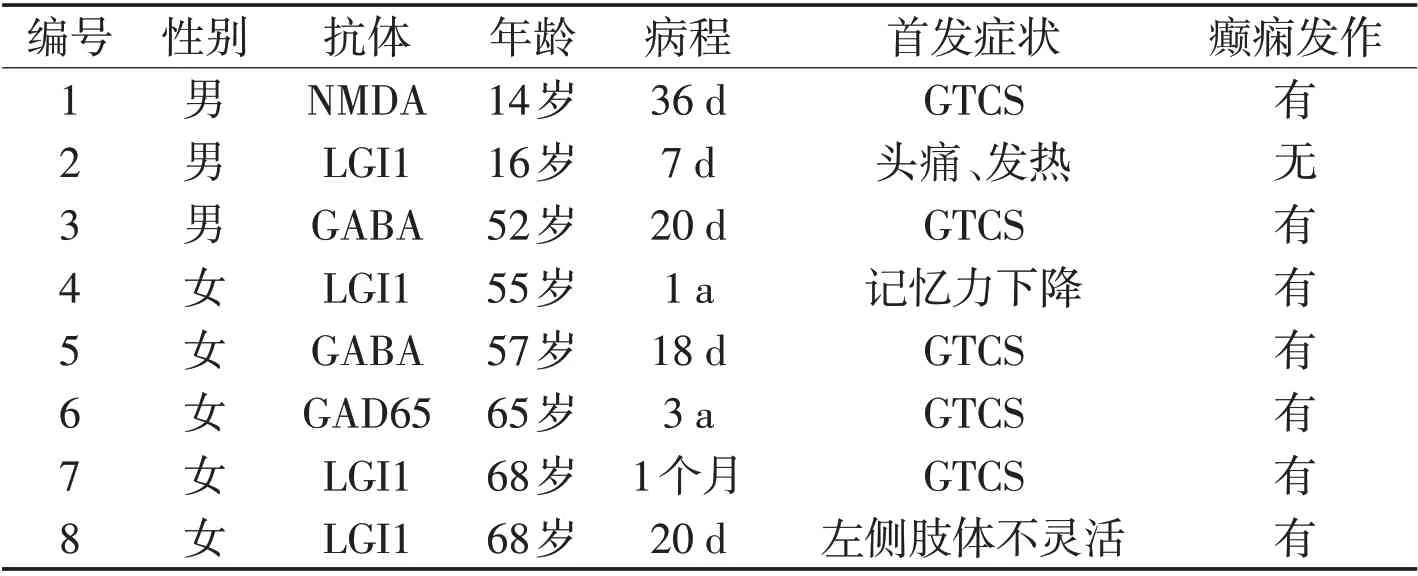
表1 Ro52抗体阳性的自身免疫性脑炎患者临床表现Table 1 Clinical manifestations of AE with Ro52 antibody positive

表2 Ro52抗体阳性与阴性的自身免疫性脑炎癫痫发生率Table 2 Incidence of epilepsy of AE with Ro52 antibody positive and negative
1.3 实验室检查 Ro52抗体阳性患者的脑脊液压力 80~160 mmH2O( 中位数 138mmH2O,1 mmH2O=0.0 098 kPa),白细胞数1~60×106个/L(参考值0~6×106个/L),中位数8×106个/L;蛋白32~72 mg/dL,中位数39.5 mg/dL,升高3例;氯化物95~131 mmol/L,中位数126 mmol/L;糖均正常45~104.95 mg/dL,中位数58.2 mg/dL。抗Ro52 抗体阳性(++)2 例,强阳性(+++)6 例,合并其他自身免疫性抗体异常6 例,分别为SSA 阳性(Ro60)4 例,抗核抗体(ANA)阳性2 例,狼疮抗凝物1 例,抗线粒体抗体2 例,抗β2-糖蛋白1 抗体阳性1 例。合并甲状腺功能减低1 例,甲状腺抗体增高5例,低钠血症2 例,钠低限2 例。Ro52 抗体阴性患者的脑脊液压力55~290 mmH2O(中位数140 mmH2O,四分位116~170 mmH2O),白细胞0~100×106个/L,糖42.5~176 mg/dL,蛋白14~337 mg/dL,氯化物119~176 mmol/L。见表3。

表3 Ro52抗体阳性的自身免疫性脑炎患者实验室检查Table 3 Laboratory examination of AE with Ro52 antibody positive
1.4 影像学及电生理检查 Ro52抗体阳性的患者头颅磁共振2 例异常(25%),为编号2 和编号3(图1),均累及双侧内侧海马,另外6 例未见特征性异常。脑电主要表现为多导联的慢波,2例见尖波节律。Ro52抗体阴性患者12例表现出头颅磁共振异常高信号(37.5%),均累及海马,个别同时累及其他脑叶,脑电图多表现为慢波。

图1 A~D:1 例52 岁男性GABA 脑炎患者,依次为轴位T1、T2、T2-FLAIR、冠状位T2-FLAIR,可见T2及T2-FLAIR双侧海马高信号;E~F:1例65岁女性,LGI1脑炎,未见明显异常Figure 1 A-D:A 52-year-old male patient with GABA encephalitis,followed by axial T1,T2,T2-FLAIR,and coronal T2-FLAIR,with bilateral hippocampal hyperintensities seen in T2 and T2-FLAIR;E-F:One case of 65 years old Female,LGI1 encephalitis,no obvious abnormalities
2 治疗及随访结果
Ro52阳性的8例患者均仅使用一线治疗,其中5 例使用激素冲击治疗,3 例联用激素和丙种球蛋白。联用激素和丙种球蛋白的患者随访评分0~2分,联用丙种球蛋白和激素的无复发,单用激素的患者有1 例复发,为LGI1 脑炎,表现为面臂肌张力障碍。Ro52 抗体阴性的患者均使用激素治疗,6例同时使用丙种球蛋白治疗,2例进行血浆置换,6例使用二线治疗,均为复发患者,1 例为GAD65 脑炎,1 例CASPR-2,2例NMDA合并MOG,1例NMDA,1例LGI1。复发主要表现为癫痫发作和精神症状,其中4例使用吗替麦考酚酯,2例使用利妥昔单抗。Ro52 抗体阳性与阴性患者临床表现、实验室检查、随访复发结果比较见表4。

表4 Ro52抗体阳性与阴性自身免疫性脑炎患者临床表现、实验室检查、随访结果比较Table 4 Comparison of clinical manifestations,laboratory tests and follow-up results of AE patients with Ro52 antibody positive and negative
3 讨论
自身免疫性脑炎多以癫痫发作、记忆力下降、精神行为异常为主要表现,常累及颞叶、海马、边缘系统。自身免疫性脑炎可出现在感染后,目前发现的有单疱病毒感染[6],日本乙型脑炎病毒[7]、EB 病毒以及目前正在流行的新冠肺炎病毒[8]等。本研究中Ro52抗体阳性患者1 例发病前有上呼吸道感染、发热史,细胞数增高,但查明具体病原类型,自身免疫性脑炎癫痫发病率高,且常合并其他系统性自身免疫性抗体增高,抗Ro52 抗体阳性的患者临床特征、病程演进以及预后尚未见报道。
自身免疫性脑炎合并癫痫比例高,可表现为各种类型的癫痫发作形式,如局灶性发作、伴或不伴意识障碍、全面强直-阵挛发作,可进展为癫痫持续状态。自身免疫性脑炎引起的癫痫以及自身免疫相关性癫痫亦是目前研究的热点[9]。国际抗癫痫联盟(ILAE)最新的定义和分类指南明确指出,以NMDAR或LGI1抗体为特征的自身免疫性脑炎是癫痫免疫病因学的代表[10]。研究显示,各型自身免疫性脑炎癫痫发病率不同。一项研究纳入66例具有抗神经元抗体介导的自身免疫性脑炎或Rasmussen 脑炎的患者发现,癫痫发作是最常见的症状。抗NMDAR和抗LGI1脑炎占多数,分别为41%和24%[11]。一项185 例中国人自身免疫性脑炎的研究显示,癫痫发生率为48.4%;一项纳入多个亚组的自身免疫性脑炎与癫痫的系统评价认为,自免脑合并癫痫的发生率42%,而NMDA 合并癫痫的发生率可达73%[12]。NMDA 受体是由GluN1 和GluN2 或GluN3亚基组成的配体门控离子通道,其主要功能是突触可塑性和学习记忆[13],甘氨酸与GluN1 或GluN3 结合,谷氨酸是一种兴奋性神经递质,与受体[14]结合后,能使突触Ca2+通透性变化表现出兴奋性毒性或神经保护作用。NMDA 受体主要存在于边缘系统(海马、海马旁回和杏仁核),当体内有抗NMDA 受体抗体或亚单位基因突变时,就会引起癫痫发作。2013 年国内报道了第1 例抗LGI1 脑炎,近年来多项国人研究显示LGI1 脑炎比例较高,LGI1 脑炎特征性表现为一侧面部-上肢的不自主运动样癫痫发作(面-臂肌张力障碍,近年研究表明仍认为是一种癫痫发作),此外LGI1脑炎还可出现发热、感觉性、竖毛样发作等[15]。LGI1 是一种分泌蛋白,主要分布在颞叶和海马,不仅在发育过程中发挥重要作用,还通过作用于电压门控钾通道Kv1.1 的神经元兴奋性,以及通过调节α-氨基-3-羟基-5-甲基-4-异唑丙酸受体(AMPA-R)的表面表达,在突触传递中发挥重要作用[16]。LGI1 连接突触前膜解整合素金属蛋白酶23与突触后膜解整合素金属蛋白酶22形成突触间蛋白复合物,使抑制信号从突触前钾离子通道传递给突触后膜AMPA-R,LGI1 抗体破坏这种抑制性信号传递而导致癫痫[17]。本文中8 例Ro52抗体中4 例为LGI 脑炎,2 例LGI1 脑炎患者表现出面-臂肌张力障碍,40 例患者中15 例LGI1 脑炎,占比最高。本研究中8 例抗Ro52抗体阳性患者中7 例合并癫痫发作,比例达87.5%,除1 例LGI1 脑炎仅表现为精神症状外,其他患者均表现为部分性或全面性癫痫发作,较Ro52 抗体阴性的自身免疫性脑炎癫痫发生率(68.7%)高,考虑与阳性组LGI 脑炎比例高有关。同时可见,NMDA 受体脑炎合并Ro52 抗体比例较低。既往研究发现,HLA-DQB1 和HLADQA1 等位基因与原发性干燥综合征患者抗Ro 抗体阳性相关[18]。HU等[19]对自身免疫性脑炎患者进行研究,探究中国汉族人群自身免疫性脑炎是否与人白细胞抗原(HLA)基因型的相关性,对101例自身免疫性脑炎患者的HLA 基因型与200 例健康对照组进行对比分析,结果表明,DRB1*03:01或DQB1*02:01等位基因和扩展的DRB1*03:01~DQB1*02:01单倍型代表了LGI11脑炎的强易感性位点,抗NMDAR脑炎患者HLA相关性与健康对照组差异无统计学意义。因此得出结论,LGI11 脑炎和抗Ro 抗体阳性的干燥综合征具有相同的易感基因DRB1*0301 和DQB1*0201。
LGI 脑炎的临床表现还包括快速进展的痴呆、顽固的低钠血症、快动眼期睡眠行为障碍[20]等。2014 年NAASAN 等[21]报道了3 例LGI1 脑炎患者出现心动过缓,严重程度足以让患者使用起搏器的治疗。近年有研究显示Ro52 抗体可影响心肌细胞离子通道,通过母体引起新生儿先天性心律失常及成人QT间期延长、窦性心动过缓[22]。动物模型显示,针对Ro52 蛋白第200~239 位氨基酸的单克隆抗体可引起小鼠的先天性心脏传导阻滞[23]。本研究中8例患者第1例患者入院时心率45次/min,血压97/52 mmHg(1 mmHg=0.133 kPa),其余患者心率在50~80 次/min,但由于多数患者伴癫痫反复发作,未完成动态心电图监测。由于自身免疫性脑炎常累及颞叶、海马边缘系统,许多患者可出现心慌、恐惧先兆,心电图表现为心率增快,故临床较少关注患者心率慢的情况。因此,临床医生在伴Ro52 抗体阳性的自身免疫性脑炎的诊疗过程中,尤其是抗LGI1抗体脑炎患者,应密切监测患者的心律,且应避免过度应用镇静药物。
既往研究显示LGI1抗体脑炎与其他自身免疫性疾病共病的比例高[24]。本研究发现Ro52 阳性自身免疫性脑炎患者合并其他自身免疫性抗体异常的比例明显高于阴性组(75%vs 8%),尤其是与甲状腺抗体增高共病率高(62.5%)。既往研究比较了抗甲状腺抗体阳性与阴性的抗NMDA受体脑炎患者,显示抗甲状腺阳性组患者意识水平下降精神行为异常或认知障碍及癫痫的发生率高于阴性组患者,但差异无统计学意义[25],但甲状腺抗体阳性组病程中最大改良Rankin 量表(mRS)评分更高,且采用2 种及2 种以上免疫治疗措施比例更高,差异有统计学意义(P<0.05)。抗Ro52抗体阳性与甲状腺抗体增高共病的现象值得进一步关注。本研究中3 例男性患者年龄分别为16、17、52 岁,而女性患者发病年龄50~70 岁,较男性患者明显偏晚。而Ro52 阴性组50 岁以上男女比例为1∶1。一项针对视神经脊髓炎谱系疾病的研究也显示,伴常见非器官特异性自身抗体的NMOSD患者发病年龄往往更晚,且脑脊液细胞数较不合并系统性免疫组患者高[26]。
自身免疫性脑炎的治疗目前主要包括一线治疗及二线治疗,一线治疗包括糖皮质激素、静脉注射免疫球蛋白和血浆交换,二线免疫药物包括利妥昔单抗与静脉应用环磷酰胺,主要用于一线免疫治疗效果不佳的患者,长程免疫治疗药物主要有吗替麦考酚酯和硫唑嘌呤,主要用于复发病例,也可用于一线免疫治疗效果不佳的患者和肿瘤阴性的抗NMDAR患者。
自身免疫性脑炎有较高的复发率,目前自身免疫性脑炎复发定义为患者症状缓解或稳定至少2 个月后出现其他原因不能解释的新发症状或症状的加重,以抗NMDAR脑炎复发率最高(0~35%)[27],LGI1脑炎的复发率4%~13%,Meta分析显示抗NMDA受体脑炎患者应用利妥昔单抗或维持人免疫球蛋白使用6 个月或以上与其不再复发有显著相关性[28]。本研究中合并Ro52抗体阳性的自身免疫性脑炎中1 例LGI1 脑炎复发,复发率12.5%,抗LGI1脑炎容易发生在免疫抑制剂减量过程中,该患者在应用激素的半年内症状稳定,停用激素1个月后复发,但临床症状较首次发病较轻,仅表现为左侧口角抽动。合并Ro52抗体阳性的自身免疫性脑炎对一线免疫治疗反应较好,但由于病例数少,尚需大样本的病例研究。关于Ro52 抗体目前了解有限,伴Ro52 抗体阳性的自身免疫性脑炎值得临床进一步关注。
