TLRs及其下游炎性因子在溃疡性结肠炎早期诊断及预后评估中的价值分析
2022-01-07刁凌云皇金萍陈洋孙唱王胜英罗玉国葛飞
刁凌云,皇金萍,陈洋,孙唱,王胜英,罗玉国,葛飞
(1.南京中医药大学徐州附属医院消化内科,江苏 徐州 221000;2.扬州大学医学院附属海安市中医院消化科,江苏 海安 226600)
溃疡性结肠炎(ulcreative colitis,UC)是一种侵袭肠道粘膜的慢性炎症和溃疡性病变,临床表现包括血性腹泻、腹痛、里急后重、呕吐等,偶尔表现为关节炎、虹膜睫状体炎和肝功能障碍等[1]。UC以病情迁延不愈、缓解和复发交替为特征,使临床诊断面临巨大挑战。寻求准确且高效的监测手段对早期发现UC,并采取有效措施治疗降低临床复发率、改善疾病预后十分重要[2]。
免疫反应是造成炎症加重及组织损伤的关键,由于核转录因子κB(NF-κB)核内与kB序列结合可影响多种炎性因子如肿瘤坏死因子(TNF-α)、白细胞介素-1β(IL-1β)和IL-10表达,故NF-κB与炎性反应、细胞增殖等关系密切[3]。炎症反应在UC的发生发展中占据主要地位,Toll样受体家族(TLRs)分布于不同的免疫细胞表面。研究[4]发现,TLR2、TLR4在UC中表达升高,而TLR1水平则未见明显波动。由于TLR4可通过LPS下游MyD88依赖性及非依赖性信号转导通路来多种炎性因子分泌,故TLR4介导的信号通路被认为是UC发病的重要因素[5]。髓过氧化物酶(MPO)是存在于中性粒细胞的一种过氧化物酶,具有使过氧化氢还原的能力,可定量反应组织炎性损伤的程度[6]。本研究通过检测UC患者TLR2、TLR4、NF-κB、IL-1β、TNF-α、IL-10及MPO活性,分析各指标在UC早期诊断及预后评估中的价值,为临床治疗提供新思路。
1 资料与方法
1.1 一般资料
选取2018年7月至2021年6月南京中医药大学徐州附属医院收治的108例UC患者为研究对象,并设为研究组;另选102例同期于本院进行肠镜检查未见异常患者为对照组。研究组中,男性58例,女性50例;年龄25~65岁,平均(41.33±8.98)岁;病程5~31个月,平均(23.41±4.25)个月;主要病变位置:乙状结肠36例,直肠34例,左半结肠22例,全结肠16例。对照组中,男性54例,女性48例;年龄24~62岁,平均(41.65±8.37)岁。本研究已获得院伦理委员会批准,所有研究对象均签署知情同意书。两组患者性别、年龄等比较,差异无统计学意义(P>0.05)。UC患者参考Mayo评分[7]评估疾病临床活动度,并分为活动期组(总分3~12分,n=70)及缓解期(评分<2分,n=38);参考Sutherland疾病活动指数(disease activity index,DAI)[8]对活动期患者进行分级,并分为轻度组(n=21)、中度组(n=27)及重度组(n=22),依据预后分为预后良好组(n=44)及预后不良组(n=26)。纳入标准:(1)UC纳入标准参照《炎症性肠病诊断与治疗的共识意见(2018年,北京)》[9];(2)入组前2月内均未接受相关系统性治疗者;(3)临床资料完整。排除标准:(1)合并其它感染性结肠炎、肠阿米巴病等;(2)合并恶性肿瘤;(3)合并重要器官功能障碍;(4)合并其它免疫系统疾病。
1.2 方法
1.2.1 资料收集 收集所有研究对象年龄、性别、疾病活动情况、临床表现、DAI评分、内镜表现等。并根据蒙特利尔分型区[10]分各UC患者病变位置,其中E1代表病变仅存在于直肠;E2代表病变累及左半结肠;E3为广泛病变累及脾曲乃至全结肠。另根据受累肠段最严重处的血管纹理、出血情况、糜烂和溃疡计算溃疡性结肠炎内镜下严重程度指数(ulcerative colitis endoscopic index of severity,UCEIS)[11]评分,其中2~6分为内镜下轻、中度活动度,7分或8分为内镜下重度活动度。见表1。

表1 UCEIS评分细则
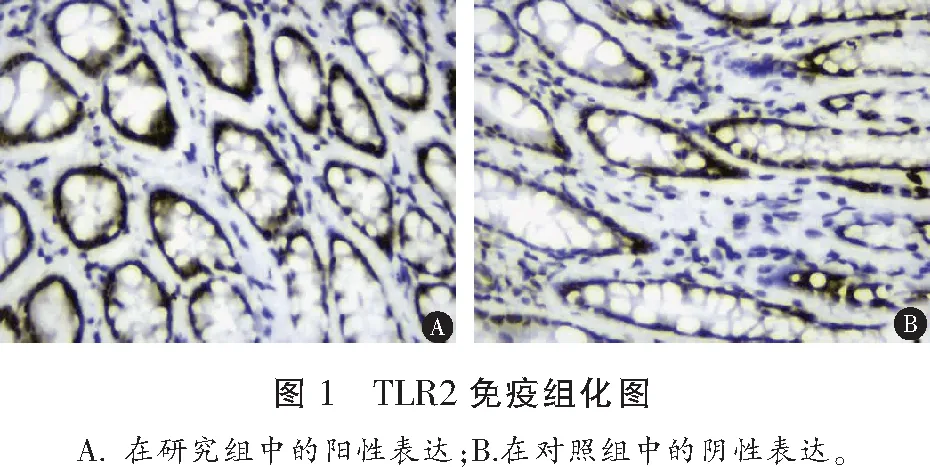
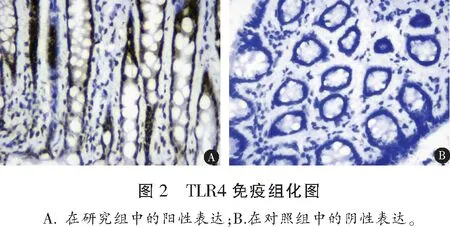
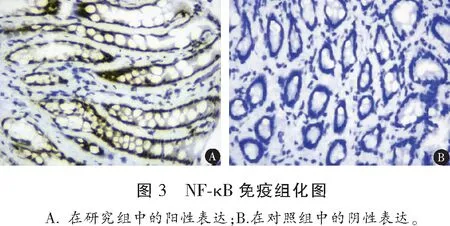
1.2.2 TLR2、TLR4、NF-κB 蛋白表达水平检测 所有患者进行结肠镜检查,并在结肠炎症最明显处取活检粘膜及适量组织,进行固定。采用免疫组织化学法检测各组结肠组织中TLR2(美国Santa Cruzsc公司,货号:P4052Rb-h)、TLR4(美国Santa Cruzsc公司,货号:P4051Rb-h)、NF-κB(上海贝博生物,货号:YT746)蛋白表达强度,连续切片5张(4~5 μM),对石蜡切片常规脱蜡,水化,封闭,脱水,热修复抗原,PBS液洗涤两次(5 min/次)。滴加5%正常山羊血清,滴加均为1∶2 000稀释的TLR2、TLR4多克隆抗体50 μL于不同切片上,PBS冲洗3次,5 min/次。将载玻片从冰箱中取出,孵育(37 ℃,30 min),PBS冲洗3次;甩干后滴加试剂1(生物素标记山羊抗兔IgG),再次孵育、冲洗,滴加试剂2(辣根酶标记的链霉卵白素工作)),PBS冲洗3次,5 min/次;最后DAB进行显色。日本OLMPUS公司显微摄像系统进行观察,在所有切片上下左右及中央部位随机选取5个视野图片,以染色呈棕褐色或者棕黄色沉淀为阳性细胞标志, Image Pr0 Plus 6.0图像分析系统(美国MediaCybemetics公司)进行半定量分析,测定组织TLR2、TLR4阳性细胞的IOD值。
1.2.3 炎性因子IL-1β、TNF-α、IL-10水平检测 采用放射免疫分析法检测各组血清IL-1β、TNF-α、IL-10水平。设备为FI-2003/2008ps全自动γ放射免疫计数器,IL-1β、TNF-α、IL-10放射免疫分析试剂盒购自北京福瑞生物工程公司,货号分别为ML-Elisa-0378、ML-Elisa-1420、BJ-R64865。严格按照试剂操作说明书完成试验。
1.2.4 MPO活性检测 参照邱重阳[12]研究方法,并进行改进。取出的结肠组织以10%甲醛固定,石蜡包埋后切为4 μL薄片,HE染色,通过过供氢体邻连茴香胺供氢后生成黄色化合物,在460 nm处通过比色测定A产物的生成量,从而推算出MPO的活力。计算公式:MPO(u/g)=测定管OD值-对照管OD值/0.113。
1.2.5 预后随访 根据《炎症性肠病诊断与治疗的共识意见(2012 年广州)》[13]对 UC 患者进行标准化治疗 ,治疗两个月后由同一名医师复查肠镜,钳取原病变位置组织,采用Mayo内镜评分[9]对粘膜愈合情况进行评估,并将Mayo内镜评分为0分者纳入预后良好组,Mayo内镜评分≥1分者纳入预后不良组。
1.3 统计学分析

2 结果
2.1 研究组活动期和缓解期患者与对照组TLR2、TLR4、NF-κB、IL-1β、TNF-α、IL-10及MPO活性比较
研究组活动期组、缓解期患者及对照组TLR2、TLR4、NF-κB、IL-1β、TNF-α水平及MPO活性比较,差异均有统计学意义(P<0.05),且活动期组>缓解期组>对照组;IL-10水平和活动期组<缓解期组<对照组比较差异有统计学意义(P<0.05)。见表2、图1、图2及图3。

表2 研究组活动期和缓解期患者与对照组TLR2、TLR4、NF-κB、IL-1β、TNF-α、IL-10及MPO活性及比较
2.2 活动期组中不同病情程度患者TLR2、TLR4、NF-κB、IL-1β、TNF-α、IL-10及MPO活性比较
轻度组、中度组及重度组TLR2、TLR4、NF-κB、IL-1β、TNF-α水平及MPO活性比较,差异有统计学意义(P<0.05),且重度组>中度组>轻度组;IL-10水平与重度组<中度组<轻度组比较,差异有统计学意义(P<0.05)。见表3。

表3 不同病情程度组患者TLR2、TLR4、NF-κB、IL-1β、TNF-α、IL-10及MPO活性比较
2.3 影响UC患者预后的单因素分析
单因素分析结果显示,预后不良组病理组织分级、UCEIS评分、DAI评分分级、TLR2、TLR4、NF-κB、IL-1β、TNF-α、IL-10及MPO活性与预后良好组比较,差异有统计学意义(P<0.05);而两组间性别、年龄、病程、病变位置比较,差异无统计学意义(P>0.05)。见表4。
表4 影响UC患者预后的单因素分析
2.4 影响UC患者预后的多因素分析
Logistics回归分析结果显示,UCEIS评分>6分、TLR2、TLR4、NF-κB、IL-1β、TNF-α、MPO活性升高及IL-10水平降低是影响UC患者预后不良的独立危险因素(P<0.05)。见表5。
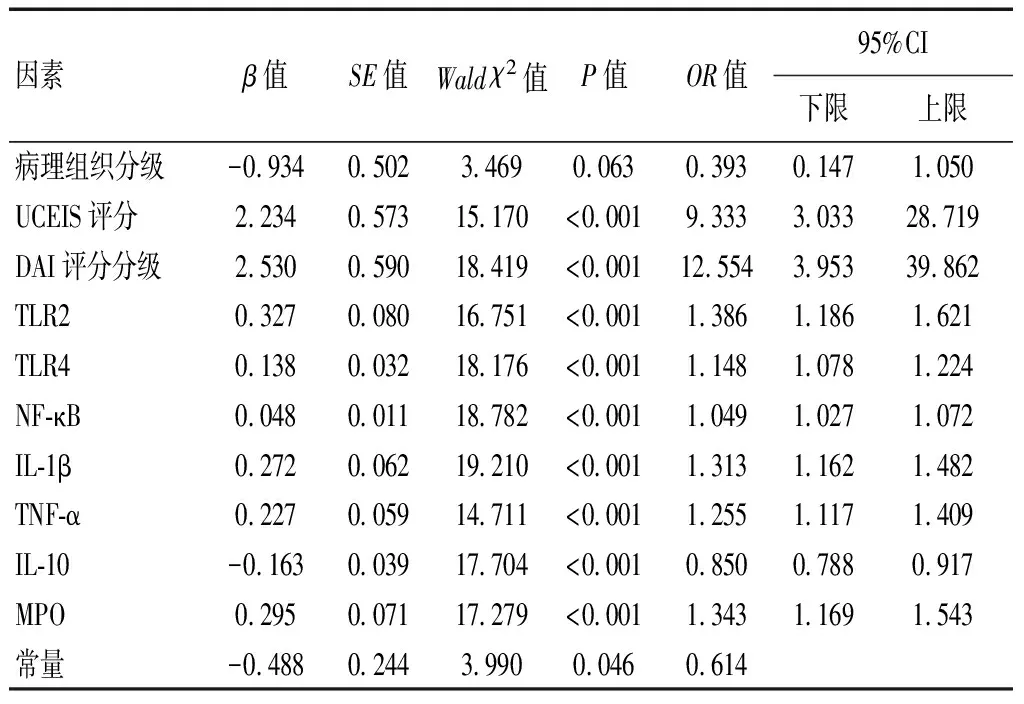
表5 影响UC患者预后不良的Logistic回归分析
2.5 TLR2、TLR4、NF-κB、IL-1β、TNF-α、IL-10、MPO活性及UCEIS评分、DAI评分分级预测UC预后不良的价值
ROC曲线分析显示, TLR2、TLR4、NF-κB、IL-1β、TNF-α、IL-10、MPO活性、UCEIS评分及DAI评分分级联合预测UC患者预后的曲线下面积(AUC)大于单项,差异有统计学意义(P<0.05)。见表6。

表6 TLR2、TLR4、NF-κB、IL-1β、TNF-α、IL-10、MPO活性、FD4水平及UCEIS评分、DAI评分分级预测UC预后不良的价值
3 讨论
UC是多种因素引起的肠道免疫系统对内部菌群免疫耐受的失衡,主要累及结肠粘膜及粘膜下层[14]。目前UC的临床诊断主要依靠临床症状、辅助检查(纤维结肠镜检、气钡灌肠双重对比造影)及相关量表评分等[15]。UCEIS评分是评估UC内镜下严重程度的一种量表型工具,可评估患者血管模式、出血和糜烂、溃疡状况[16]。一项最新研究[17]显示,应用UCEIS可准确评估UC的总体内镜下严重度。由于UC具有反复发作的特点,单纯应用内镜检查对鉴别UC存在一定局限性,故寻求更多的指标评估临床治疗效果及预后对减轻患者负担有重要意义。尽管UC的确切发病机制仍存在争议,但细胞因子在其中发挥的作用已得到公认,这也为临床诊断和治疗提供了新的思路。
免疫异常为UC的主要因素之一,不仅可破坏患者原有的肠粘膜功能,还会引起其它肠外并发症,严重影响预后。TLRs是一种跨膜受体和信号转导受体,该受体可以通过识别保守的微生物蛋白质/DNA 基序或病原体相关分子模式,可识别不同的病原微生物。肠粘膜持续的损伤可使TLR4-CD14阳性的巨噬细胞聚集,增加UC对LPS等配体的敏感性,从而触发TLR4/NF-κB信号通路,造成大量NF-κB的出现[18]。近年有研究[19]发现,NF-κB是肠道慢性炎症发生和加重的因素之一,原因在于NF-κB可改变肠粘膜中致炎细胞因子和抑炎细胞因子的表达,导致炎症反应持续发生,进而造成上皮细胞的凋亡。张颖慧等[20]探讨了Toll样受体在UC组织中的表达变化及与组织中炎性细胞因子表达的关系,发现UC患者结肠粘膜TLR2、TLR4蛋白表达阳性率远高于正常者,认为Toll样受体的异常表达与UC的发生及炎症反应程度加重关系密切。本研究与上述结果相似,且多因素Logistics回归分析结果显示,TLR2、TLR4、NF-κB表达升高是影响UC患者预后不良的独立危险因素(P<0.05),进一步提示各种病原微生物触发TLRs信号通路过度活化可能是UC发病和的始动因素之一,可通过检测UC患者TLR2、TLR4、NF-κB表达变化对病情进展及预测预后转归做出预测。
UC患者由于肠道菌群失调,宿主肠黏膜对革兰阴性菌的脂多糖的耐受性被打破,由于TLR4与革兰阴性菌的脂多糖关系密切,导致结肠粘膜上皮细胞及固有层细胞大量表达TLR4,进而激活下游的细胞因子(NF-κB等)大量释放自由基,加重黏膜损伤。同时,肠腔内的抗原物质亦可经上皮细胞,参与免疫反应,加剧炎症程度,形成恶性循环,因此TLR4的表达水平与UC患者炎症反应相关。另外,激活的NF-κB亦可激活TLR2转录表达,形成TLR2-NF-κB-TLR2循环。此外,细胞因子在UC患者的变化亦值得关注。本研究结果显示,UC患者中活动期组IL-1β、TNF-α水平较对照组高(P<0.05),IL-10水平较缓对照组低(P<0.05),且三者水平变化与病情严重程度呈相关性(P<0.05)。在炎症反应中,IL-1β、TNF-α是促炎细胞因子,IL-10则是常见的抑炎细胞因子,三者通过控制炎症发应进展,参与UC的发生、发展。
MPO是中性粒细胞中含量较高的一种酶,肠粘膜MPO活性是监测UC活动性的常用指标之一[21]。本研究结果显示,UC组织中MPO表达高于正常组(P<0.05),且在重度组患者中更为显著(P<0.05),提示MPO活性可反映结肠组织的病理损害程度,对于UC的早期诊断及预后评估有指导意义。此外,肠粘膜屏障是保证肠道功能正常运行的重要组成部分,在感染、创伤等应激反应发生时,肠粘膜屏障将受到不同程度损伤,造成通透性的改变,引起细菌移位及炎症反应[22]。因此,明确肠粘膜屏障功能的改变,对明确UC的发生及判断炎症进展有一定价值。本研究推测TLR2、TLR4、NF-κB、IL-1β、TNF-α、IL-10及MPO活性及具有预测UC预后不良的价值,经绘制ROC曲线论证,结果显示,各指标AUC以联合检测最大,提示临床在传统手段基础上,增加多项细胞因子的检测可提高预测UC患者预后的灵敏度。
综上所述,Toll-TLRs、炎性因子、NF-κB及MPO活性在UC患者中呈显著异常表达,各指标与患者病情严重程度关系密切,联合检测各指标可作为早期诊断UC及预测患者预后的有效指标。
