酯酶的药物代谢与种属差异研究进展
2022-01-07李鑫王文艳
李鑫,王文艳
(烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心 分子药理和药物评价教育部重点实验室,山东 烟台264005)
酯酶参与药物的活化和解毒过程,与药物的代谢密切相关,在体内发挥重要作用,也是前药设计主要考虑的因素。催化酯类、硫酯类和酰胺类药物水解的酯酶可分为3类:A-酯酶、B-酯酶和C-酯酶。能够有效水解有机磷[如对氧磷、甲氟膦酸异丙酯(沙林)和甲氟磷酸频哪酯(梭曼)]的酯酶,被归类为A-酯酶,对氧磷酶(paraoxonase,PON)就是典型的A-酯酶。被有机磷、氨基甲酸酯和有机硫化合物抑制的酯酶被归类为B-酯酶,羧酸酯酶(carboxylesterase,CES)、芳基乙酰胺脱乙酰酶(arylacetamide deacetylase,AADAC)、丁酰胆碱酯酶(butyrylcholinesterase,BCHE)等为B-酯酶[1]。不水解有机磷酯类并受其抑制的酯酶被归类为C-酯酶,羧甲烯丁烯羟酸内酯酶就是C-酯酶[2]。2008—2018年,美国食品和药品管理局(FDA)已批准上市30个前药,占批准上市的小分子化合物的12%以上[3]。2020年,FDA批准3个前药,约占批准上市的小分子药物的8%,目前仍然有10个以上的前药正处于临床试验阶段,如NUC-1031、OBI-3424、BSM-582664等[4]。这些已上市的前药中50%以上均是酯类前药,FDA申报资料中报道约18个前药经酯酶水解发挥活性,包括CES、BCHE以及其他的非特异性酯酶。如2015年上市药物艾沙康唑硫酸酯(esaconazole sulfate),主要通过血液中的BCHE水解为艾沙康唑发挥抗真菌作用,2017年FDA批准上市的telotristat etiprate是羧酸酯类前药,羧基乙酯化目的是增加脂溶性来提高体内的吸收。对于uridine triacetate、fesoterodine、gabapentin enacarbil这些经非特异性酯酶水解发挥作用的前药,目前尚不知具体参与代谢的酶,更加迫切地需要了解体内参与药物水解的酯酶,以探究联合用药时发生药物间相互作用的可能性。
本文主要关注CES、AADAC、BCHE、PON在药物代谢中的应用,对这几种酯酶的组织分布、底物及特异性抑制剂和种属差异进行总结,以期为相关研究提供参考。
1 酯酶的组织分布
酯酶的独特组织分布为设计用于组织靶向的前药提供了巨大的机会,因此有必要了解体内酯酶的分布,下文对人体内主要的酯酶进行分述。
1.1 羧酸酯酶
CES是一类重要的丝氨酸水解酶家族,根据遗传序列哺乳动物CES可以分为6个家族:CES1、CES2、CES3、CES4、CES5和 CES6[5]。 在 人 体中,CES1、CES2 mRNA在肝中高度表达;CES1 mRNA在心、胃、睾丸、肾、脾和结肠中表达量较少;CES2 mRNA在小肠中高度表达,在心、结肠中也有表达;CES3在脑、肝、结肠处表达;而对CES4、CES5在人体内的研究较少。其中CES1、CES2在药物代谢中起到重要的作用。CES存在于胞浆中[6],CES1由567个氨基酸组成,相对分子质量为62 521,以单体、三聚体、六聚体形式存在,主要在肝中表达,小肠中几乎不表达。CES2由559个氨基酸组成,相对分子质量为61 807,以单体形式存在,主要在小肠中表达,在肝、肾中也有表达[7]。
1.2 芳基乙酰胺脱乙酰酶
AADAC是一种微粒体丝氨酸酯酶,相对分子质量约45 000,存在于内质网的腔体侧[8],在人体内主要在肝和胃肠道表达,膀胱中也有表达,在肺和肾微粒体中不表达[9-10]。
1.3 丁酰胆碱酯酶
BCHE的mRNA在人肝中表达量最高,其次是肺、脑、心、骨骼肌、胰腺和肾[11];其蛋白主要位于粗面内质网。BCHE在肝中以单体或二聚体的形式存在。此外,BCHE还存在于血浆中,是由在肝中合成的BCHE分泌到血液中,在血浆中以四聚体的形式存在,大部分的BCHE以单体形式存在[12]。
1.4 对氧磷酶
PON家族至少有3个成员,包括PON1、PON2和PON3。PON1是PON家族中发现最早,研究最多的成员,PON1定位于内质网的腔侧,并在脂质转移中起作用[13],PON1 mRNA仅分布于成人的肾、肝、结肠以及胎儿的肝,PON2在人体内表达于除血浆外的组织,PON2 mRNA更广泛地分布在成人的脑、心、肾、脾、肝、结肠、肺、小肠、肌肉、胃、睾丸、胎盘、唾液、甲状腺、肾上腺、胰腺、皮肤和骨髓,以及胎儿的大脑和肝中[14]。PON1和PON3主要在肝中合成并分泌到血浆中,与高密度脂蛋白紧密结合[15]。PON基因产物血清PON在有机磷神经毒剂解毒中起重要作用,其基因多态性与脑卒中、动脉粥样硬化、冠心病及2型糖尿病发病等有密切关系[16]。
2 酯酶的底物
了解酯酶的底物,从底物的化学结构出发,对不同酯酶底物的结构进行规律总结,为前药设计提供合理依据。表1总结了酯酶的代表性底物及药代动力学参数,下面对不同酯酶水解的底物进行分述。
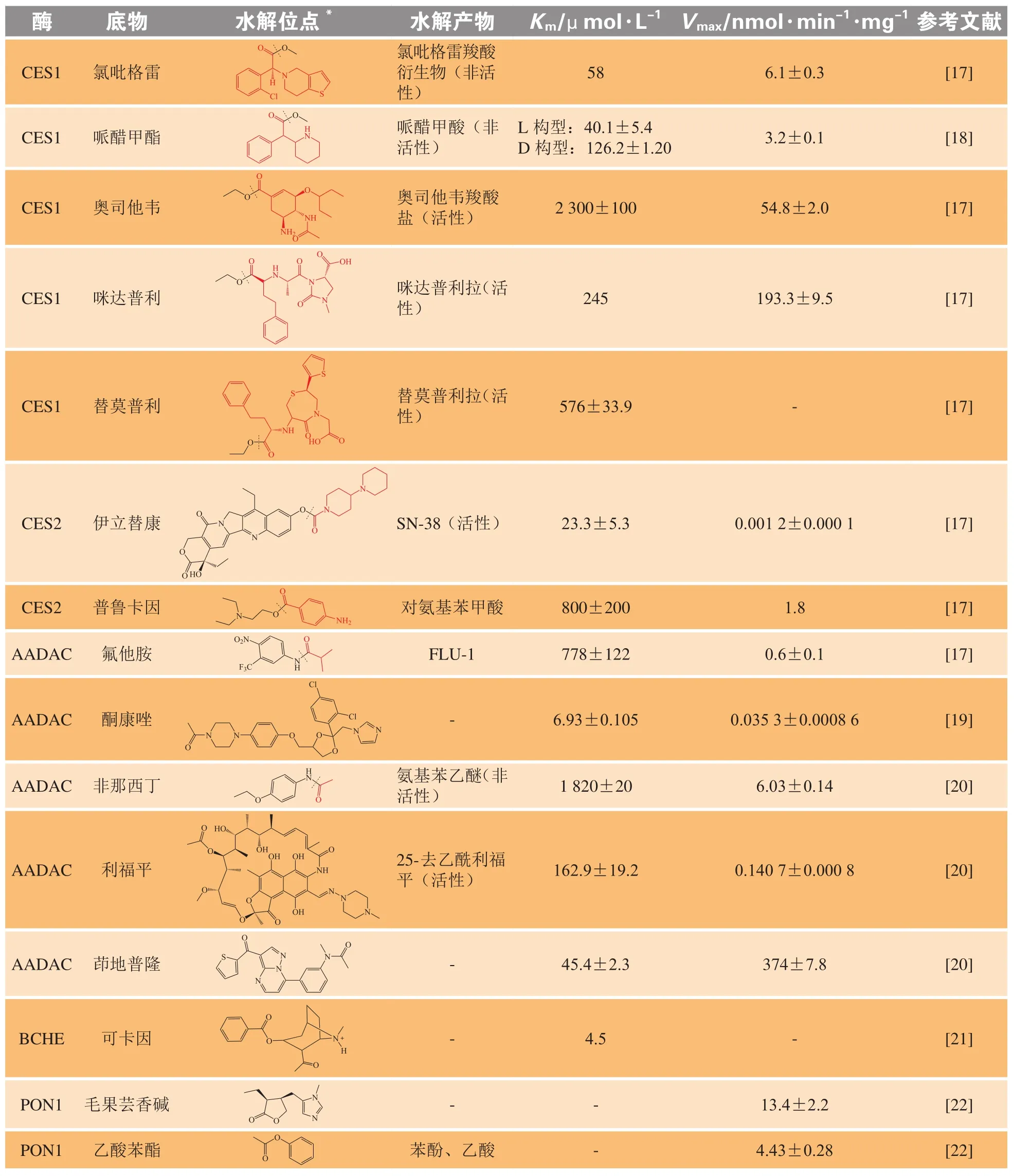
表1 酯酶代表性底物及药代动力学参数Table 1 Representative substrates and kinetic parameters of esterase
2.1 羧酸酯酶
CES主要催化酯键、酰胺键、硫酯键等的水解。CES1偏向水解含有较小乙醇基和较大酰基的底物如氯吡格雷、哌替啶、奥司他韦及几种血管紧张素转换酶抑制剂如咪达普利、依那普利、特莫卡普利等,还包括海洛因与可卡因这类毒品[23]。同时CES1参与生理和病理过程,例如在脂质代谢、胆固醇稳态和脂肪肝疾病等中负责水解大量内源性酯如胆固醇酯和三酰甘油。CES2偏向于水解含有较大乙醇基和较小酰基的底物如伊立替康、普拉格雷、卡培他滨、氟他胺、普鲁卡因等[17]。CES2在肝脏中的表达和功能与几种代谢性疾病密切相关,如肥胖症和非酒精性脂肪性肝炎,负责水解三酰甘油和二酰甘油。CES的大部分底物是前药,因此要考虑参与水解的酶的亚型。
2.2 芳基乙酰胺脱乙酰酶
Kurokawa等[24]研究发现,普拉格雷水解不仅是由人CES催化的,而且还由AADAC催化。因为CES1和CES2在犬肠中不表达,所以在犬的肠中AADAC主要参与水解。因此AADAC是药物开发中需要考虑的一种重要酯酶。从AADAC底物的
化学结构来看AADAC倾向于水解较大醇基和较小酰基的底物,如氟他胺[17]、酮康唑、非那西丁[20]、利福平[21]和茚地普隆等。Fukami 等[25]比较了人AADAC和CES的底物特异性发现,氟他胺、二乙酸荧光素可以由AADAC和CES2共同水解,表明AADAC与CES2的底物有一定的重叠。
2.3 丁酰胆碱酯酶
BCHE以非常快的速率水解丁酰胆碱,还可水解丙酰胆碱、乙酰胆碱、苯甲酰胆碱、琥珀酰胆碱[26],米拉贝隆、可卡因也是BCHE的底物。有研究者总结了经人血浆酯酶水解的临床相关化合物如伊立替康、间羟舒喘灵酯、氟司洛尔、醋酸甲基强的松龙等均可由BCHE水解[27]。
2.4 对氧磷酶
沙林是最为熟知的PON底物,毛果芸香碱[22]也是PON1的底物。NM441是新喹诺酮羧酸抗菌剂NM394的前药,Tougou等[28]研究鉴定NM441的水解酶为大鼠血清PON。糖皮质激素γ-内酯和环状碳酸酯也是PON的底物。有报道认为,有机磷酸酯和乙酸苯酯可用作PON1的特异性底物;二氢香豆素是目前已报道的PON2底物,酰基高丝氨酸内酯可用作PON2的相对特异性底物;洛伐他汀、辛伐他汀和螺内酯可作为PON3的底物[29]。
3 酯酶的抑制剂
在样品收集、存储和分析过程中,稳定的含酯的前药是成功开发和验证分析物浓度以进行安全性和暴露评估的生物分析检测方法的关键步骤。在方法开发阶段尽早使用酯酶抑制剂,因此了解不同类型的酯酶抑制剂更有利于酯类前药生物样品分析方法的开发,表2对酯酶的特异性抑制剂进行总结,以下对不同类别的酯酶抑制剂进行分述。
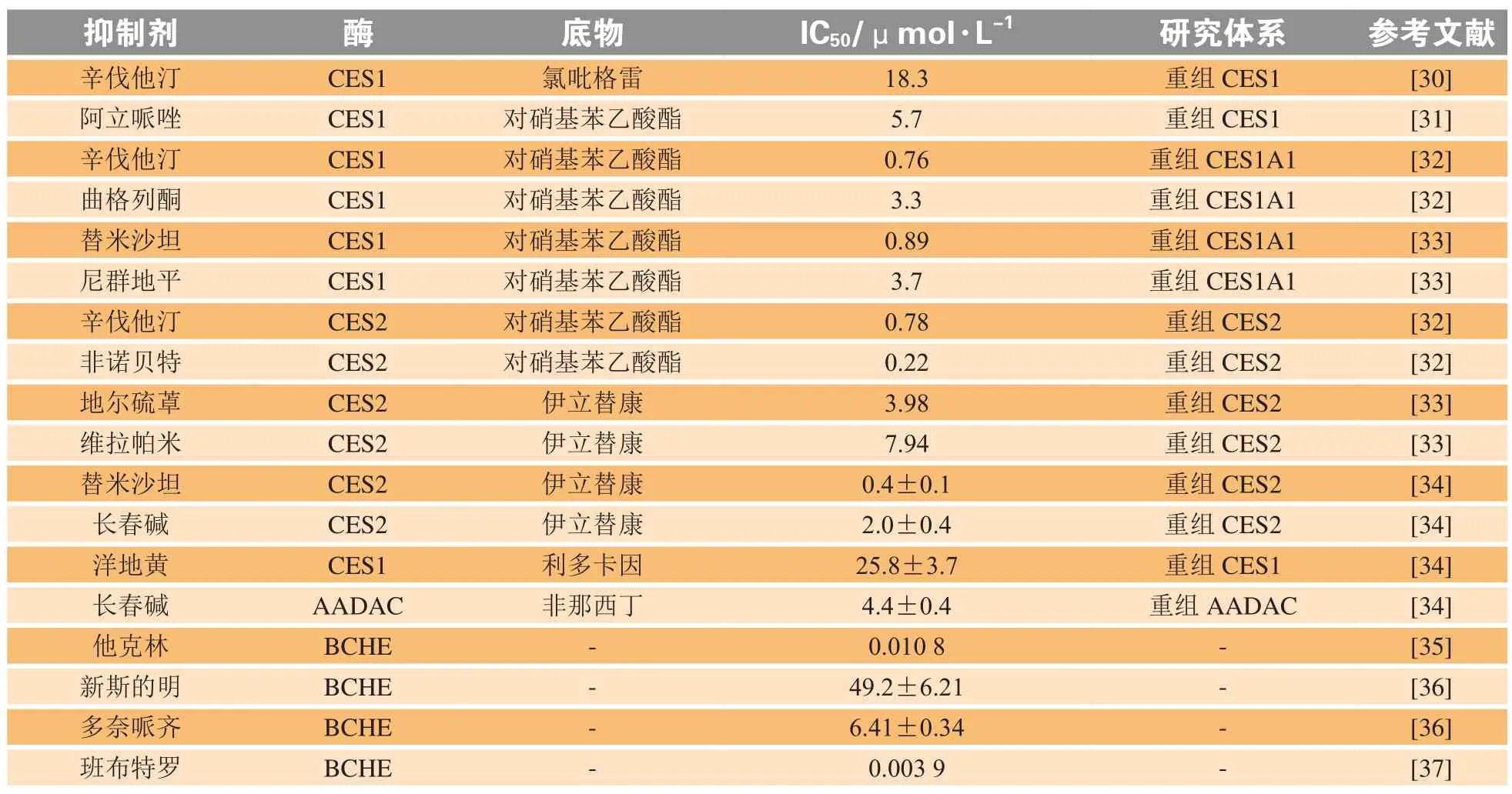
表2 酯酶的特异性抑制剂及IC50值Table 2 Specific inhibitors of esterase and IC50 values
3.1 羧酸酯酶
CES是丝氨酸酯酶,因此它的酶活性可以被有机磷、二异丙基氟磷酸(DFP)、双(4-硝基苯基)磷酸酯(BNPP)和苯甲基磺酰氟(PMSF)等一般的丝氨酸酯酶抑制剂所抑制。目前已报道:替米沙坦、尼群地平、辛伐他汀可以抑制CES1;非诺贝特、辛伐他汀、卡维地洛、地尔硫䓬、毒扁豆碱、洛哌丁胺可以抑制CES2[23]。除了以上药物对CES有抑制作用外,常用的药物赋形剂对CES也有抑制作用,如十二烷基硫酸钠、聚氧乙烯氢化蓖麻油对CES1有抑制作用,而吐温20对CES2有抑制作用。另外许多天然产物及结构改造物对CES也有抑制作用:一些天然黄酮类化合物对CES1和CES2都有抑制作用[38-39],石吊兰素是CES1的抑制剂[40],光甘草定对CES2有强烈的抑制作用[41];齐墩果酸和熊果酸这2种五环三萜类化合物对CES1具有很强的抑制作用[42]。
3.2 芳基乙酰胺脱乙酰酶
DFP也是AADAC的抑制剂[43]。目前尚未发现AADAC的特异性抑制剂,但长春碱[17]对CES2和AADAC均有抑制作用,对CES1无明显抑制作用。毒扁豆碱能有效地抑制CES2和AADAC,可作为AADAC的特异性抑制剂。
3.3 丁酰胆碱酯酶
BCHE也是丝氨酸酯酶,可以被DFP、PMSF抑制,但BNPP对BCHE的抑制效果不强。BCHE还可以被奎尼丁、乐果与各种有机氯和氨基甲酸酯农药所抑制[26]。金丝梅、连翘叶[44]等常用中药提取物对BCHE也有一定的抑制作用。BCHE具有代表性的抑制剂有四异丙基焦磷酸亚胺(iso-OMPA)[45]、他克林[35]、溴吡斯的明、新斯的明、多奈哌齐[46]、班布特罗[47]。
3.4 对氧磷酶
PON受氯化汞和4-(羟基汞)苯甲酸钠的抑制。因为PON需要钙维持其活性和稳定性,所以乙二胺四乙酸(EDTA)可以高度抑制PON。目前尚没有为每个PON特定的抑制剂。
4 酯酶的种属差异
在药物开发中,实验动物经常用于预测代谢途径并评估候选药物的毒性,但有时药物代谢酶的物种差异导致推测在人体内的药代动力学行为困难。在人、猴、犬、兔、大鼠和小鼠中,均存在着共同的BCHE和PON。BCHE存在于所有物种的血浆中,尚未报道有PON的组织分布中的物种差异,故本文主要讨论了CES和AADAC的种属差异,为临床前研究选择实验动物、预测酯类前药在人体的药代动力学提供依据。
4.1 羧酸酯酶
人类的CES主要有6个亚型,CES1、CES2主要参与药物的水解,人类CES1和CES2家族均只有一个亚型,但在啮齿类动物中,ces1和ces2家族均存在多种亚型,表3为不同种属中CES的组织分布。在大鼠中,ces1家族有5个亚型(ces1a、ces1b、ces1c、ces1d和 ces1f),ces2家族有 7个亚型(ces2a、ces2b、ces2c、ces2d、ces2e、ces2f、ces2g);在小鼠中,ces1家族有8个亚型(ces1a、ces1b、ces1c、ces1d、ces1e、ces1f、ces1g、ces1h),ces2家 族 有 8个 亚 型(ces2a、ces2b、ces2c、ces2d、ces2e、ces2f、ces2g、 ces2h)[5]。在食蟹猴中,有3个ces1亚型(ces1a、ces1b和ces1c),3个ces2亚型(ces2a、ces2b和ces2c)。在大鼠肝中ces1的表达高于ces2,这与人类很相近[48]。然而食蟹猴ces1a mRNA在肝中的表达水平比ces1b高19倍,ces2a mRNA在肝中表达水平比ces2b高56倍,但ces2c在肝中不表达,在空肠和肾中表达[49]。在大鼠小肠中ces1与ces2均有表达,而人小肠不表达CES1,犬小肠内无ces。此外,ces1在大鼠肾中表达,在小鼠肾中高表达,CES1在人肾中不表达。

表3 不同种属羧酸酯酶组织分布Table 3 Tissue distribution of carboxylesterase in different species
Rudakova等[50]研究人、大鼠、小鼠血浆中的酯酶活性发现,人血浆中胆碱酯酶活性最高,CES活性可以忽略不计,但大鼠、小鼠血浆中ces活性最高,且小鼠ces活性高于大鼠,而犬血浆中缺乏ces[44],从血浆中酯酶活性与种类来看,犬的血浆更接近于人[51]。在大多数实验动物中,ces2主要在肠中表达,猴小肠中表达ces1和ces2;人、大鼠、小鼠小肠中只表达ces2,但酶的表达量有差异,比格犬小肠中无ces[52]。Igawa等[53]研究食蟹猴与人肠道水解酶的活性差异发现,食蟹猴中肠水解对普萘洛尔衍生物显示对映选择性水解,猴肠道ces2具有对映选择性,选择猴作为实验动物来推测前药在人体肠道内的水解可能是不准确的,这种情况下可以通过同源性建模和对接模拟来预测底物可被CES2水解的程度,以提升对药物代谢的预测能力。然而采用Caco-2细胞评价药物在小肠的吸收能力时,由于Caco-2细胞主要表达CES1,与人肠道表达CES2相反,在评价经CES代谢的前药时其结果可能是不准确的,对此早期研究人员采用在Caco-2细胞中添加BNPP抑制CES来评价前药的吸收能力,但此种方法不适用于高通量筛选。目前研究人员已建立了具有与人小肠相似的低表达CES1的新型Caco-2来评价前药渗透性[54-55],这将更加准确反映前药在肠道的渗透性。Nishimuta等[56]研究几种前药的清除率时发现,在所研究的物种(猴、犬、大鼠)中,霉酚酸酯和替莫卡普利在猴肝细胞中的水解与人肝细胞最相似,大鼠与人的差别最大。对于低清除率的前药,使用肝细胞来预测水解速率比较准确;对于高清除率的前药,使用肝S9数据来预测可以减少差异。
抗血小板药物维卡格雷处于临床开发阶段,经过CES水解后再经细胞色素(CYP)酶代谢为活性代谢物,研究发现其第一步水解主要由肠道酯酶CES2介导,Qiu等[57]研究维卡格雷在犬和大鼠体内的药代动力学发现,灌胃给药后,维卡格雷经水解后生成2-氧代氯吡格雷,由于人和大鼠在胃肠道具有相似的CES2,人肠中活性代谢产物的产生可能与大鼠最相似。BMS-936561(αCD70_MED-A)是一种抗体-药物结合物,MED-A是一种氨基甲酸酯前体药物,由CES激活,形成MED-B,发挥其DNA烷基化活性[58]。体外血清稳定性研究表明,αCD70_MED-A中氨基甲酸酯保护基团的水解效率遵循顺序为小鼠>大鼠>猴子>犬、人。由于人血浆中没有CES,犬与猴血浆与人类似,采用猴的药代动力学参数和在犬中水解速率常数预测人体内药代动力学与临床结果相一致。综上所述,大鼠小肠ces特性与人较为相似,考虑血浆酯酶活性与水解速率则发现比格犬血浆更接近人,而猴肝中的ces 酶活性与人较为相似,故了解酯酶的种属差异后,可以结合多个种属的数据结果进行预测。
4.2 芳基乙酰胺脱乙酰酶
在人中,AADAC的mRNA在肝和胃肠道中高表达,在膀胱中中度表达,在肾和肺中不表达。在食蟹猴中AADAC在肝和肠中表达,在大鼠和小鼠肝脏中AADAC mRNA表达水平最高,其次是胃肠道和肾,但大鼠肝中AADAC表达水平为小鼠的1/10[49],与雄性大鼠相比,雌性大鼠组织中AADAC 的mRNA表达高约1.5 ~ 3.0倍[10]。AADAC表达水平的性别差异在小鼠中未检测到[59]。AADAC是导致人非那西丁水解的主要酶[20],重组人和小鼠AADAC对非那西丁水解的催化效率高于大鼠AADAC[59],而食蟹猴肝中非那西丁的水解活性显著高于人。姜金方等[10]已报道,利福平不会被大鼠或小鼠的AADAC水解,也不会被犬AADAC水解[17],也不会被食蟹猴AADAC水解,但利福平会被人的AADAC特异性水解[18],在人血浆中检测到利福平的水解代谢物25-去乙酰利福平[60],在大鼠、兔血浆中未检测到。因此,25-去乙酰利福平很可能是在人体内形成的一种特殊代谢物。普拉格雷由人体肠道CES2水解,但在犬肠道可以水解,证明AADAC是参与犬肠道普拉格雷水解的酶[24]。在临床前药物开发研究中,对于AADAC的底物特异性与种属差异要引起注意。
5 结语
为了改善药物的一些不良因素如水溶性低、不良味道;或者改善药代动力学上一些影响药效发挥的因素如易降解、半衰期太长或太短、药物透膜能力低、缺乏理想的特异性(靶向性)等,可以将药物设计成前药类型。对酯酶研究的深入,可以指导新药的合理设计,特别是酯类前药。本文总结了酯酶的分布、底物、抑制剂及种属差异,期望对药物设计特别是前药设计方面提供思路,为药物在不同种属中的药代动力学差异给出合理解释。
